
- DAZ.online
- DAZ / AZ
- DAZ 36/2020
- Aus zwei mach eins: ...
Arzneimittel und Therapie
Aus zwei mach eins: Trastuzumab-Deruxtecan
Beschleunigtes Zulassungsverfahren für Antikörperkonjugat
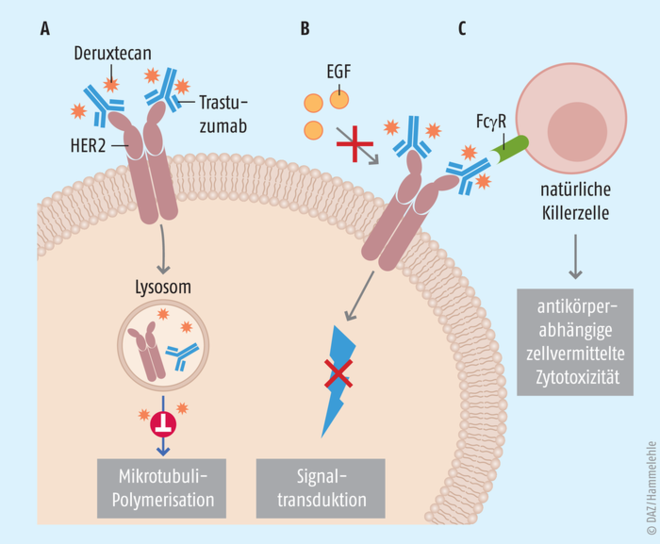
HER2-positive Mammakarzinome gelten als besonders aggressive Tumoren mit schlechter Prognose. Bei diesen Tumoren sind besonders viele HER2-Rezeptoren, welche die Bindungsstelle des Wachstumsfaktors Epidermal Growth Factor (EGF) darstellen, auf der Zelloberfläche zu finden. Grundsätzlich möchte man in der Tumorbehandlung möglichst gezielt die Krebszellen bekämpfen und gleichzeitig so wenig wie möglich gesunde Zellen in Mitleidenschaft ziehen. Diesem Ziel ist man durch die geschickte Kombination eines Antikörpers mit einem Zytostatikum einen großen Schritt näher gekommen. Trastuzumab-Deruxtecan ist ein Antikörper-Wirkstoff-Konjugat, bei dem der Antikörperanteil über einen spaltbaren Linker mit einem zytotoxischen Topoisomerase-Hemmstoff verbunden ist. Der Antikörperanteil dockt an die entsprechenden Zielzellen – in diesem Fall an den HER2-Rezeptor der Brustkrebszellen – an und internalisiert das Zytostatikum nach Ablösen von dem Linker in die HER2-positive Mammakarzinomzelle (s. Abb). Nur dort wirkt der Mitosehemmstoff zytotoxisch, gesunde Zellen werden also nicht angegriffen. Dieses Prinzip wurde bereits mit dem ersten Trastuzumab-Wirkstoff-Konjugat (Trastuzumab-Emtansin; Kadcyla®) verfolgt.
Abb.: Über verschiedene Mechanismenwird die Krebszelle zerstört: Zum einen wird durch Bindung des Antikörper-Wirkstoff-Konjungats (AWK) und anschließender Internalisierung und enzymatischer Freisetzung von Deruxtecan die Mikrotubuli-Polymerisation der Zelle verhindert (A). Zum anderen ist die Bindungsstelle des Wachstumsfaktors EGF an HER2 durch Trastuzumab blockiert (B). Natürliche Killerzellen binden über FcγR an das Fc-Ende des an der Zielzelle haftenden Trastuzumab und zerstören anschließend die Krebszelle durch Lyse oder Apoptose (C).
CHMP empfiehlt Zulassung
Nach Prüfung der bereits vorliegenden Daten sprach sich der für Humanarzneimittel zuständige Ausschuss CHMP (Committee for Medicinal Products for Human Use) der europäischen Genehmigungsbehörde EMA im Juni 2020 für ein beschleunigtes Zulassungsverfahren für Trastuzumab-Deruxtecan aus. Die Zulassung erstreckt sich auf die Therapie erwachsener Patientinnen mit einem nicht resezierbaren oder metastasierten HER2-positiven Mammakarzinom, die mindestens zwei HER2-basierte Vortherapien erhalten haben.Der Zulassungsantrag basiert auf den positiven Ergebnissen der pivotalen Phase-II-Studie DESTINY-Breast01, die eine Trastuzumab-Deruxtecan-Monotherapie bei Patientinnen mit HER2-positivem metastasiertem Mammakarzinom mit mindestens zwei vorhergehenden Anti-HER2-Therapien untersuchte. Aufgrund der Ergebnisse dieser Studie erteilte die amerikanische Zulassungsbehörde FDA bereits im Dezember 2019 eine behördliche Genehmigung für Trastuzumab-Deruxtecan (Enhertu®).
Gute Ergebnisse in der Zulassungsstudie erzielt
Die Destiny-Breast01-Studie ist eine zweiteilige, offene, multizentrische Phase-II-Studie. Teil 1 befasste sich mit der Dosisfindung, Teil 2 mit der Sicherheit und Wirksamkeit. Der primäre Studienendpunkt von Teil 2 war das objektive Ansprechen; sekundäre Endpunkte ermittelten unter anderem die Sicherheit, die Dauer der Response, die Rate des klinischen Benefits sowie das progressionsfreie Überleben. Insgesamt erhielten 184 Brustkrebspatientinnen, die im Median sechs vorherige Behandlungen erhalten hatten, die empfohlene Dosis Trastuzumab Deruxtecan (5,4 mg pro Kilogramm Körpergewicht). Die Intention-to-Treat-Analyse ermittelte für 112 Patienten ein Ansprechen auf die Therapie (60,9%; 95% -Konfidenzintervall [KI], 53,4 bis 68,0). Die mediane Dauer des Follow-up betrug 11,1 Monate (Bereich 0,7 bis 19,9). Die mediane Ansprechdauer lag bei 14,8 Monaten (95% KI, 13,8 bis 16,9) und die mediane Dauer des progressionsfreien Überlebens bei 16,4 Monaten (95% KI, 12,7 bis nicht erreicht).
Die häufigsten unerwünschten Ereignisse (Grad 3 oder höher) waren eine verringerte Neutrophilenzahl (bei 20,7% der Patienten), Anämie (bei 8,7%) und Übelkeit (bei 7,6%). Ferner war das Antikörper-Wirkstoff-Konjugat bei 13,6% der Patienten mit einer interstitiellen Lungenerkrankung unterschiedlicher Schwere assoziiert. Diese unerwünschten Wirkungen erfordern ein sorgfältiges Monitoring der Patientinnen.
Derzeit wird Trastuzumab-Deruxtecan in einem umfangreichen Studienprogramm bei mehreren HER2-exprimierenden Tumorentitäten, einschließlich Mamma-, Magen- und Bronchialkarzinom untersucht. Darüber hinaus sind Studien zu Kombinationen mit anderen onkologischen Therapien – einschließlich Immuntherapien – geplant oder werden bereits durchgeführt. |
Literatur
Beschleunigtes Zulassungsverfahren für Trastuzumab Deruxtecan zur Behandlung des HER2-positiven metastasierten Mammakarzinoms durch EMA zugesprochen. Pressemitteilung von Daiichi Sankyo und AstraZeneca 6. Juli 2020
Modi S et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med 2020; 382:610-621. DOI: 10.1056/NEJMoa1914510
A Study of DS-8201a in Metastatic Breast Cancer Previously Treated With Trastuzumab Emtansine (T-DM1), https://clinicaltrials.gov/ct2/show/NCT03248492, Aufruf am 16. Juli 2020
Mammakarzinom der Frau, Informationen der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie e.V., www.onkopedia.com/de/onkopedia/guidelines/mammakarzinom-der-frau/@@guideline/html/index.html, Abruf am 27. August 2020




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.