
- DAZ.online
- DAZ / AZ
- DAZ 53/2020
- Neue Arzneimittel 2020
Neue Arzneimittel
Neue Arzneimittel 2020
Antianämika
Luspatercept
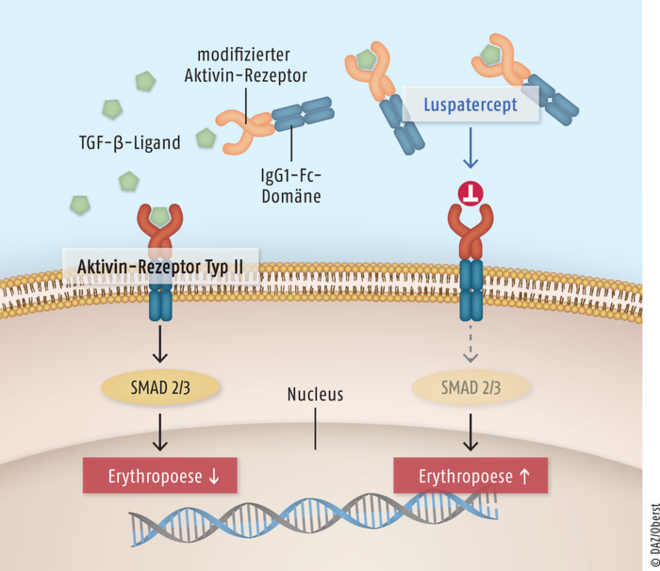
Die myelodysplastischen Syndrome sind eine heterogene Gruppe von Erkrankungen des Knochenmarks, die überwiegend im höheren Alter auftreten (Altersleukämie), aber auch Vorstufe einer akuten Leukämie sein können. Das mediane Erkrankungsalter liegt bei etwa 75 Jahren. Bei den Betroffenen sind genetisch veränderte Stammzellen nicht mehr in der Lage, vollständig reife und funktionstüchtige Blutzellen zu bilden. Neben einer verstärkten Blutungsneigung und Infektanfälligkeit geht vor allem die Erythrozyten-Konzentration stark zurück, daher ist eine regelmäßige Transfusion von Erythrozyten und Thrombozyten erforderlich. Damit besteht aber langfristig die Gefahr einer schweren Eisenüberladung mit assoziierten Organschädigungen, die mediane Überlebenszeit liegt bei etwa ein bis fünf Jahren. Auch bei Patienten mit β-Thalassämie sind regelmäßige Transfusionen mit Erythrozyten-Konzentraten erforderlich. Für beide Patientengruppen stellt der neue Erythrozyten-Reife-Aktivator Luspatercept als Alternative zu Eythropoietin einen gewissen therapeutischen Fortschritt dar. Die TGF-β-Liganden-inaktivierende Substanz hat einen völlig innovativen Wirkmechanismus. Der Wirkstoff bindet an die Liganden des Transforming-Growth-Factor-β (TGF-β) und hebt so deren hemmenden Effekt auf die Erythropoese auf (Abb. 1). So wird die Erythrozyten-Reifung begünstigt und ein Anstieg der Hämoglobin-Werte erreicht. Nach subkutaner Applikation von Luspatercept kommt es zu einer Erhöhung der Hämoglobin-Werte und zur Senkung der Transfusionslast. Bei einem Großteil der Patienten kann die Zahl der erforderlichen Erythrozyten-Transfusionen relevant reduziert werden, viele bleiben sogar über mehrere Jahre transfusionsunabhängig.
Abb. 1: Bei Patienten mit myelodysplastischem Syndrom oder β-Thalassämie sind bestimmte Liganden der Transforming-Growth-Factor-β(TGF-β)-Gruppe überexprimiert. Diese Zytokine führen über eine Bindung an den Aktivin-Rezeptor Typ IIB und die Aktivierung des nachgeschalteten SMAD2/3-Signalwegs zu einer Hemmung der Erythropoese (links). Luspatercept, ein Fusionsprotein aus einem modifizierten Aktivin-Rezeptor und einer humanen IgG1-Fc-Domäne bindet an die TGF-β-Liganden und hebt so deren hemmenden Effekt auf die Erythropoese auf (rechts). Durch den Einsatz des Erythrozyten-Reifungs-Aktivators benötigen die Patienten seltener eine Transfusion mit Erythrozyten-Konzentrat.
Antiandrogene
Darolutamid
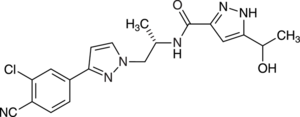
Der Androgenrezeptor(AR)-Inhibitor Darolutamid (Nubeqa®) ist für die Behandlung von Männern mit nichtmetastasiertem Kastrations-resistentem Prostatakarzinom indiziert, das vorwiegend von dem Geschlechtshormon Testosteron gesteuert wird. Der hochaffine kompetitive Androgenrezeptor-Inhibitor ist ein nichtsteroidales Antiandrogen mit einer flexiblen Pyrazolstruktur (Abb. 2). Er bindet mit hoher Affinität an die Liganden-bindende Domäne des Androgenrezeptors, so dass die Einwanderung des aktivierten Rezeptors in den Zellkern gehemmt wird. Die oral einsetzbare Substanz bewirkt eine signifikante Verlängerung der Metastasen-freien Überlebenszeit. Aber Darolutamid stellt keinen relevanten therapeutischen Fortschritt dar. Bereits seit 2013 bzw. 2019 sind Enzalutamid und Apalutamid mit identischem Wirkmechanismus verfügbar. Anders als Darolutamid sind die älteren Substanzen nicht nur für die Behandlung des nichtmetastasierten Kastrations-resistenten Prostatakarzinoms mit hohem Risiko für Metastasen, sondern auch für die Therapie von bereits metastasierten Prostatatumoren zugelassen.
Anticorticosteroide
Osilodrostat
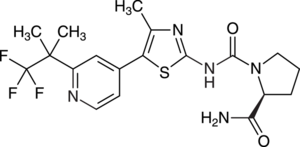
Für Erwachsene mit endogenem Cushing-Syndrom wurde der 11β-Hydroxylase-Inhibitor Osilodrostat (Isturisa®) eingeführt. Das Cushing-Syndrom ist mit einer erhöhten Plasmakonzentration von Glucocorticoiden, insbesondere Cortisol, sowie mit Hyperglykämien assoziiert. Der neue Wirkstoff hemmt die 11β-Hydroxylase (CYP11B1) und damit den letzten Biosyntheseschritt des Hormons Cortisol in der Nebennierenrinde. Neben einer Normalisierung der endogenen Cortisol-Spiegel kommt es zu einer Akkumulation von Cortisol-Vorstufen wie 11-Desoxycortisol und einer beschleunigten Biosynthese von weiteren Nebennierenrinden-Hormonen, einschließlich Androgenen. Aufgrund der sinkenden Cortisol-Konzentration wird bei den Cushing-Patienten im Rahmen der Rückkopplung eine Verstärkung der ACTH-Sekretion und der Steroidbiosynthese beobachtet. Für Patienten, die nicht ausreichend auf chirurgische Maßnahmen ansprechen, stehen bereits seit Jahren die Adrenostatika Metyrapon und Pasireotid als Mittel der zweiten Wahl zur Verfügung. Diese können die verbleibende Steroidsynthese unterdrücken. Ob nun der neue Cortisol-Synthesehemmer Osilodrostat einen relevanten therapeutischen Fortschritt darstellt, ist derzeit fraglich. Von Metyrapon unterscheidet er sich lediglich durch eine längere Eliminationshalbwertszeit, sodass Osilodrostat nicht viermal, sondern nur zweimal täglich appliziert werden muss.
Antidiarrhoika und intestinale Antiphlogistika/Antiinfektiva, Antibiotika
Rifamycin
Für Erwachsene mit Reisediarrhö steht ein neues Antibiotikum zur Verfügung, mit dem sie über drei Tage behandelt werden können. Die magensaftresistenten Tabletten mit Rifamycin (Relafalk®, Abb. 3) beinhalten eine lipophile Matrix, die in einer hydrophilen Struktur verteilt ist. Der Polymerfilm zerfällt bei pH-Werten über 7, wie sie erst in tiefen Darmabschnitten zu finden sind. So wird das antibakteriell wirkende Rifamycin gezielt in Dickdarm und Rektum freigesetzt, es wird nur sehr wenig aus dem Gastrointestinaltrakt resorbiert. Die antibakterielle Wirkung von Rifamycin beruht auf einer irreversiblen Bindung an die β-Untereinheit der prokaryotischen DNA-abhängigen RNA-Polymerase. Als Folge wird die Initiierung der Transkription bzw. der bakteriellen Proteinbiosynthese gehemmt. Rifamycin wirkt bakterizid und ist gegen die meisten grampositiven und -negativen, aeroben und anaeroben Bakterien wirksam, die normalerweise Darminfektionen verursachen. Bei invasiver Enteritis ist es nicht effektiv wirksam, hier ist ein systemisch wirksames Antibiotikum notwendig.
Antiepileptika
Cannabidiol
Die Epilepsieformen Lennox-Gastaut- oder Dravet-Syndrom gelten als besonders schwer therapierbar. Cannabidiol wurde bereits seit Langem off label in Form entsprechender Öle erfolgreich zur unterstützenden Therapie von Krampfanfällen eingesetzt und steht nun als standardisierte Zubereitung Epidyolex® für Kinder ab zwei Jahren zur Verfügung. Seine genauen antikonvulsiven Wirkmechanismen sind noch nicht verstanden, sie beruhen allerdings nicht auf einer Interaktion mit Cannabinoid-Rezeptoren. Man vermutet, dass Cannabidiol die neuronale Übererregbarkeit über eine Modulation intrazellulärer Calcium-Ionen reduziert. Dies soll auf eine Beeinflussung von G-Protein-gekoppelten Rezeptoren (GPR55) und transienten Rezeptor-Potenzial-Kationenkanälen der Unterfamilie Vanilloid 1 (TRPV1) zurückzuführen sein. Ebenso wird eine Modulation der Adenosin-vermittelten Signalgebung durch Hemmung der intrazellulären Aufnahme von Adenosin diskutiert. In klinischen Studien konnte insbesondere beim Einsatz zusammen mit Clobazam eine gesteigerte antikonvulsive Wirkung erreicht werden, die signifikante Reduktion der epileptischen Anfälle führt zu einer Verbesserung der Lebensqualität der Kinder. Durch die kombinierte Anwendung beider Substanzen ist zudem eine gegenseitige Wirkungsverstärkung aufgrund von pharmakokinetischen Wechselwirkungen zu beobachten. Zum ersten Mal steht eine standardisierte, für die Indikationen Dravet- bzw. Lennox-Gastaut-Syndrom ausdrücklich zugelassene Cannabidiol-Zubereitung zur Verfügung.
Antihämorrhagika
Fostamatinib
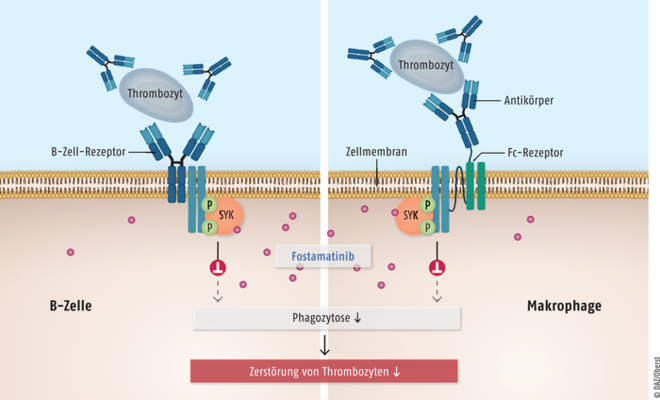
Für Erwachsene mit chronischer Immunthrombozytopenie wurde Fostamatinib (Tavlesse®) zugelassen. Die oral verfügbare Substanz hemmt die Milz-Tyrosinkinase SYK und ist für Patienten vorgesehen, die auf andere Behandlungen nicht ansprechen. Eine erworbene Immunthrombozytopenie beruht auf einer gegen Oberflächenproteine von Thrombozyten und Megakaryozyten gerichteten Autoimmunreaktion. Antikörper-markierte Thrombozyten binden als Antigen an B-Zell-Rezeptoren sowie an Fc-Rezeptoren auf Makrophagen und dendritischen Zellen in Milz und Leber und werden durch diese Antigen-präsentierenden Zellen mittels Phagozytose abgebaut.
Abb. 4: Mechanismus von Fostamatinib Bei einer Immunthrombozytopenie binden Antikörper-markierte Thrombozyten als Antigen an B-Zell-Rezeptoren auf B-Zellen (Lymphozyten) sowie an Fc-Rezeptoren von Makrophagen und werden durch Phagozytose abgebaut. Ein Auslöser der Antikörper-vermittelten Zerstörung der Thrombozyten ist die Milz-Tyrosinkinase SYK. Tamatinib, der pharmakologisch aktive Hauptmetabolit des Prodrugs Fostamatinib, reduziert als SYK-Inhibitor die Signaltransduktion von B-Zell-Rezeptoren und Fc-aktivierenden Rezeptoren. Als Folge wird die Phagozytose von Antikörper-beladenen Thrombozyten blockiert.
Bei den Betroffenen fällt die Thrombozytenzahl unter einen Grenzwert von 100.000 pro µl Blut und es kommt zu einer erhöhten Blutungsneigung. Ein Auslöser der Antikörper-vermittelten Thrombozyten-Zerstörung ist die Milz-Tyrosinkinase SYK (Spleen Tyrosine Kinase), die ein wichtiger Modulator bei der Signaltransduktion zur Aktivierung des Immunsystems in Makrophagen, Neutrophilen sowie Mast- und B-Zellen ist. Tamatinib (R406), der pharmakologisch aktive Hauptmetabolit des Prodrugs Fostamatinib, ist ein Inhibitor dieser Tyrosinkinase. Die Substanz führt zu einer Reduktion der Signaltransduktion von B-Zell-Rezeptoren und Fc-aktivierenden Rezeptoren (Abb. 4), die Phagozytose von Antikörper-beladenen Thrombozyten wird blockiert. Für Immunthrombozytopenie-Patienten stellt Fostamatinib eine gewisse Hoffnung dar. Auch wenn in den klinischen Studien nur knapp 20% der Teilnehmer auf die Therapie mit Fostamatinib ansprachen, sollte ein Therapieversuch unternommen werden, denn zumindest bei einem Teil der Patienten kann eine über Jahre anhaltende Besserung der Symptome erreicht werden.
Antineoplastische Mittel
Alpelisib
Alpelisib (Piqray®) ist ein α-spezifischer Phosphoinositid-3-Kinase(PI3Kα)-Inhibitor. Die Substanz ist zur Behandlung von Männern und postmenopausalen Frauen mit Hormonrezeptor(HR)-positivem und humanem epidermalem Wachstumsfaktor-Rezeptor-2(HER2)-negativem Brustkrebs indiziert, der lokal fortgeschritten oder metastasiert ist und eine PIK3CA-Mutation aufweist.
Diese Patienten entwickeln häufig Resistenzen gegen die endokrine Standardtherapie mit antiestrogenen Wirkstoffen. Aufgrund der schlechten Prognose der Betroffenen besteht ein hoher therapeutischer Bedarf an neuen Pharmaka. 40% der Patienten mit HR-positivem und HER2-negativem Brustkrebs haben eine Mutation im PIK3CA-Gen, das für die katalytische α-Untereinheit der Phosphatidylinositol-3-kinase kodiert. Es kommt zu einer Aktivierung des entsprechenden Signalwegs und damit zu einer Verstärkung von Tumorwachstum, -motilität und -überleben. Auf dieser Erkenntnis aufbauend, wurde das hochspezifische Alpelisib entwickelt, das die Signaltransduktion des PI3K-Wegs hemmt.
Der Wirkmechanismus ist nicht vollständig innovativ, da auch das zur Behandlung von follikulären Lymphomen und chronischen lymphatischen Leukämien eingesetzte Idelalisib hier angreift. Zwar konnte in der zulassungsrelevanten Studie eine hochsignifikante Steigerung des progressionsfreien Überlebens von sechs auf elf Monate gezeigt werden, jedoch können teilweise schwere oder lebensbedrohliche Nebenwirkungen auftreten.
Belantamab-Mafodotin
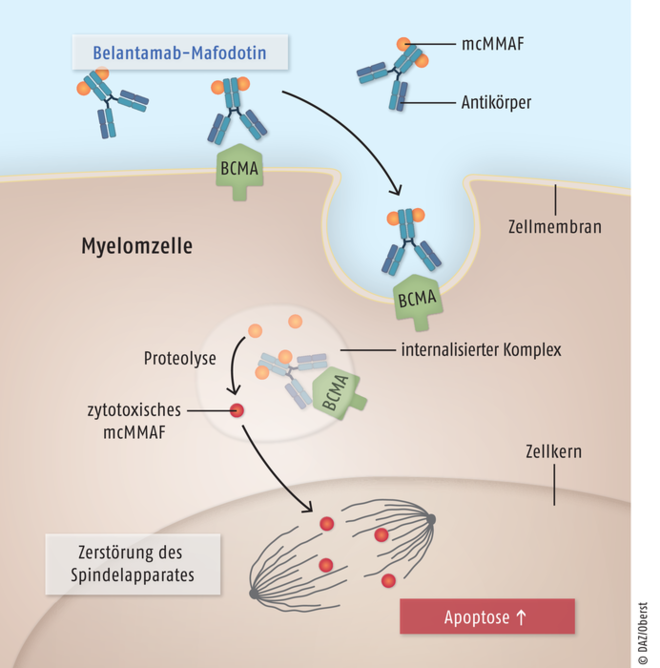
Das Antikörper-Wirkstoff-Konjugat Belantamab-Mafodotin (Blenrep®) wird als Monotherapeutikum zur Behandlung des multiplen Myeloms eingesetzt. Die zytotoxische Wirkung beruht auf dem hochpotenten Mitosehemmstoff Maleimidocaproyl-Monomethyl-Auristatin F (mcMMAF), der über das Verbindungsstück Maleimidocaproyl (Peptid-Linker „mc“) kovalent gebunden ist an einen monoklonalen Immunglobulin-G1κ-Antikörper. Dieser Antikörper-Anteil ist hochspezifisch gegen das B-Zell-Reifungsantigen (BCMA) gerichtet, das ausschließlich auf Zellen des multiplen Myeloms exprimiert wird. Proteasen im Zellinneren setzen dann die zytotoxische Komponente frei. Das Spindelgift bindet während der Zellteilung an Mikrotubuli und zerstört diese (Abb. 6).
Abb. 6: Das Antikörper-Wirkstoff-Konjugat Belantamab-Mafodotin bindet mit seinem Antikörperbereich an das Oberflächenprotein B-Zell-Reifungsantigen (B cell maturation antigen, BCMA) von Myelom-Zellen. Der gebildete Komplex wird zusammen mit dem kovalent an den Antikörper gebundenen Spindelgift Maleimidocaproyl-Monomethyl-Auristatin-F (mcMMAF) in die Zelle aufgenommen. Durch Proteolyse kommt es zur Abspaltung der zytotoxischen Komponenten vom Antikörper. mcMMAF bindet während der Zellteilung an Mikrotubuli des Spindelapparates, zerstört diese und löst Apoptose aus. So wird bei Patienten mit multiplem Myelom eine gezielte Eliminierung der maligne entarteten B-Zellen erreicht.
Belantamab-Mafodotin ist nach derzeitigem Kenntnisstand als therapeutischer Fortschritt einzuordnen. Das Wirkprinzip mit einem Konjugat aus zielgerichtetem Antikörper, der eine zytotoxische Substanz freisetzt, ist zwar nicht neu. Die Wirkung von Polatuzumab-Vedotin (s. u.) zur Behandlung des diffusen großzelligen B-Zell-Lymphoms beruht auch auf diesem Mechanismus. Allerdings ist Blenrep® die erste zugelassene Therapie, die auf einer spezifischen Bindung an das für Myelom-Zellen charakteristische B-Zell-Reifungsantigen beruht, und in der zulassungsrelevanten Studie sprachen immerhin etwa ein Drittel der austherapierten Patienten an.
Axicabtagen-Ciloleucel
Für die Behandlung von rezidivierten oder refraktären großzelligen B-Zell-Lymphomen steht als weiteres CAR-T-Zell-Präparat Axicabtagen-Ciloleucel (Yescarta®) zur Verfügung. Die für jeden Patienten individuell hergestellte „lebende“ Immunzell-Therapie auf Basis autologer T-Zellen wird nach mindestens zwei erfolglosen systemischen Behandlungen eingesetzt. Axicabtagen-Ciloleucel bindet an CD19-exprimierende Krebszellen und normale B-Zellen. Es werden nachgeschaltete Signalkaskaden aktiviert, die bei den T-Zellen zu Aktivierung, Proliferation, Erlangung von Effektorfunktionen und Sekretion von inflammatorischen Zytokinen und Chemokinen führen. Diese Abfolge von Ereignissen führt zur Apoptose und Nekrose der CD19-exprimierenden Zielzellen. Die Behandlung mit Axicabtagen-Ciloleucel ist höchst effektiv und daher als außerordentlicher therapeutischer Fortschritt anzusehen. Der Wirkmechanismus ist praktisch identisch mit dem des CAR-T-Zell-Präparats Tisagenlecleucel (Kymriah®), das 2018 eingeführt wurde. Beide Präparate sind nur einmalig zu applizierende, personalisierte Krebstherapien, die über längere Zeit im Organismus verbleiben und auf einer Kombination von zytotoxischer Therapie und Gentherapie basieren.
Entrectinib
Entrectinib (Rozlytrek®, Abb. 7) ist ein Inhibitor der Tropomyosin-Rezeptorkinasen TRKA, -B und -C, der Tyrosin-Proteinkinase ROS1 und der anaplastischen Lymphomkinase (ALK). Die Substanz ist für Patienten mit lokal fortgeschrittenen oder metastasierten soliden Tumoren und neurotropher Tyrosinrezeptorkinase(NTRK)-Genfusion sowie für Erwachsene mit ROS1-positivem, fortgeschrittenem nicht-kleinzelligem Lungenkarzinom (NSCLC) indiziert. Entrectinib ist für bereits austherapierte Patienten mit soliden Tumoren und entsprechender Mutation vorgesehen. Der Wirkmechanismus ist nicht innovativ. Larotrectinib (Vitrakvi®, NA 2019/12, ist ebenfalls ein TRK-Hemmer und für ähnliche Indikationen vorgesehen. Entrectinib kann unabhängig von der zugrunde liegenden Tumor-Pathogenese eingesetzt werden und zeigt eine frühzeitige Response mit hohen Ansprechraten. Entrectinib hat zudem den Vorteil, dass es ein Inhibitor der Tyrosin-Proteinkinase ROS1 und der anaplastischen Lymphomkinase ist, daher laufen bereits klinische Studien zu weiteren Einsatzmöglichkeiten.
Gilteritinib
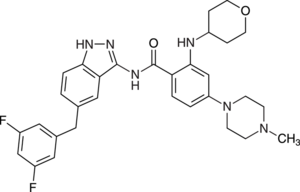
Gilteritinib (Xospata®, Abb. 8) ist ein Inhibitor der FMS-ähnlichen Tyrosinkinase 3 (FLT3) und der AXL-Rezeptor-Tyrosinkinase. Die Substanz wird als perorales Monotherapetikum zur Behandlung von Erwachsenen mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML) eingesetzt. Gilteritinib hemmt die dem FLT3-Rezeptor nachgeschalteten Signalwege sowie die Proliferation von Zellen, die FLT3-Mutationen exogen exprimieren. Bei Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie wurde innerhalb von 24 Stunden nach Applikation von Gilteritinib eine anhaltende, mehr als 90%ige Hemmung der FLT3-Phosphorylierung erreicht. Als Folge kommt es zu einer Verlängerung der Überlebenszeit. Etwa 30% der AML-Patienten weisen eine Mutation der FLT3-Kinase auf, was mit einem besonders aggressiven Erkrankungsverlauf assoziiert ist. Die Beeinflussung dieses veränderten Enzyms als unmittelbarer (Mit-)Ursache der AML-Pathogenese gilt als vielversprechender Therapieansatz. Gilteritinib stellt als Hemmstoff der FLT3-Kinase einen gewissen therapeutischen Fortschritt dar. Allerdings ist der Wirkansatz nicht völlig innovativ. Der bereits seit 2018 eingesetzte Multikinase-Inhibitor Midostaurin (Rydapt®) ist ebenfalls gezielt gegen Zellen mit FLT3-aktivierenden Mutationen gerichtet.
Glasdegib
Erwachsene mit neu diagnostizierter de novo oder sekundärer akuter myeloischer Leukämie (AML) können mit dem Smoothened-Rezeptor-Antagonisten Glasdegib (Daurismo®) behandelt werden. Der oral verfügbare antitumorale Wirkstoff ist ein Hemmstoff des Hedgehog-Signalwegs und wird in Kombination mit Cytarabin eingesetzt, wenn eine Standard-Induktionschemotherapie nicht infrage kommt. In klinischen Studien wurde durch die kombinierte Anwendung mit Cytarabin im Gegensatz zur Cytarabin-Monotherapie die Überlebenszeit von durchschnittlich vier auf acht Monate verdoppelt. Der Wirkmechanismus ist allerdings nicht völlig innovativ. Auch Vismodegib (Erivedge®, NA 2013/12) und Sonidegib (Odomzo®, NA 2018/5) sind Hedgehog-Signalweg-Inhibitoren, sie werden jedoch bislang nicht bei akuter myeloischer Leukämie, sondern zur Behandlung von Basalzellkarzinomen erfolgreich verwendet. Noch ist nicht klar, ob Glasdegib einen therapeutischen Fortschritt darstellt, da direkt vergleichende Untersuchungen fehlen.
Neratinib
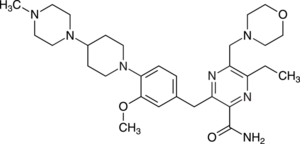
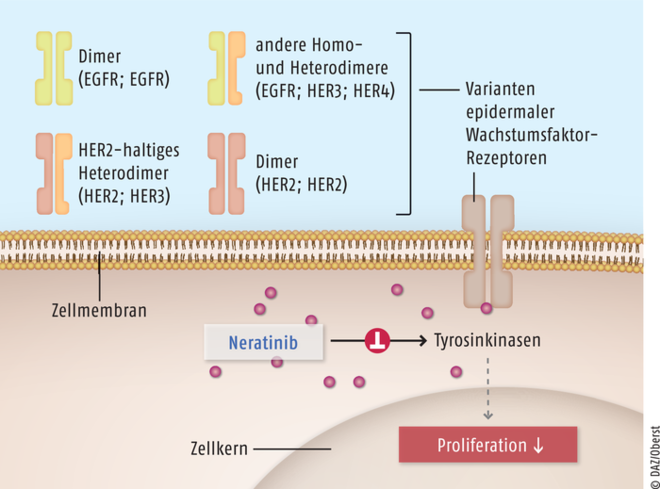
Neratinib (Nerlynx®) ist ein irreversibler Tyrosinkinase-Hemmer und zur erweiterten adjuvanten Behandlung von Hormonrezeptor-positivem Brustkrebs mit Überexpression des humanen epidermalen Wachstumsfaktor-Rezeptors 2 (human epidermal growth factor receptor 2, HER2) indiziert. Er wird bei Patientinnen in einem frühen Erkrankungsstadium eingesetzt, die eine adjuvante Therapie mit dem komplementär wirkenden HER2-Antikörper Trastuzumab abgeschlossen haben. Über epidermale Wachstumsfaktor-Rezeptoren (EGFR oder HER) werden mitogene Signale von der Zelloberfläche an den Zellkern weitergeleitet. Während gesunde Zellen eine nur relativ geringe Menge an HER-Rezeptoren vom Typ 2 aufweisen, ist bei verschiedenen Tumorarten eine Hochregulierung oder Mutation dieses Proteins feststellbar, was zu einer Überflutung mit Wachstumssignalen und zur unkontrollierten Vermehrung der Tumorzellen führt. Neratinib führt zu einer nachhaltigen Hemmung der die Tumorzellproliferation fördernden Kaskaden (Abb. 9).
Abb. 9: Der Multikinase-Hemmer Neratinib blockiert die Signaltransduktion der drei verschiedenen Varianten des humanen epidermalen Wachstumsfaktor-Rezeptors EGFR/HER1, HER2 und HER4 sowie die entsprechenden aktiven Heterodimere. Der Effekt beruht auf einer kovalenten und damit irreversiblen, hochaffinen Bindung an der jeweiligen intrazellulären ATP-Bindungsstelle der Tyrosinkinase. Dies führt zu einer nachhaltigen Inhibition der nachgeschalteten mitogenen Signalkaskaden und somit zu einer antitumoralen und antiproliferativen Wirkung.
Mogamulizumab
Der Antikörper Mogamulizumab (Poteligeo®) ist ein defucosyliertes, humanisiertes IgG1-Kappa-Immunglobulin, das selektiv an den CCR4-Rezeptor bindet, einen G-Protein-gekoppelten Rezeptor für CC-Chemokine, der am Zellverkehr von Lymphozyten zu verschiedenen Organen einschließlich der Haut beteiligt ist. CCR4 wird auf der Oberfläche einiger Krebszellen exprimiert, darunter auch T-Zell-Malignome wie Mycosis fungoides und Sézary-Syndrom, bei denen eine CCR4-Expression inhärent ist. Von der Behandlung profitieren Patienten mit rezidivierenden oder refraktären kutanen Lymphomen wie Mycosis fungoides und T-Zell-Lymphomen der Haut, die vor allem bei älteren Männern auftreten. Durch die Behandlung wird das progressionsfreie Überleben signifikant verlängert. Mogamulizumab gilt nach derzeitigem Kenntnisstand durchaus als Behandlungsfortschritt, es ist das erste, eigens für Mycosis fungoides und Sézary-Syndrom zugelassene Therapeutikum mit völlig neuem Wirkmechanismus.
Polatuzumab Vedotin
Auch Polatuzumab Vedotin (Polivy®) ist ein Konjugat aus dem hochpotenten Mitosehemmstoff Monomethyl-Auristatin-E (MMAE) und einem kovalent gebundenen humanisierten monoklonalen Immunglobulin-G1-Antikörper. Es bindet selektiv und hochaffin an CD79b-positive B-Zellen und wird rasch internalisiert. Polatuzumab Vedotin wird derzeit ausschließlich in Kombination mit dem Zytostatikum Bendamustin und dem Anti-CD20-Antikörper Rituximab eingesetzt. Durch den Zusatz des Antikörper-Konjugats ist eine Verdopplung der Patientenzahl mit kompletter Remission erreichbar.
Talazoparib
Für Erwachsene mit lokal fortgeschrittenem oder metastasiertem Mammakarzinom steht mit Talazoparib (Talzenna®) ein Hemmstoff der Poly(ADP-ribose)-Polymerasen (PARP) 1 und 2 zur Verfügung, die zur Reparatur von DNA-Einzelstrangbrüchen notwendig sind. Es wird als Monotherapeutikum eingesetzt und ist für Patienten mit Mutationen der Tumorsuppressorgene BRCA1/2 in der Keimbahn und Human-Epidermal-Growth-Factor-Receptor-2(HER2)-negativem Tumor geeignet. Talazoparib bindet hochpotent an das aktive Zentrum der DNA-assoziierten PARP-Enzyme und hemmt die katalytische Aktivität. Zudem hält Talazoparib PARP an der DNA fest (PARP-Trapping), was die Effektivität der Enzymhemmung verstärken soll. So werden DNA-Reparatur, -Replikation und -Transkription verhindert und als Folge die Apoptose ausgelöst. In klinischen Studien kam es gegenüber Standardtherapeutika zu einer signifikanten Verlängerung des progressionsfreien Überlebens und der Ansprechrate. Ob die Substanz gegenüber anderen Therapieoptionen einen therapeutischen Fortschritt darstellt, ist derzeit offen. Zurzeit laufen klinische Studien zum Einsatz von Talazoparib bei anderen Brustkrebsformen, Melanomen, Kopf-Hals-Tumoren, Ovarial-, Zervix-, Nierenzell-, Retina-, Lungen- und Prostatakarzinomen sowie bei verschiedenen Leukämien.
Antivirale Mittel
Bulevirtid
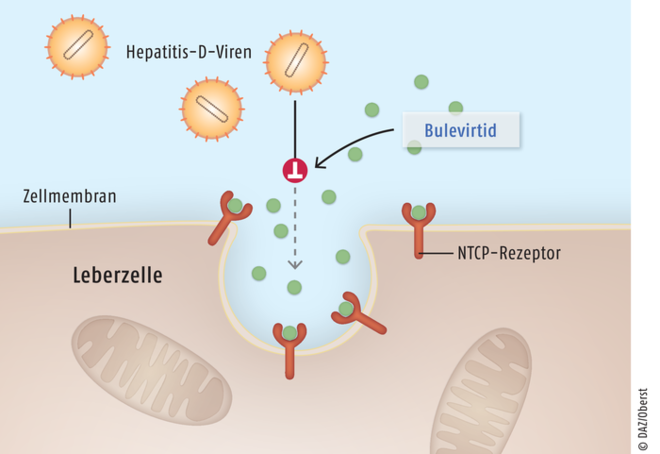
Für Erwachsene mit einer chronischen Hepatitis-Delta-Virus(HDV)-Infektion wurde Bulevirtid (Hepcludex®) eingeführt. Der erste für diese Indikation zugelassene, gut verträgliche Inhibitor des hepatischen Transporters Natriumtaurocholat-Kotransport-Polypeptid besitzt einen völlig innovativen Wirkmechanismus (Abb. 10). Das lineare Peptid blockiert das Eindringen von Hepatitis-B- und Hepatitis-D-Viren in Hepatozyten und ist für Patienten mit kompensierter Lebererkrankung indiziert, die positiv auf HDV-RNA getestet wurden. Bulevirtid, ein synthetisch hergestelltes lineares Peptid aus 47 L-Aminosäuren, entspricht einem Teil der Proteinsequenz der Virushülle. Seine Struktur ist vom HBV-Oberflächenantigen HBsAg (HBV surface antigen) abgeleitet. Bulevirtid bindet an das Natriumtaurocholat-Kotransport-Polypeptid (NTCP) und inaktiviert diesen Gallensalz-Transporter ähnlich einem abgebrochenen Schlüssel. So wird das Eindringen von Hepatitis-D-Viren und auch von Hepatitis-B-Viren in ihre Wirtszellen blockiert. Gesunde Hepatozyten sind somit vor einer Infektion geschützt, während bereits infizierte Zellen nach einiger Zeit absterben oder vom körpereigenen Immunsystem zerstört werden. Bulevirtid ist für einen Großteil der Erkrankten als ein relevanter Fortschritt einzustufen. In den zulassungsrelevanten Studien war durch Bulevirtid nach wenigen Monaten bei etwa der Hälfte der Patienten keine Hepatitis-D-Virus-RNA mehr nachweisbar.
Abb. 10: Das Peptid Bulevirtid bindet an den Gallensalz-Transporter Natriumtaurocholat-Kotransport-Polypeptid (NTCP) und inaktiviert ihn. Auf diese Weise wird das Eindringen von Hepatitis-D-Viren in ihre Wirtszellen, die Hepatozyten, blockiert.
Ibalizumab
Zur Behandlung multiresistenter HIV-1-Infektionen bei Erwachsenen wurde der IgG4-Antikörper Ibalizumab (Trogarzo®) zugelassen (Abb. 11). Der Wirkstoff bindet allosterisch an den CD4-Rezeptor auf der Oberfläche von Zellen des Immunsystems. Er wird als Zweitlinien-Therapeutikum in Kombination mit anderen antiretroviralen Arzneimitteln eingesetzt, wenn diese allein nicht mehr ausreichend wirksam sind. Ibalizumab bietet zumindest für einen Teil der Menschen mit HIV-1-Infektion neue Hoffnung.
Die gegen die Domäne 2 des CD4-Proteins auf Immunzellen gerichtete Substanz weist einen innovativen Wirkmechanismus auf: Es wird der Viruseintritt in die Wirtszelle unterbunden und als Folge kann die HIV-assoziierte Immunsuppression verhindert werden. In den zulassungsrelevanten Studien wurde durch den neuen Wirkstoff mit optimierter Standardtherapie innerhalb von 25 Wochen bei mehr als 40% der Teilnehmer eine Reduktion der HIV-1-RNA-Kopien auf weniger als 50 pro ml Blut erreicht.
Glucagon-like-Peptid-1-Rezeptoragonisten
Semaglutid
Der Glucagon-like-Peptide-1(GLP-1)-Rezeptoragonist Semaglutid (Ozempic®) wird bei Erwachsenen mit trotz Diät und körperlicher Aktivität unzureichend kontrolliertem Diabetes mellitus Typ 2 eingesetzt und wird einmal wöchentlich subkutan appliziert. Das Inkretin-Mimetikum wirkt als selektiver Agonist am Glucagon-like-Peptide-1-Rezeptor und senkt nach oraler Glucosezufuhr den Blutzuckerspiegel, indem es die Insulinsekretion der β-Zellen erhöht und die Glucagonsekretion der α-Zellen des Pankreas drosselt. Semaglutid ist nach Albiglutid, Dulaglutid, Exenatid und Liraglutid der fünfte in Europa eingesetzte GLP-1-Agonist. Die Markteinführung verzögerte sich aufgrund der frühen Nutzenbewertung und der Preisverhandlungen um mehr als ein Jahr. Das langwirksame Antidiabetikum gilt als ein gewisser Fortschritt in der Therapie des Typ-2-Diabetes bei unzureichender Blutzucker-Kontrolle, es ist zumindest im direkten Vergleich mit Dulaglutid signifikant besser wirksam und verträglich.
Weitere hämatologische Wirkstoffe
Betibeglogen autotemcel
Für die Behandlung einer transfusionsabhängigen β-Thalassämie steht mit dem für jeden Patienten individuell hergestellten Betibeglogen autotemcel (Zynteglo®) eine langfristige kausale Therapieoption zur Verfügung. Die Zubereitung enthält CD34+-Stammzellen, die funktionelle Kopien des β-Globin-Gens enthalten. Die β-Thalassämie ist eine autosomal-rezessiv vererbbare Synthesestörung des Proteins β-Globin im Hämoglobin, bei der sich eine hämolytische Anämie entwickelt, wodurch der Körper nur unzureichend mit Sauerstoff versorgt wird. Bei schwerem Erkrankungsverlauf werden regelmäßig Transfusionen mit Erythrozyten-Konzentrat benötigt. Die Herstellung des Ex-vivo-Gentherapeutikums Betibeglogen autotemcel erfolgt für jeden Patienten individuell. Bei schwerer β-Thalassämie ist Zynteglo® mit seinem innovativen Wirkmechanismus nach derzeitigem Kenntnisstand ein relevanter therapeutischer Fortschritt, denn es kann erreicht werden, dass die Patienten lebenslang ohne Transfusionen auskommen. Der genetische Defekt ist meist durch eine einzige Behandlung dauerhaft behebbar, die allerdings etwa 1,6 Millionen Euro kostet.
Immunsuppressiva
Siponimod und Ozanimod
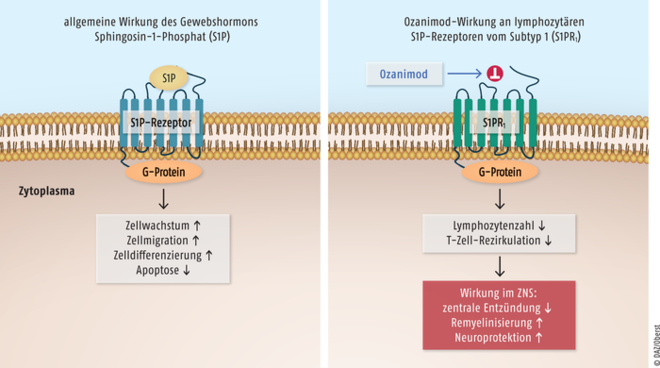
In der Pathogenese der multiplen Sklerose spielt eine durch Lymphozyten und T-Zellen vermittelte Entzündungsreaktion im Zentralnervensystem eine entscheidende Rolle. Das Gewebshormon Sphingosin-1-Phosphat (S1P) ist für Zellwachstum, -migration sowie -differenzierung mitverantwortlich und fungiert als Apoptosehemmstoff. Sphingosin-1-Phosphat-Rezeptor-Modulatoren wie Siponimod (Mayzent®) und Ozanimod (Zeposia®) binden selektiv an verschiedene Subtypen der fünf S1P-assoziierten, G-Protein-gekoppelten Rezeptoren und verhindern, dass diese Immunzellen aus den Lymphknoten austreten und ins Zentralnervensystem gelangen (Abb. 12).
Abb. 12: Das Gewebshormon Sphingosin-1-Phosphat (S1P) steigert durch Bindung an die zugehörigen G-Protein-gekoppelten Rezeptoren S1PR Zellwachstum, Zellmigration sowie Zelldifferenzierung und fungiert als Apoptosehemmstoff (links). S1P-Rezeptor-Modulatoren wie Ozanimod und Siponimod binden als Antagonisten an den Rezeptor vom Subtyp 1 (S1PR1) auf Lymphozyten und verhindern, dass diese aus den Lymphknoten austreten und ins Zentralnervensystem gelangen (rechts). Es kommt zu einer verminderten Rezirkulation von T-Zellen in das ZNS, wodurch die zentrale Entzündungsreaktion begrenzt wird.
Aufgrund dieser dosisabhängigen Lymphozyten-Sequestrierung kommt es zu einer verminderten Rezirkulation von T-Zellen in das ZNS, wodurch die zentrale Entzündungsreaktion begrenzt wird. Bei den MS-Patienten kann eine signifikante Verringerung der Schubrate und der Erkrankungsprogression erreicht werden. Ozanimod ist zur Erstlinien-Therapie von erwachsenen Patienten mit schubförmig remittierender multipler Sklerose indiziert. Siponimod ist in Europa derzeit nur für die Behandlung der sekundär progredienten multiplen Sklerose zugelassen. Direkt vergleichende klinische Studien fehlen.
Upadacitinib
Für Erwachsene mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die auf eine Behandlung mit krankheitsmodifizierenden Antirheumatika (DMARD) unzureichend angesprochen oder sie nicht vertragen haben, wurde Upadacitinib (Rinvoq®) eingeführt. Der Inhibitor der Januskinase 1 (JAK1) kann als Monotherapeutikum oder in Kombination mit Methotrexat angewendet werden und führt zu einer relevanten Besserung der Symptome. Januskinasen (JAK) sind zytoplasmatische Tyrosinkinasen. Sie leiten Signale von Zytokinen und Wachstumsfaktoren weiter, die eine wichtige Rolle bei immunologischen und inflammatorischen Prozessen spielen. Die JAK-Enzymfamilie umfasst die vier Mitglieder JAK1, JAK2, JAK3 und TYK2 (non-receptor tyrosine-protein kinase 2) mit sich überschneidenden Funktionen. Der selektive und reversible JAK-Inhibitor Upadacitinib hemmt JAK1 etwa 74-fach stärker als JAK2 und 58-fach stärker als JAK3. Bisher waren in Europa die beiden JAK-Inhibitoren Baricitinib und Tofacitinib zugelassen, nur in den USA, der Schweiz und in Kanada ist Ofacitinib verfügbar. Während die älteren Substanzen zwei bzw. drei verschiedene Januskinasen hemmen, inhibiert das neue Upadacitinib überwiegend JAK1, was zu einem verbesserten Nebenwirkungsprofil führen soll.
Ophthalmika
Brolucizumab
Erwachsene Patienten mit neovaskulärer (feuchter) altersabhängiger Makuladegeneration (AMD) können mit dem humanisierten monoklonalen Antikörperfragment Brolucizumab (Beovu®) behandelt werden. Die Substanz ist gegen den vaskulären endothelialen Wachstumsfaktor A (Vascular Endothelial Growth Factor A, VEGF-A) gerichtet und wird intravitreal appliziert. Bei den Betroffenen kann eine Verbesserung der Sehschärfe erreicht werden, die über mehrere Jahre stabil bleibt. Der bereits zur Verfügung stehende VEGF-A-Inhibitor Ranibizumab und der VEGF-1- und -2-Rezeptor-Inhibitor Aflibercept dichten die Blutgefäße ab und führen zu einer gewissen Rückbildung der Gefäße. Beide Wirkstoffe stabilisieren eine AMD und verbessern in rund 40% der Fälle sogar das Sehvermögen. Durch den neuen VEGF-A-Inhibitor Brolucizumab konnte in den zulassungsrelevanten klinischen Studien eine ähnliche Verbesserung der Sehschärfe wie durch Aflibercept erreicht werden. Allerdings fiel die Reduktion der Netzhautdicke und der intraretinalen Flüssigkeitsansammlungen unter Brolucizumab deutlich besser aus. Ein weiterer Vorteil der neuen Substanz ist, dass mehr als die Hälfte der Behandelten in der Erhaltungsphase nur einmal pro Quartal eine Injektion benötigen, während Aflibercept alle zwei Monate gegeben werden muss.
Pankreashormone, glykogenolytische Hormone
Glucagon
Zur Akutbehandlung von schweren Hypoglykämien bei Patienten mit Diabetes mellitus Typ 1 oder Typ 2 steht das nasal zu applizierende Glucagon-Präparat Baqsimi® zur Verfügung (Abb. 13). Die Zubereitung ist im Notfall sehr rasch und ohne vorherige Schulung einsatzbereit und sowohl für Erwachsene als auch für Jugendliche und Kinder ab vier Jahren erprobt. Glucagon ist ein aus 29 Aminosäuren bestehendes Peptidhormon. Durch eine Aktivierung von Glucagon-Rezeptoren stimuliert es die Freisetzung von Glucose aus Glykogen. Als Insulin-Gegenspieler wird Glucagon bei Blutzuckerabfall oder nach einer proteinreichen Mahlzeit von der Bauchspeicheldrüse in die Blutbahn sezerniert und dort frei transportiert. Bei Hypoglykämien kann durch äußere Zufuhr von Glucagon ein rascher Blutzuckeranstieg erreicht werden. Allerdings ist das Peptidhormon oral nicht bioverfügbar. Daher wurde mit dem Präparat Baqsimi® ein nasal applizierbares Glucagon entwickelt, das in Notfällen sehr schnell einsatzbereit ist. Die Wirkung setzt nach etwa fünf Minuten ein, bereits nach zehn Minuten werden Glucose-Spiegel im Bereich von 70 mg/dl erreicht. Damit gilt das nasal applizierbare Glucagon als relevanter therapeutischer Fortschritt.
Psychoanaleptika
Solriamfetol
Solriamfetol (Sunosi®, Abb. 14) wurde zur Behandlung von Erwachsenen mit übermäßiger Tagesschläfrigkeit aufgrund von Narkolepsie oder von bislang nicht zufriedenstellend behandelbarer obstruktiver Schlafapnoe zugelassen. Die Substanz verbessert signifikant die Wachheit. Als Wirkmechanismus wird eine Hemmung der Dopamin- und Noradrenalin-Wiederaufnahme aus dem synaptischen Spalt angenommen. Bisher verfügbare Therapieoptionen für Narkolepsie sind im Wesentlichen die Psychostimulanzien Methylphenidat oder Modafinil. Für Patienten mit obstruktiver Schlafapnoe gab es bislang keine zugelassene Medikation. Ob der neu auf dem Markt verfügbare Dopamin-/Noradrenalin-Reuptake-Hemmer Solriamfetol als therapeutischer Fortschritt einzuordnen ist, ist noch nicht ersichtlich. Die Substanz hat sich zwar in klinischen Studien in den Indikationen Narkolepsie und obstruktive Schlafapnoe gegenüber Placebo als überlegen erwiesen. Vergleichende Untersuchungen mit den bereits auf dem Markt befindlichen Präparaten wurden bislang nicht durchgeführt. Immerhin ist Solriamfetol das erste ausdrücklich für Patienten mit obstruktiver Schlafapnoe zugelassene Medikament.
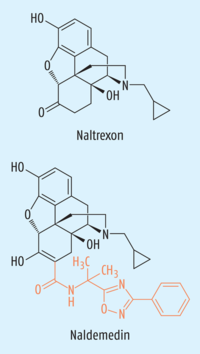
Abb. 15: Naltrexon (oben) ist ein zentral wirksamer Opioidrezeptor-Antagonist, der bei Alkohol- und Opioid-Missbrauch eingesetzt wird. Das bei Opioid-induzierter Obstipation eingesetzte Naldemedin überwindet aufgrund einer zusätzlichen raumfüllenden, hydrophilen Seitenkette die Blut-Hirn-Schranke normalerweise nicht in relevantem Ausmaß. Die Substanz wirkt daher praktisch ausschließlich in der Peripherie als opioider Antagonist, beispielsweise an gastrointestinalen Opioidrezeptoren.
Mittel gegen Obstipation, periphere Opioidrezeptor-Antagonisten
Naldemedin
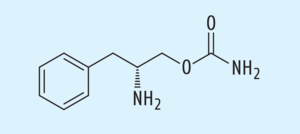
Obstipation ist eine häufig auftretende und mitunter sehr unangenehme Nebenwirkung einer Schmerztherapie mit Opioiden. Der oral verfügbare und peripher wirkende Opioidrezeptor-Antagonist Naldemedin (Rizmoic®, Abb. 15) kann bei Erwachsenen mit Opioid-induzierter Obstipation eingesetzt werden, die auf herkömmliche Laxanzien nicht ausreichend reagierten. Naldemedin wirkt als voller Antagonist an µ-, κ- und δ-Opioidrezeptoren und führt zu einer Linderung der Symptome, es treten mehr spontane Darmbewegungen auf. Naldemedin unterscheidet sich chemisch von dem bei Alkohol- und Opioid-Missbrauch eingesetzten Opioidrezeptor-Antagonisten Naltrexon durch eine raumfüllende, hydrophile Seitenkette. So kann die Blut-Hirn-Schranke normalerweise nicht in relevantem Ausmaß überwunden werden. Zudem ist der Wirkstoff ein Substrat des Efflux-Transporters P-Glycoprotein (P-gp), der potenziell ebenfalls dazu beiträgt, die Konzentration von Naldemedin im ZNS niedrig zu halten. Somit ist die Inzidenz von zentralen Effekten wie der Beeinträchtigung der Analgesie durch kombiniert angewandte Opioide reduziert. Nach derzeitigem Kenntnisstand gilt Naldemedin nicht als relevanter Fortschritt, da die Wirkung auf dem gleichen Wirkmechanismus wie bei den bereits seit Jahren etablierten Arzneistoffen Methylnaltrexon und Naloxegol beruht. Positiv ist, dass Naldemedin unabhängig von den Mahlzeiten appliziert werden kann.
Andere Mittel gegen Störungen des Muskel- und Skelettsystems
Onasemnogen-Abeparvovec
Das Gentherapeutikum Onasemnogen-Abeparvovec (Zolgensma®) ist zur Behandlung von Patienten mit 5q-assoziierter spinaler Muskelatrophie (SMA) und einer biallelischen Mutation im Survival-Motoneuron-1-Gen (SMN1) indiziert. Der virale Vektor wird nur einmalig intravenös verabreicht. Das derzeit nur für die schwere biallelische Erkrankungsform zugelassene Gentherapeutikum gilt nach derzeitigem Kenntnisstand als ein erheblicher therapeutischer Fortschritt. Insbesondere bei frühzeitigem Einsatz, wenn noch keine großflächige irreversible Zerstörung der Motoneuronen eingesetzt hat, besteht durch den kausalen Behandlungsansatz die Hoffnung auf Stabilisierung, Besserung und möglicherweise sogar auf Heilung der quälenden, lebensbedrohenden Erkrankung. Allerdings wird für das Präparat ein Preis von etwa einer Million Euro diskutiert.
Retinoide zur topischen Anwendung bei Akne
Trifaroten
Die Wirkung topischer Retinoide bei leichter bis mittelschwerer Acne vulgaris beruht auf einer Bindung an die nucleären Retinoid-Rezeptoren RAR und RXR). Der neue Wirkstoff Trifaroten (Selgamis®, Abb. 16), ein Terphenylsäure-Derivat, ist ein potenter und spezifischer Agonist des Retinsäure-Rezeptors vom Subtyp γ. Zur lokalen Therapie der Acne vulgaris wird die Creme bei Patienten ab zwölf Jahren topisch im Gesicht oder am Rumpf angewendet, wenn viele Komedonen, Papeln und Pusteln vorhanden sind. In den zulassungsrelevanten Studien zeigte die Trifaroten-Zubereitung auch über längere Beobachtungszeiträume eine signifikant bessere Wirkung als die reine Salbengrundlage. Allerdings wurde in den Untersuchungen keine aktive Vergleichssubstanz eingesetzt, sodass kein Vor- oder Nachteil herausgestellt werden konnte. Trifaroten ist zudem als Orphan Drug für die Behandlung der kongenitalen Ichthyose zugelassen, einer meist durch Gendefekte verursachten Verhornungsstörung der Haut.
Behandlung von Knochenerkrankungen, andere Mittel mit Einfluss auf Knochenstruktur und Mineralisation
Romosozumab
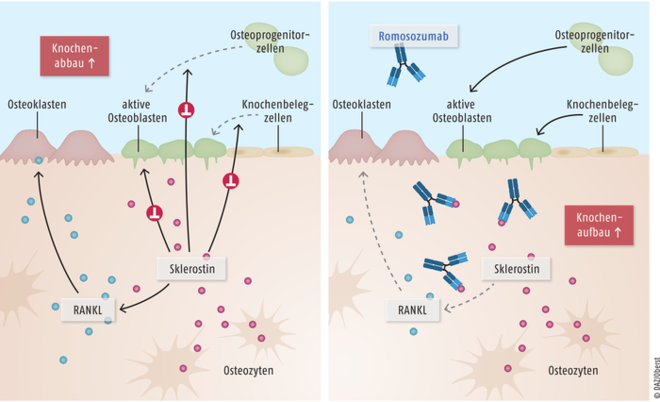
Der monoklonale IgG2-Antikörper Romosozumab (Evenity®) ist für die Behandlung postmenopausaler Frauen mit manifester Osteoporose vorgesehen. Er ist gegen das die Osteogenese hemmende Glykoprotein Sklerostin gerichtet und bei deutlich erhöhtem Frakturrisiko indiziert. Romosozumab bindet mit hoher Affinität an Sklerostin (Abb. 17). Als Folge kommt es zu einer Aktivierung von Knochenbelegzellen, zu einer gesteigerten Produktion von Knochenmatrix durch Osteoblasten sowie zu einer vermehrten Rekrutierung von den Knochenaufbau begünstigenden Osteoprogenitorzellen. Über eine reduzierte Expression des Osteoblasten-Mediators RANKL hemmt Romosozumab zudem den Knochenabbau. Aufgrund seines dualen osteoanabolen und antiresorptiven Wirkmechanismus werden ein rascher Anstieg der trabekulären und kortikalen Knochenmasse sowie eine Verbesserung der Knochenstruktur und -festigkeit erreicht. Damit weist Romosozumab einen völlig neuen Wirkmechanismus auf. In klinischen Studien hat sich die Substanz gegenüber dem Standardtherapeutikum Alendronat als signifikant überlegen erwiesen. Allerdings ist die Therapie mit teilweise schwerwiegenden kardiovaskulären Ereignissen assoziiert. Aufgrund von Sicherheitsbedenken wurde die Zulassung auf die Behandlung von Frauen mit deutlich erhöhtem Frakturrisiko ohne vorangegangene Myokardinfarkte oder Schlaganfälle begrenzt. Dass Romosozumab zukünftig auch für die Behandlung von Männern mit Altersosteoporose zugelassen wird, erscheint fraglich. In klinischen Studien kam es auch bei diesem Personenkreis vermehrt zu kardiovaskulären Zwischenfällen.
Abb. 17: Das in Osteozyten produzierte Sklerostin vermindert die knochenbildende Aktivität von Osteoblasten und aktiviert gleichzeitig die knochenresorptive Wirkung von Osteoklasten. Letzteres wird über eine dosisabhängige Hochregulation des von Osteoblasten sezernierten Signalmoleküls RANKL (Receptor Activator of Nuclear-factor-κB Ligand) vermittelt. Insgesamt resultiert ein Knochenabbau (links). Der Antikörper Romosozumab bindet mit hoher Affinität an Sklerostin. Als Folge kommt es zu einer Aktivierung von Knochenbelegzellen, zu einer gesteigerten Produktion von Knochenmatrix durch Osteoblasten sowie zu einer Rekrutierung von den Knochenaufbau begünstigenden Osteoprogenitorzellen. Über eine reduzierte Expression des Mediators RANKL bewirkt Romosozumab zudem eine Hemmung des Knochenabbaus. Aufgrund dieses dualen osteoanabolen und antiresorptiven Wirkmechanismus wird eine Verbesserung der Knochenstruktur und -festigkeit erreicht (rechts).
Immunsuppressiva,andere Immunsuppressiva
Darvadstrocel
Das allogene mesenchymale Stammzell-Präparat Darvadstrocel (Alofisel®, Abb. 18) ist zur Zweitlinien-Therapie von komplexen perianalen Fisteln indiziert. Die Zubereitung ist für Patienten mit nicht bzw. nur gering aktivem luminalem Morbus Crohn geeignet, die unzureichend auf mindestens eine Therapie mit Antibiotika, Immunsuppressiva oder TNF-α-Blockern angesprochen haben. Durch Darvadstrocel wird in etwa der Hälfte der Fälle ein dauerhafter Fistelverschluss erreicht: Nach lokaler Applikation von Darvadstrocel im Bereich von perianalen Fisteln führen Zytokine zu einer Aktivierung der aus Fettgewebe von gesunden Spendern gewonnenen und expandierten mesenchymalen Stammzellen, sodass als Folge eine Heilung des Gewebes rund um den Fistelgang ermöglicht wird. Wie lange der positive Effekt anhält und ob Wirksamkeit und Sicherheit auch bei einer erforderlichen erneuten Behandlung gewährleistet sind, muss in weiteren Untersuchungen geprüft werden.
Mesenchymale Stromazellen
Erleiden Patienten nach einer allogenen Stammzelltransplantation eine steroidrefraktäre, akute Graft-versus-Host-Reaktion (graft-versus-host disease, GvHD) vom Grad II bis IV, können sie nun zusätzlich zur konventionellen Therapie mit Immunsuppressiva wie Ciclosporin A oder Prednisolon mit einem humanen, allogenen mesenchymalen Stromazell-Präparat (Obnitix®) behandelt werden. Auf diese Weise wird bei 70 bis 80% der Patienten ein Abklingen der Graft-versus-Host-Reaktion erreicht. Damit stellt das neue Obnitix® einen relevanten Fortschritt dar. Zwar werden bereits seit Längerem mesenchymale Stromazellen in der Therapie der Graft-versus-Host-Reaktion eingesetzt, allerdings handelt es sich meist um Zubereitungen von nur einem oder zwei Spendern. Bei der neuen Zubereitung werden im Rahmen eines standardisierten Herstellungsverfahrens Knochenmarkzellen von mindestens acht gesunden Spendern gewonnen und in Thrombozytenlysat kultiviert. Auf diese Weise wird gegenüber herkömmlichen Zubereitungen eine verbesserte und reproduzierbarere allosuppressive und antiinflammatorische Wirksamkeit erreicht. In klinischen Untersuchungen konnte gezeigt werden, dass die Prognose von GvHD-Patienten mit schwerer und sehr schwerer Erkrankung etwa ebenso gut ist wie die von Patienten mit leichterer Graft-versus-Host-Reaktion und herkömmlicher Behandlung.
Gentherapeutika, RNA-Interferenz-Therapeutika
Givosiran
Givosiran (Givlaari®) ist ein synthetisch hergestelltes doppelsträngiges Ribonukleinsäure-Fragment (dsRNA), das zur Behandlung bei akuter hepatischer Porphyrie zugelassen ist. Durch eine einmal monatliche subkutane Applikation werden die Blutspiegel der körpereigenen neurotoxischen Substanzen Aminolävulinsäure und Porphobilinogen reduziert und mitunter lebensbedrohliche Erkrankungs-Attacken und -Manifestationen gemildert. Bei Patienten mit genetisch bedingter akuter hepatischer Porphyrie (AHP) ist die Häm-Biosynthese gestört. Das Enzym Aminolävulinsäure-Synthase-1 (ALAS1) wird zum Ausgleich des Häm-Mangels vermehrt exprimiert. Als Folge kommt es zwar zu einer ausreichenden Produktion des Blutfarbstoffs, aber auch verstärkt zur Bildung der neurotoxischen Zwischenstufen Aminolävulinsäure und Porphobilinogen. Bei den Betroffenen treten anfallsartig mitunter lebensbedrohliche abdominale, neurologische und kardiovaskuläre Symptome auf. Givosiran stellt als erstes prophylaktisch einsetzbares AHP-Therapeutikum einen erheblichen therapeutischen Fortschritt dar. Durch den monatlichen Einsatz des RNA-Silencers ist es möglich, die Anzahl der AHP-Attacken auf etwa ein Viertel herunterzufahren und die Spiegel der neurotoxischen Zwischenprodukte auf das physiologische Niveau zu reduzieren. Zudem führt die Substanz zu einer signifikanten Verbesserung der Lebensqualität und der psychischen Verfassung der Patienten. |
Informationen zu neuen Wirkstoffen
In der monatlich erscheinenden Beilage „Neue Arzneimittel“ stellen wir Ihnen alle neuen Wirkstoffe ausführlich vor und ordnen sie in die bestehenden Therapieoptionen ein. Ein Archiv mit allen seit 2000 eingeführten Wirkstoffen finden Sie auf DAZ.online unter www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“.
Oder Sie geben einfach in die Suchfunktion auf DAZ.online den Webcode P7YV8 ein und gelangen direkt zur Übersichtsseite der „Neuen Arzneimittel“. Dort können Sie als Abonnent nach Wirkstoffnamen, Handelsbezeichnung, Einführungsjahr oder ATC-Code suchen.
Substanz | Handelsname | Gruppe | Hersteller/Vertrieb | Einführungsdatum | NA Nr.-Jahr |
|---|---|---|---|---|---|
Alpelisib | Piqray® | antineoplastische Mittel, andere antineoplastische Mittel | Novartis Pharma GmbH | 1. September 2020 | 11-20 |
Axicabtagen-Ciloleucel | Yescarta® | andere antineoplastische Mittel | Gilead Sciences GmbH | 1. Dezember 2019 | 2-20 |
Belantamab-Mafodotin | Blenrep® | antineoplastische Arzneimittel, monoklonale Antikörper | GlaxoSmithKline GmbH | 15. September 2020 | 12-20 |
Betibeglogen autotemcel | Zynteglo® | Hämatologika, andere hämatologische Wirkstoffe | Bluebird Bio Germany GmbH | 1. April 2020 | 6-20 |
Brolucizumab | Beovu® | Ophthalmika, antineovaskuläre Mittel | Novartis Pharma GmbH | 15. März 2020 | 6-20 |
Bulevirtid | Hepcludex® | antivirale Mittel zur systemischen Anwendung, andere antivirale Mittel | MYR GmbH | 1. September 2020 | 12-20 |
Cannabidiol | Epidyolex® | Antiepileptika, andere Antiepileptika | GW Pharma (International) (NL) | 15. Oktober 2019 | 1-20 |
Darolutamid | Nubeqa® | Hormonantagonisten und verwandte Mittel, Antiandrogene | Bayer Vital GmbH | 1. Mai 2020 | 6-20 |
Darvadstrocel | Alofisel® | Immunsuppressiva,andere Immunsuppressiva | Takeda GmbH | 1. Dezember 2019 | 3-20 |
Entrectinib | Rozlytrek® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Roche Pharma AG | 1. September 2020 | 12-20 |
Fostamatinib | Tavlesse® | Antihämorrhagika, andere systemische Hämostatika | Grifols Deutschland GmbH | 1. Juli 2020 | 9-20 |
Gilteritinib | Xospata® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Astellas Pharma GmbH | 1. Dezember 2019 | 1-20 |
Givosiran | Givlaari® | Gentherapeutika, RNA-Interferenz-Therapeutika | Alnylam Netherlands B. V., (NL) | 15. April 2020 | 7-20 |
Glasdegib | Daurismo® | antineoplastische Mittel, andere antineoplastische Mittel | Pfizer-Pharma GmbH | 15. August 2020 | 11-20 |
Glucagon | Baqsimi® | Pankreashormone, glykogenolytische Hormone | Lilly Deutschland GmbH | 1. März 2020 | 5-20 |
Ibalizumab | Trogarzo® | antivirale Mittel zur systemischen Anwendung, andere antivirale Mittel | Theratechnologies Europe Ltd., (IRL) | 1. September 2020 | 11-20 |
Luspatercept | Reblozyl® | Antianämika, andere Antianämika | Celgene GmbH | 1. August 2020 | 10-20 |
Mogamulizumab | Poteligeo® | antineoplastische und immunmodulierende Mittel, monoklonale Antikörper | Kyowa Kirin GmbH | 15. Juni 2020 | 8-20 |
Naldemedin | Rizmoic® | Mittel gegen Obstipation, periphere Opioidrezeptor-Antagonisten | Hexal AG | 15. Mai 2020 | 7-20 |
Neratinib | Nerlynx® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Pierre Fabre Pharma GmbH | 1. Dezember 2019 | 2-20 |
mesenchymale Stromazellen | Obnitix® | Immunsuppressiva,andere Immunsuppressiva | Medac GmbH | 15. September 2019 | 1-20 |
Onasemnogen-Abeparvovec | Zolgensma® | andere Mittel gegen Störungen des Muskel- und Skelettsystems, Gentherapeutika | Avexis EU Ltd. (IRL) | 1. Juli 2020 | 9-20 |
Osilodrostat | Isturisa® | Anticorticosteroide | Recordati Rare Diseases Germany GmbH | 15. Juli 2020 | 10-20 |
Ozanimod | Zeposia® | Immunsuppressiva, selektive Immunsuppressiva | Celgene GmbH | 15. Juli 2020 | 10-20 |
Polatuzumab Vedotin | Polivy® | antineoplastische Arzneimittel, monoklonale Antikörper | Roche Pharma AG | 15. Februar 2020 | 5-20 |
Rifamycin | Relafalk® | Antidiarrhoika und intestinale Antiphlogistika/Antiinfektiva, Antibiotika | Dr. Falk Pharma GmbH | 1. Dezember 2019 | 3-20 |
Romosozumab | Evenity® | Osteoporosemittel, andere Mittel mit Einfluss auf die Knochenstruktur und Mineralisation | UCB Pharma GmbH | 15. März 2020 | 7-20 |
Semaglutid | Ozempic® | Antidiabetika, Glucagon-like-Peptid-1(GLP-1)-Rezeptoragonisten | Novo Nordisk Pharma | Aufnahme der Packung in die Taxe: 15. Januar 2020 Ausbietungsdatum 1. November 2018 | 4-20 |
Siponimod | Mayzent® | Immunsuppressiva, selektive Immunsuppressiva | Novartis Pharma GmbH | 15. Februar 2020 | 5-20 |
Solriamfetol | Sunosi® | Psychoanaleptika, zentral wirkende Sympathomimetika | Jazz Pharmaceuticals Ireland Ltd. (IRL) | 15. Mai 2020 | 8-20 |
Talazoparib | Talzenna® | andere antineoplastische Mittel, PARP-Inhibitor | Pfizer Pharma GmbH | 1. Juni 2020 | 8-20 |
Trifaroten | Selgamis® | Retinoide zur topischen Anwendung bei Akne | Galderma Laboratorium GmbH | 15. August 2020 | 11-20 |
Upadacitinib | Rinvoq® | Immunsuppressiva, selektive Immunsuppressiva | AbbVie Deutschland GmbH | 1. Februar 2020 | 4-20 |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.