
- DAZ.online
- DAZ / AZ
- DAZ 17/2021
- Mit 6 × 2 Spritzen ...
Beratung
Mit 6 × 2 Spritzen durchs Jahr
Neuer Meilenstein in der HIV-Therapie
Cabotegravir ist der jüngste Vertreter der antiretroviral wirksamen HIV-1-Integrase-Strangtransfer-Inhibitoren (INSTI oder kurz INI, Integrase-Hemmer). Bekannte Wirkstoffe dieser Substanzklasse sind das strukturell sehr ähnliche Dolutegravir (DTG) sowie Bictegravir (BIC), Elvitegravir (EVG) und Raltegravir (RAL). Sie greifen zu einem Zeitpunkt in den HIV-Replikationszyklus ein, der entscheidend für die Integration der retroviralen DNA, welche mittels reverser Transkriptase gebildet wurde, in die DNA menschlicher Zellen ist. Konkret hemmen Strangtransfer-Inhibitoren im mehrschrittigen Integrationsprozess das aktive Zentrum der viruseigenen Integrase und verhindern das Andocken und irreversible Binden der viralen DNA in das Wirtsgenom, den sogenannten Strangtransfer. Folglich können weder virale RNA noch virale Proteinvorstufen produziert werden, wodurch man der Virusausbreitung effektiv die Basis entzieht.
Kombinationspartner Rilpivirin
Bekanntermaßen reicht es nicht, nur einen Schritt im HIV-Replikationszyklus zu hemmen, zu groß ist die Gefahr einer Resistenzentwicklung, auch wenn der Integrasehemmer Cabotegravir eine hohe Resistenzbarriere aufweist. Als antiretroviraler Kombinationspartner, der den Wirkmechanismus von Cabotegravir sinnvoll ergänzt und als Depot-Injektion verabreicht werden kann, kam Rilpivirin infrage. Es handelt sich um einen nicht-nukleosidalen Inhibitor der reversen Transkriptase (NNRTI) der zweiten Generation. Die reverse Transkriptase ist ein Enzym, das der Integrase vorgeschaltet ist. Rilpivirin hat sich in der HIV-Therapie bewährt und ist bereits seit 2011 in oraler Darreichungsform (Edurant®) zugelassen. Ein dritter Kombinationspartner, wie er in vielen oralen Therapieregimen noch üblich ist, musste aufgrund ausreichender Wirksamkeit der Zweierkombination nicht akquiriert werden. Somit bilden Cabotegravir und Rilpivirin das erste injizierbare 2-Drug-Regime (2DR) in der HIV-Behandlung.
Effektives Zweifach-Regime
Dass nur zwei antiretrovirale Substanzen zu einem effektiven HIV-Regime miteinander kombiniert werden, ist im Bereich der peroralen Therapie auch erst seit 2017 möglich und zwar mit der sehr ähnlichen Wirkstoffkombination aus Dolutegravir und Rilpivirin (Juluca®). Zweifach-Regime zeichnen sich vor allem durch eine geringere Substanzbelastung aus und bieten dadurch Vorteile bei den lebenslang durchzuführenden Behandlungen. Es besteht auch ein geringeres Wechselwirkungspotenzial, was bei zunehmendem Alter der Betroffenen immer wichtiger wird, da sie verglichen mit Nicht-Infizierten früher und häufiger Komorbiditäten entwickeln. Im Vergleich zu einer Dreifachtherapie besteht allerdings bei suboptimaler Therapietreue unter 2-Drug-Regimen und daraus folgenden subinhibitorischen Wirkstoffkonzentrationen die Sorge, nicht robust genug bezüglich der Virussuppression und einer möglichen Resistenzentwicklung zu sein.
Stabiles virologisches Ansprechen
Zulassungsrelevant waren drei unterschiedlich konzipierte, multizentrische Studien der Phase III (ATLAS, ATLAS-2M und FLAIR), an denen insgesamt 2227 HIV-infizierte Menschen teilnahmen. Dabei waren die Nicht-Unterlegenheitsstudien ATLAS und FLAIR noch auf eine monatliche Applikation von 400 mg Cabotegravir und 600 mg Rilpivirin ausgerichtet, während ATLAS-2M darauf aufbauend den Wirksamkeitsnachweis für die nun in Europa zugelassene zweimonatliche Applikation von 600 mg Cabotegravir und 900 mg Rilpivirin erbrachte. ATLAS verglich die monatliche Injektionstherapie bei virologisch supprimierten Patienten mit solchen, die weiterhin ihre bisherige orale antiretrovirale Standardtherapie erhielten [1]. In FLAIR wurden hingegen Studienteilnehmer einbezogen, die therapienaiv waren [2]. Hier erhielten alle Teilnehmer eine 20-wöchige Induktionstherapie mit Triumeq® (Abacavir, Dolutegravir und Lamivudin). Lagen Patienten stabil unter der Nachweisgrenze, wurden sie entweder mit diesem Regime weiterbehandelt oder erhielten stattdessen – nach einer vierwöchigen oralen CAB/RPV-Einleitungsphase – einmal pro Monat die Depotinjektionen. In beiden Studien war der primäre Endpunkt nach 48 Wochen das Überschreiten der Nachweisgrenze von 50 HIV-1-RNA-Kopien/ml. Es zeigte sich jeweils eine Nicht-Unterlegenheit in der Wirksamkeit der monatlichen Depotinjektionen (1,6% bzw. 2,1% über der Nachweisgrenze) im Vergleich zu den jeweiligen Kontrollgruppen (1,0% bzw. 2,5% über der Nachweisgrenze) [1, 2], was kürzlich auch bei einer Fortführung der FLAIR-Studiendauer über 96 Wochen bestätigt werden konnte [3]. Entscheidend für die europäische Zulassung war, dass Patienten auch bei der zweimonatlichen Applikation im Vergleich zur monatlichen Gabe erfolgreich virologisch supprimiert waren, wie Ergebnisse der fortlaufenden ATLAS-2M-Studie belegen konnten [4]. Nach 48 Wochen überschritten 1,7% der Verumgruppe die Nachweisgrenze im Vergleich zu 1,0% der Kontrollgruppe mit monatlichen Injektionen. Bei Patienten mit bestätigtem virologischem Versagen war dies übrigens nicht auf subtherapeutische Wirkstoffkonzentrationen zurückzuführen. Eher scheinen übersehene Resistenzen zu Therapiebeginn oder weniger empfängliche virale Subtypen eine Rolle zu spielen – Faktoren, die noch weiter zu untersuchen sind.
DAH²KA = kompetente Hilfe
Die Deutsche Arbeitsgemeinschaft der HIV- und Hepatitis-kompetenten Apotheken DAH²KA e. V. vertritt die Interessen der niedergelassenen Apotheker, die in der Beratung und Versorgung von HIV-infizierten Patienten engagiert sind. Ziele sind unter anderem
- die Beratung, Compliance und Versorgung mit Arzneimitteln von HIV-infizierten Patienten zu verbessern,
- die Weiterbildung der Mitglieder auf allen die HIV-Infektion betreffenden wissenschaftlichen Gebieten,
- die Förderung der Zusammenarbeit der unterschiedlichen Fachgebiete in der Beratung und Versorgung von HIV-infizierten Patienten,
- die Förderung der Zusammenarbeit zwischen niedergelassenen Apothekern und Institutionen des Gesundheitswesens, die bei der Beratung und Versorgung von HIV-infizierten Patienten kooperieren können,
- die Durchführung und Dokumentation von Fortbildungsveranstaltungen.
Weitere Informationen unter www.dahka.de
Injektionstherapie punktet
Bezüglich der Zufriedenheit der Therapie nach 48 Wochen sprechen die vorliegenden Untersuchungen eine deutliche Sprache: 86% der ATLAS-Studienteilnehmer präferierten die monatliche Behandlung gegenüber ihrer bisherigen antiretroviralen Therapie [1], und 91% der FLAIR-Studienteilnehmer mit monatlicher Injektionstherapie bevorzugten diese gegenüber der oralen Induktionstherapie [2]. Berücksichtigt man nur diejenigen, die auf die Befragung geantwortet haben, betrug die Vorliebe sogar 97 [1] bzw. 99% [2]. Rückmeldungen von Probanden, die nach Abschluss der ATLAS- in die ATLAS-2M-Studie wechselten und von einer monatlichen auf die zweimonatliche Applikationsfrequenz randomisiert wurden, bevorzugten zu 94% den längeren Applikationsabstand. [4].
Reaktionen an der Injektionsstelle
Mindestens drei von vier Studienteilnehmern (81% [1], 86% [2], 76% [4]) klagten unter der langwirksamen antiretroviralen Therapie mindestens einmal über Reaktionen an der Injektionsstelle. Hauptsächlich handelte es sich um Ereignisse mit milden bis moderaten Schmerzen, die im Mittel für drei Tage andauerten. Weitere Injektionsreaktionen umfassten Rötungen an der Einstichstelle, Unbehagen, Schwellungen, Knötchenbildung sowie Verhärtungen. In allen Studien nahm die Inzidenz der Injektionsreaktionen mit der Zeit deutlich ab, nach 48 Wochen berichtete aber immerhin noch etwa jeder fünfte [2, 4] beziehungsweise zehnte [1] Patient davon. Zudem wurden Nasopharyngitis, Kopfschmerzen, Infektionen der oberen Atemwege und Diarrhö als häufigste Nebenwirkungen genannt [1, 2, 4].
Sorgsame Patientenauswahl
Gemäß der Zulassung kommt die intramuskuläre Behandlung nicht für therapienaive Patienten infrage, sondern nur für virologisch supprimierte Erwachsene, die sich dank eines antiretroviralen Regimes stabil unter der Nachweisgrenze von kleiner 50 HIV-1-RNA-Kopien/ml befinden. Um zum Scheitern verurteilte Behandlungsverläufe von vornherein zu verhindern, darf kein virologisches Versagen unter und keine Resistenzen gegenüber nicht-nukleosidalen Inhibitoren der reversen Transkriptase oder Integrase-Inhibitoren aufgetreten sein bzw. bestehen. Neben diesen Grundvoraussetzungen muss vor einem Wechsel auf die neue Injektionstherapie eruiert werden, ob der Patient motiviert ist, das streng festgelegte und nur wenige Abweichungen tolerierende Schema aus oraler Einleitungsphase, intramuskulärer Initiierungs- und Erhaltungstherapie durchzuführen und aufrechtzuerhalten (siehe Abb. 1). Neben einem hohen Verständnis des Therapiekonzeptes müssen die Patienten insbesondere bereit sein, Termine genau einzuhalten. Bei HIV-infizierten Menschen, die bisher durch Adhärenzschwierigkeiten aufgefallen sind oder konkurrierende Probleme wie Obdachlosigkeit oder Drogengebrauch aufweisen, scheinen Ärzte besorgt, dass Folgetermine nicht eingehalten werden und sich Resistenzen oder ein virologisches Versagen entwickeln könnten [5]. Da gerade diese Patienten von einer Therapie mit wenigen Applikationszeitpunkten profitieren würden, wäre es wünschenswert gewesen, dass gerade sie an Studien wie ATLAS und ATLAS-2M hätten teilnehmen können. Da aber Zweifel an ihrer Zuverlässigkeit bestehen, waren sie von den Studien ausgeschlossen.
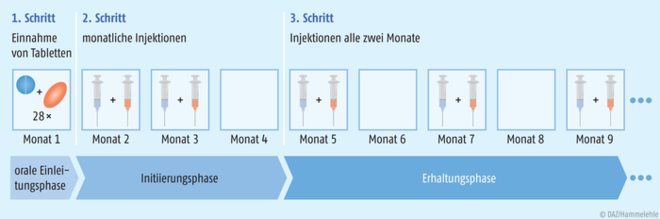
Abb. 1: Langwirksame antiretrovirale Therapie Einer mindestens 28-tägigen oralen Einleitungsphase mit täglicher Gabe von Cabotegravir und Rilpivirin folgt die intramuskuläre Initiierungsphase, in der die Substanzen gemeinsam, einmal monatlich, in den Monaten zwei und drei verabreicht werden. Ab dem fünften Monat beginnt die Erhaltungstherapie, in der die Spritzen gemeinsam alle zwei Monate appliziert werden. Ab der zweiten Initialdosis und in der Erhaltungsphase ist als Injektionszeitpunkt ein flexibles Zeitfenster von +/- sieben Tagen um das Zieldatum herum erlaubt [nach Informationen der ViiV Healthcare GmbH].
Drei Phasen der Therapie
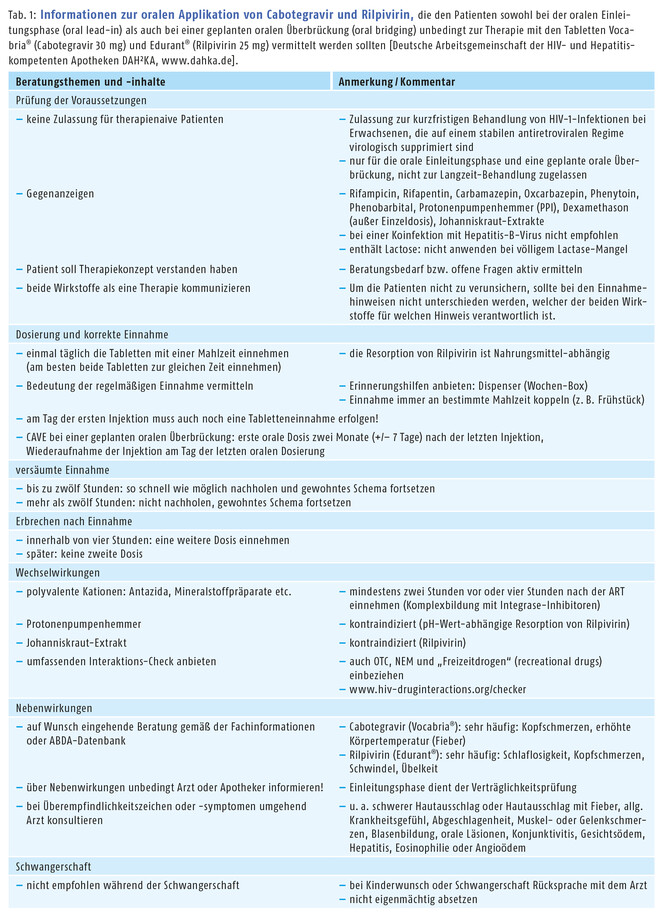
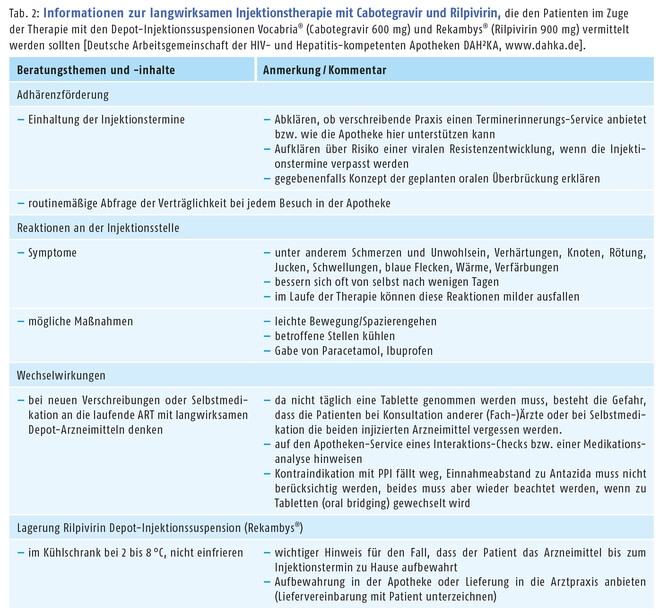
Wird die langwirksame injizierbare antiretrovirale Therapie konsequent angewendet, kann sie die orale hochaktive antiretrovirale Therapie (HAART) ersetzen. Das komplexe Therapieschema erfordert intensive Beratung. In der Apotheke sollte dem Patienten ein diskretes Gespräch in einem Beratungsraum angeboten werden – eventuell unter Einbindung eines HIV-Schwerpunkt-Apothekers. Die Deutsche Arbeitsgemeinschaft der HIV- und Hepatitiskompetenten Apotheken DAH²KA hat für die Unterstützung in der pharmazeutischen Beratung Informationen zusammengestellt, die die Tabellen 1 und 2 zeigen.
Der langwirksamen (long-acting) antiretroviralen Therapie wird im ersten Monat eine orale Einleitungsphase (oral lead-in) vorgeschaltet, um die Verträglichkeit der neuen Kombination zu beurteilen. Hierzu erhält der Patient einmal täglich für mindestens 28 Tage jeweils eine Tablette mit 30 mg Cabotegravir und eine Tablette mit 25 mg Rilpivirin (siehe Abb. 1). Dabei ist Cabotegravir in oraler Darreichungsform neu (Vocabria® Filmtabletten), aber nur für Einleitungs- und Überbrückungszwecke im Rahmen der Injektionstherapie zugelassen,
sie sollen ab 1. Mai 2021 zur Verfügung stehen. Zwar werden mit Cabotegravir und Rilpivirin zwei Wirkstoffe angewendet, es empfiehlt sich jedoch in der Beratung, beide als integrierte Therapie zu kommunizieren und bei den Einnahmehinweisen nicht zu unterscheiden, welcher
der beiden Wirkstoffe für welchen Hinweis verantwortlich ist, um die Patienten nicht zu verunsichern (s. Tab. 1). Beispielsweise besteht bei oral verabreichtem Rilpivirin aufgrund von Wechselwirkungen mit Protonenpumpenhemmern eine Kontraindikation, bei oral verabreichtem Cabotegravir stören hingegen Interaktionen mit Antazida, Mineralstoffen und sonstigen mehrwertigen Kationen. Stehen keine relevanten Nebenwirkungen der Therapieaufnahme im Wege, wird am letzten Tag der oralen Einleitungsphase mit der intramuskulären Injektionstherapie begonnen. Zunächst mit einer Initiierungsphase, in der die beiden Substanzen einmal monatlich in Monat zwei und drei injiziert werden, um ein wirksames Depot aufzubauen. Ab Monat fünf geht die Behandlung über in die Erhaltungsphase, in der die Applikationsfrequenz alle zwei Monate beträgt. Sowohl in der Initiierungs- als auch in der Erhaltungsphase werden an einem Termin zwei Spritzen verabreicht: 3 ml Vocabria® (600 mg Cabotegravir) werden in einen Gesäßmuskel und 3 ml Rekambys® (900 mg Rilpivirin) in den anderen Gesäßmuskel injiziert (siehe Kasten „In den Muskel mit der Z-Track-Methode“). Als Eselsbrücke bietet sich an, Rilpivirin immer auf der rechten Körperseite anzuwenden. Bei einheitlichem Vorgehen ist so nachvollziehbar, welcher Wirkstoff für mögliche Injektionsreaktionen verantwortlich ist. Sollten Injektionstermine absehbar nicht eingehalten werden können, kann für eine Dauer von maximal zwei Monaten eine orale Überbrückungstherapie mit Cabotegravir/Rilpivirin erfolgen. Es muss beachtet werden, dass die beiliegenden Injektionsnadeln mit einer Länge von 38 mm nicht für adipöse Patienten geeignet sind, hier müssten längere, praxiseigene Injektionsnadeln gewählt werden, um den Gesäßmuskel sicher zu erreichen.
In den Muskel mit der Z-Track-Methode
Die intramuskuläre, ventrogluteale Injektion erfolgt in Seiten- oder Rückenlage in den möglichst entspannten Musculus gluteus medius nach der sogenannten „Z-Track-Methode“ (s. Abb. 2). Hierbei muss die Haut an der Injektionsstelle um circa 2,5 cm zur Seite gezogen und gehalten werden, wodurch sich Epidermis, Dermis und Unterhautgewebe in diese Richtung verschieben. Dann erst wird die Nadel in einem 90°-Winkel eingeführt und die Suspension langsam über mehrere Minuten in den Gesäßmuskel verabreicht. Anschließend wird die Kanüle bei weiterhin heruntergedrücktem Spritzenkolben herausgezogen, dann wird sofort die zurückgehaltene Haut losgelassen. Hierdurch kehren die Hautschichten in ihre ursprüngliche Position zurück, die im Muskel befindliche Suspension kann nicht dem Stichkanal folgen, sie verbleibt im Muskel. So können Leckagen mit nicht kalkulierbarem Wirkstoffverlust verhindert werden. Weil die Spur der Kanüle nun scheinbar einen Z-förmigen Verlauf genommen hat, spricht man von der „Z-Track- oder Zickzack-Methode“.
Mehr Aufwand für Praxen
Die neue Therapieform stellt HIV-Schwerpunktpraxen vor gewisse organisatorische und personelle Herausforderungen. Um einen reibungslosen Ablauf zu gewährleisten, muss das Termin- und Rezeptmanagement gut funktionieren, damit Patienten ihre Medikation in den vorgesehenen Abständen erhalten. Es empfiehlt sich, die Termine für beispielsweise ein Jahr im Voraus zu planen und kontinuierlich fortzuschreiben. Abweichungen von sieben Tagen vor bis sieben Tagen nach dem gewählten Injektionszeitpunkt können dabei toleriert werden und sind zum Beispiel dann hilfreich, wenn der gewählte Tag auf ein Wochenende fällt oder sich der Patient (planmäßig) auf Reisen befindet. Gegebenenfalls müssen Patienten kurz vor den Terminen oder im Versäumnisfall erinnert werden. Die Abläufe können apothekenseitig unterstützt werden, falls Patienten einer Liefervereinbarung der Medikamente an die Arztpraxis zustimmen. Nicht nur bei der Terminplanung und -nachverfolgung, sondern auch bezüglich der Applikation müssen die praxisindividuellen Kapazitäten berücksichtigt werden, gerade bei starker Nachfrage [5]. Schließlich müssen pro Patient gleich zwei Injektionen vorbereitet und von speziell geschultem Personal appliziert werden. Es ist zwar keine Verdünnung oder Rekonstitution erforderlich, aber beide Suspensionen sind nicht sofort applikationsfertig. Zum einen muss das gekühlt gelagerte Rilpivirin vor der Applikation Raumtemperatur erlangen, und zum anderen befinden sich beide Suspensionen in Durchstechflaschen. Diese müssen zur Homogenisierung geschüttelt und anschließend in Spritzen aufgezogen werden. Aufgrund der großen Volumina von jeweils drei Millilitern muss zwingend über mehrere Minuten langsam injiziert werden. Studienärzte, die damit schon praktische Erfahrung haben, empfehlen eine Injektionsdauer von jeweils drei bis fünf Minuten. Es ist daher ratsam, einen ruhigen Behandlungsraum vorzuhalten und Störungen zu vermeiden, damit der Patient während der Prozedur entspannt ist.
Erleichterungen für Patienten
Im Vergleich zu Single-Tablet-Regimen ergeben sich für HIV-Patienten, die für die neue Depot-Injektion infrage kommen, vielfältige Vorteile. Ein zentraler Nutzen ist, dass nur an sechs Tagen pro Jahr eine Arzneimittelapplikation erfolgt. Dennoch sind weitere Arztbesuche, zum Beispiel zur Überwachung der Virussuppression oder zur Ausstellung von Rezepten, einzuplanen. Dies bedeutet aber für Patienten, die eine tägliche Tabletteneinnahme als psychisch belastend empfunden haben, oder die sich sorgen, die tägliche Einnahme zu vergessen, oder bei denen die regelmäßige Einnahme aufgrund von Schichtdiensten, häufigen Reisen oder Schluckbeschwerden nicht gut handhabbar war, eine wesentliche Erleichterung. Sie müssen sich nicht mehr täglich mit ihrer Erkrankung auseinandersetzen und erleben unter anderem dadurch eine höhere Behandlungszufriedenheit, wie in den Zulassungsstudien gezeigt werden konnte [1, 2]. Ein weiterer Vorteil ergibt sich für diejenigen, die ihre HIV-Infektion vor Familienmitgliedern oder anderen Kontaktpersonen geheim halten wollen, da es sich um eine diskrete Behandlungsoption handelt. Vermutlich eröffnet sich so manchem eine Therapie, die er oder sie aus Angst vor Stigmatisierung, Gewalt oder Verstoß im Falle eines Bekanntwerdens der Erkrankung möglicherweise bisher nicht ergriffen hat. Gerade für Frauen, die hierzulande oder im Ausland in ungleichen Partnerschaften oder Abhängigkeiten leben, wäre dies eine hoffnungsvolle Perspektive. Nicht zuletzt kann die langwirksame HIV-Therapie mit ihren regelmäßigen Arztkontakten zu stabilen Plasmaspiegeln und konstanter Virussuppression beitragen, sofern die Adhärenz stimmt und die Injektionen wie vorgesehen erfolgen. |
Literatur
[1] Swindells S et al. Long-acting Cabotegravir and Rilpivirine for Maintenance of HIV-1 suppression. N Engl J Med 2020;382:1112-1123, DOI: 10.1056/NEJMoa1904398
[2] Orkin C et al. Long-Acting Cabotegravir and Rilpivirine after Oral Induction for HIV-1 Infection. N Engl J Med 2020;382:1124-1135, DOI: 10.1056/NEJMoa1909512
[3] Orkin C et al. Long-acting cabotegravir plus rilpivirine for treatment in adults with HIV-1 infection: 96-week results of the randomised, open-label, phase 3 FLAIR study. Lancet HIV 2021;8(4):e185-e196, doi: 10.1016/S2352-3018(20)30340-4
[4] Overton ET et al. Long-acting cabotegravir and rilpivirine dosed every 2 months in adults with HIV-1 infection (ATLAS-2M), 48-week results: a randomised, multicentre, open-label, phase 3b, non-inferiority study. Lancet 2020;396(10267):1994-2005, DOI:10.1016/S0140-6736(20)32666-0
[5] Mantsios A et al. Multi-level considerations for optimal implementation of long-acting injectable antiretroviral therapy to treat people living with HIV: perspectives of health care providers participating in phase 3 trials. BMC Health Services Research 2021;21:255, https://doi.org/10.1186/s12913-021-06214-9

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.