
- DAZ.online
- DAZ / AZ
- DAZ 10/2022
- Gegen das Vergessen
Alzheimer-Demenz
Gegen das Vergessen
Was die Alzheimer-Therapie derzeit leisten kann
„Ich habe mich sozusagen verloren.“ Diesen Satz äußerte Auguste Deter mehrmals gegenüber Alois Alzheimer. Als erste Patientin der später nach ihrem Arzt benannten Krankheit beschreibt ihre Aussage den Charakter der Erkrankung verblüffend prägnant. Ein typischer Verlauf beginnt zunächst mit Einschränkungen der Lern- und Merkfähigkeit. Betroffene verlegen häufiger Dinge, vergessen Namen oder ringen im Gespräch nach den passenden Worten. Mittel- und langfristig entgleiten den Patienten länger zurückliegende Erinnerungen, ihre Orientierung geht verloren, ihre körperlichen Fähigkeiten schwinden. Selbst geliebte Menschen werden zu Fremden. Die Patienten benötigen dann eine intensive Pflege und werden in ihrer letzten Lebensphase palliativ betreut. Medizinisch objektiviert werden kann der Verlauf anhand verschiedener Skalen wie z. B. dem Mini-Mental-Status-Test (MMST, s. Kasten „Mini-Mental-Status-Test“).
Mini-Mental-Status-Test
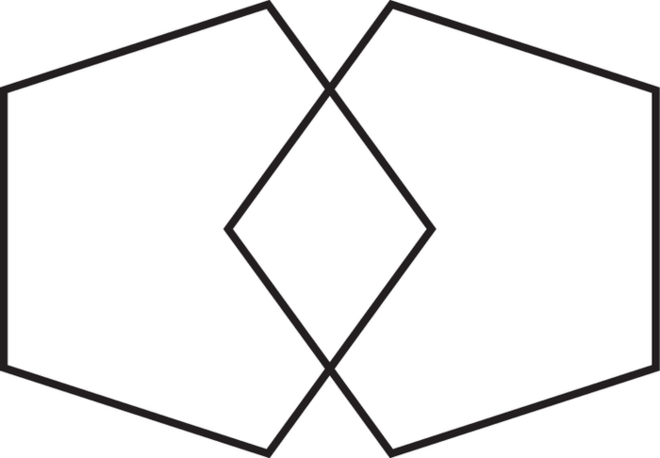
Der Mini-Mental-Status-Test (MMST) ist einer von verschiedenen Tests, um den Schweregrad einer Demenz einzuschätzen. Er ist Teil einer ausführlichen Diagnostik zur Überprüfung von Fähigkeiten und kognitiven Einschränkungen. Mittels Handlungsaufgaben und praxisnahen Fragen werden räumliche Orientierungsprobleme, Merkfähigkeit, Erinnerungsfähigkeit, Aufmerksamkeit, Rechenfähigkeit und Sprache geprüft. Die Abb. 1 zeigt eine geometrischer Form, die gezeichnet werden soll. Entsprechend der erreichten Punkte wird das Testergebnis interpretiert:
30 bis 27: keine Demenz
26 bis 20: leichte Demenz
19 bis 10: mittelschwere Demenz
≤ 9: schwere Demenz
Plaques und Fibrillen im Zentrum
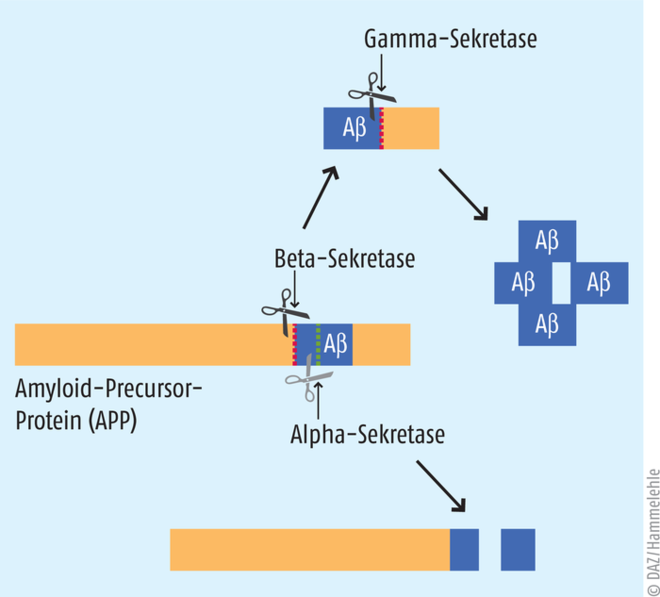
Alois Alzheimer beschrieb als Erster die pathophysiologischen Manifestationen dieser „eigenartigen Krankheit der Hirnrinde“ an Hirnschnitten seiner Patientin Auguste Deter. Er beobachtete neben atrophierten Hirnarealen Einlagerungen im Kortex und Neurofibrillen in den Nervenzellen – heute bekannt als senile Beta-Amyloid-Plaques und Tau-Fibrillen, die noch immer den Schwerpunkt der Alzheimer-Forschung bilden. Das Plaque-Peptid Beta-Amyloid wird in den Neuronen durch enzymatische Spaltung aus dem Amyloid-Precursor-Protein, einem Membranprotein, gebildet (s. Abb. 2). Die beiden Enzyme Beta-Sekretase (BACE1) und Gamma-Sekretase spalten nacheinander das Protein, bis nur noch Beta-Amyloid-Fragmente übrigbleiben und ins Interstitium abgegeben werden. Freies Beta-Amyloid neigt dort zur Aggregation. Mehrere Moleküle lagern sich zu Oligomeren zusammen, die sich zu Protofibrillen, Fibrillen und schlussendlich zur Plaque organisieren. Die Amyloid-Agglomerate stören bspw. die Aktivität der Synapsen und können die zerebrale Blutung beeinflussen. Wurde früher noch angenommen, dass diese Ablagerungen die Neurodegeneration verursachen, wird deren Rolle mittlerweile kontroverser diskutiert. Womöglich sind vor allem die kleineren Beta-Amyloid-Oligomere am toxischsten [1]. Eine andere These lautet, dass die Plaques eher Vermittler als Verursacher der Neurodegeneration sind, bspw. indem sie das zweite pathophysiologische Kardinalzeichen der Krankheit fördern, die intrazellulären Tau-Fibrillen bzw. Tangles [2]. Tau ist ein Protein, welches mit den Mikrotubuli interagiert und damit zur Funktion des Zytoskeletts der Neuronen beiträgt. Tau ist aufgrund zahlreicher basischer Aminosäuren sehr hydrophil und weist nativ keine Faltung auf. Unter gewissen Umständen kann das Molekül aber zu Oligomeren und Fibrillen aggregieren. Bei Alzheimer-Patienten geschieht dies durch eine Hyperphosphorylierung des Tau-Proteins. Beta-Amyloid scheint diesen Vorgang zu fördern [2]. Die gebildeten Fibrillen sind wasserunlöslich und lagern sich im Inneren der Nervenzellen ab und gehören womöglich zu den Hauptverursachern der Neurodegeneration. Im Gegensatz zum Beta-Amyloid korreliert die Dichte der Tau-Fibrillen zumindest direkt mit der kognitiven Beeinträchtigung der Patienten [3]. Morbus Alzheimer wird aufgrund dieser fehlerhaften Tau-Proteine auch als Tauopathie klassifiziert.
Abb. 2: Beta-Amyloid, Hauptbestandteil der senilen Plaques (Aβ) ist ein Abbauprodukt des Amyloid-Precursor-Proteins. Das Enzym Beta-Sekretase spaltet den N-terminalen Teil des Proteins ab. Im nächsten Schritt greift die Gamma-Sekretase an und entfernt den C-terminalen Rest. Dabei entstehen verschieden lange Fragmente des Beta-Amyloids, die entweder 38, 40 oder 42 Aminosäuren lang sind und miteinander zu Oligomeren, Fibrillen und Plaques aggregieren. Alternativ kann das Amyloid-Precursor-Protein auch durch die Alpha-Sekretase abgebaut werden. Das Enzym greift zwischen den Schnittstellen der beiden anderen Sekretasen an und produziert so ein größeres Spaltprodukt, das nicht mehr zum Beta-Amyloid transformiert werden kann und blockiert diesen schädlichen Stoffwechselweg.
Bislang gibt es nur Theorien, wie die pathologischen Amyloid- und Tau-Veränderungen induziert werden und wie genau sie letztendlich die Neurodegeneration und damit die Alzheimer-Erkrankung auslösen. Es zeichnet sich aber ab, dass die Genese der Krankheit mulitfaktoriell ist. Genetische Veränderungen wie Mutationen des Amyloid-Precursor-Proteins oder der Präseniline, Bausteine der Gamma-Sekretase sowie der Apolipoprotein-E4-Genotyp und Trisomie 21 sind bekannte Risikofaktoren [2]. Diskutiert werden auch entzündliche Prozesse, Infektionen und Schlafstörungen als mögliche Auslöser [2]. Der größte Einflussfaktor ist allerdings das Alter. Während 1% der 65- bis 74-Jährigen betroffen sind, leiden 23% der über 85-Jährigen an Morbus Alzheimer [4]. Frauen sind überproportional häufig betroffen [4]. Zu den vermeidbaren Risikofaktoren der Krankheit zählen unter anderem Bluthochdruck, Rauchen, übermäßiger Alkoholkonsum, Übergewicht, geringe Bildung, und Kopfverletzungen in der Vergangenheit [5]. Mit einer guten Vorsorge ließen sich nach Angaben der Lancet Commission 40% aller Alzheimer-Erkrankungen verhindern oder zumindest verzögern [5]. Eine enorme Zahl, gerade im Anbetracht der limitierten Therapieoptionen. Die Alzheimer-Erkankung lässt sich derzeit nur symptomatisch behandeln. Disease-modifying Drugs, also krankheitsmodifizierende Arzneimittel, befinden sich noch in der Entwicklung.
Angriffspunkt Acetylcholin
Alzheimer-Patienten werden anfänglich meist mit Acetylcholinesterase-Inhibitoren therapiert. Im Laufe der Erkrankung sterben cholinerge Neuronen in wichtigen zerebralen Nuclei wie dem Nucleus basalis Meynert ab. Da die Nervenzellen in weite Teile der Großhirnrinde projizieren, entsteht ein cholinerges Defizit, sobald dieser Input schwindet. Der Neurotransmittermangel wird mit den frühen Aufmerksamkeits- und Merkfähigkeitsstörungen in Verbindung gebracht. Acetylcholinesterase-Inhibitoren erhöhen die Acetylcholin-Konzentration im synaptischen Spalt und kompensieren diesen Mangel teilweise. Zur Behandlung der leichten und mittelschweren Alzheimer-Demenz zugelassen sind die Wirkstoffe Donepezil (Aricept®), Rivastigmin (Exelon®) und Galantamin (Reminyl®). Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat 2007 den Nutzen Acetylcholinesterase-Inhibitoren bewertet und 2012 um einen weiteren Bericht ergänzt: alle Substanzen verbessern die Alltagsfunktion und Kognition der Patienten gegenüber Placebo [6, 7]. Unterschiede in der Wirksamkeit bestehen nicht, die liegen vor allem in der Pharmakokinetik. Donepezil bspw. weist die längste Halbwertzeit auf und muss deshalb nur einmal täglich eingenommen werden. Welche der drei Substanzen für die Therapie ausgewählt wird, soll vor allem nach den Wechselwirkungen und Nebenwirkungen der verschiedenen Wirkstoffe entschieden werden [8]. Da die Acetylcholinesterase-Inhibitoren dosisabhängig wirken, ist die höchste verträgliche Dosis anzustreben (s. Tab.).
Wirkstoff | Applikationsform | Einnahme | tägliche Startdosis | Maximal-Dosis | minimal wirksame Dosis |
|---|---|---|---|---|---|
Donepezil | Tabletten: 5 mg bzw. 10 mg Schmelztabletten: 5 mg bzw. 10 mg | einmal täglich | 5 mg abends | 10 mg | 5 mg |
Galantamin | retardierte Hartkapseln: 8 mg; 16 mg; 24 mg | einmal täglich | 8 mg retard morgens | 24 mg | 16 mg |
Lösung: 1 ml entspricht 4 mg | zweimal täglich | 4 mg morgens und abends | |||
Rivastigmin | Hartkapseln: 1,5 mg; 3 mg, 4,5 mg bzw. 6 mg | zweimal täglich | 1,5 mg morgens und abends | 12 mg | 6 mg |
Lösung: 1 ml entspricht 2 mg | zweimal täglich | morgens und abends | |||
transdermales Pflaster: 4,6 mg/24 Stunden; 9,5 mg/24 Stunden; 13,3 mg/24 Stunden | einmal täglich | 4,6 mg/24 Stunden | 9,5 mg 13,3 mg (nach sechs Monaten Behandlung mit 9,5 mg mit klinischer Progression) | 9,5 mg | |
Memantin | Tabletten: 10 mg bzw. 20 mg zur Aufdosierung: 5 mg bzw. 15 mg | ein- oder zweimal täglich | 5 mg | 20 mg | 20 mg |
Tropfen: 1 ml oder 20 Tropfen entspricht 10 mg | zweimal täglich | ||||
Ginkgo-biloba-Spezialextrakt EGb 761 | Tabletten: 120 mg bzw. 240 mg | einmal täglich | 240 mg | 240 mg | 240 mg |
Trotz der Therapie lässt sich die Krankheit nicht aufhalten und schreitet auch unter Acetylcholinesterase-Inhibitoren unaufhaltsam fort. Was passiert, wenn Patienten in das letzte, schwere Krankheitsstadium eintreten und die Einnahme der Cholinergika per definitionem nun off-label erfolgt? Werden die Medikamente nach längerer Einnahme abgesetzt, ist laut der Demenz-Leitlinie trotz Krankheitsprogression zu erwarten, dass sich der Zustand des Patienten zusätzlich verschlechtert. Beendet werden sollte die Behandlung deshalb nur in Ausnahmefällen, bspw. wenn die Nebenwirkungen nicht mehr tolerabel sind [8]. Die Demenz-Leitlinie legt nahe, dass vorbehandelte Patienten weiter therapiert werden sollten, aber auch, dass Erkrankte, die erst im schweren Stadium auf Acetylcholinesterase-Inhibitoren eingestellt werden, profitieren können [8]. Entsprechende Studien sprechen für die Wirksamkeit dieses Off-Label-Ansatzes. Donepezil und Rivastigmin verbesserten die Kognition und Alltagsfähigkeit schwer Erkrankter, während Galantamin nur die Kognition günstig beeinflusste [8]. In den USA sind Donepezil und Rivastigmin entgegen dem hiesigen Status deshalb zur Behandlung der schweren Alzheimer-Demenz zugelassen.
Toxisches Glutamat mit Memantin aufwiegen
Der zweite Eckpfeiler der medikamentösen Therapie des Morbus Alzheimer ist der N-Methyl-D-Aspartat(NMDA)-Antagonist Memantin (Axura®). Absterbende Neurone setzen Glutamat frei, das in erhöhten Konzentrationen Nervenzellen überstimuliert und zu einem starken Calciumeinstrom führt, der letztendlich den Zelltod vermittelt (Exzitotoxizität). Ein Teufelskreis setzt sich in Gang, den Memantin abzuschwächen verspricht. Zugelassen ist der Wirkstoff zur Behandlung der moderaten und schweren Alzheimer-Demenz. Patienten profitieren von einer besseren Kognition und Alltagsfunktion, der klinische Gesamteindruck wird ebenfalls verbessert [8]. Memantin wird in wöchentlichen 5-mg-Schritten über drei Wochen auf eine Erhaltungsdosis von 20 mg täglich aufdosiert (s. Tab. 1). Obwohl ein Cochrane-Review auch einen geringen Effekt auf die Kognition von Alzheimer-Patienten in der leichten Krankheitsphase attestierte [9], konnte dies in einer späteren Metaanalyse nicht bestätigt werden [10]. Die Demenz-Leitlinie spricht sich deshalb gegen einen frühen Einsatz des Wirkstoffs aus [8].
Da sowohl Acetylcholinesterase-Inhibitoren und Memantin an unterschiedlichen Punkten angreifen, drängt sich die Frage auf, ob die Antidementiva in Kombination additiv wirken könnten. Für leichte und mittelschwere Alzheimer-Demenzen ist die Kombination einem Acetycholinesterase-Inhibitor allein aber nicht überlegen, bei schweren Fällen ist die Datenlage zu widersprüchlich [8]. Laut Leitlinie kann die Kombinationstherapie dann aber trotzdem erwogen werden.
Antidementiva nicht unumstritten
Ein häufig vorgebrachter Kritikpunkt an den beiden Antidementiva-Klassen ist die geringe Wirkstärke. Beispielsweise ermittelte der Cochrane-Review für Donepezil, dass sich die mit dem Wirkstoff behandelten Patienten beim Mini-Mental-Status-Test nur um 1,1 Punkte besser schlugen [11]. Die anderen Antidementiva erreichen ähnliche Werte. Die Frage, wie relevant solch eine Verbesserung für den Patienten und die Angehörigen ist, kann nicht zufriedenstellend beantwortet werden. Ebenso unklar ist, wie der Erfolg der Therapie in der Praxis gemessen werden sollte. Schließlich kann auch trotz verschlechterter Symptomatik immer noch eine Wirkung der Medikamente vorliegen [8]. Insbesondere die langfristigen Effekte sind aufgrund einer Dauer der meisten relevanten Studien von 24 Wochen nur wenig untersucht. Die Demenz-Leitlinie empfiehlt, die Therapie langfristig fortzusetzen, da nach den Ergebnissen der DOMINO-Langzeitstudie sich der Zustand der Patienten signifikant verschlechtert, wenn Donepezil abgesetzt wurde [12]. Kritiker wenden aber ein, dass auch ein Absetzsyndrom für die beobachtete Verschlechterung verantwortlich sein könnte [13].
Auf die Seite der Kritiker hat sich auch der französische Staat geschlagen, der entschieden hat, dass ab 1. August 2018 die Antidementiva Donepezil, Rivastigmin, Galantamin und Memantin nicht mehr durch die staatliche Gesundheitsversicherung erstattungsfähig sind. Neben den Zweifeln an der klinischen Bedeutsamkeit der Präparate werden auch Warnungen über ein erhöhtes Bradykardie-Risiko der Cholinergika ins Feld geführt. Die französischen Gesundheitsbehörden erhoffen sich durch die Entscheidung einen verstärkten Fokus auf nicht-pharmakologische Therapieverfahren [14].
Das Ginkgo-Blatt wendet sich
Der Extrakt aus Ginkgo-biloba-Blättern, genauer gesagt der standardisierte Spezialextrakt EGb 761® (Tebonin®), ist der Dritte im Bunde der Antidementiva. Hauptinhaltsstoffe einer Tagesdosis von 240 mg Trockenextrakt sind die Flavonglykoside (hauptsächlich Quercitin, Kämpferol und Isorhamnetin) mit 52,8 bis 64,8 mg und die Terpenlactone (6,72 bis 8,16 mg Ginkgolide A, B und C, sowie 6,24 bis 7,68 mg Bilobalid) sowie weniger als 1,2 µg der unverträglichen Ginkgolsäuren. Zugelassen ist der Extrakt bei hirnorganisch bedingten geistigen Leistungseinbußen bei demenziellen Syndromen, das Einsatzgebiet weist also über die Alzheimer-Demenz hinaus. Der Wirkmechanismus des Extrakts ist nicht genau bekannt. Man nimmt an, dass der Extrakt die Fließeigenschaften des Blutes verbessert und für eine bessere Durchblutung bestimmter Hirnareale sorgt. Aber auch eine verminderte Aggregation des Beta-Amyloids wird debattiert [15].
Obwohl der Ginkgo-biloba-Extrakt zu den am häufigsten bei Demenzen eingesetzten (Phyto)-Pharmaka zählt, wird der Blatt-Extrakt immer noch äußerst kontrovers diskutiert, Tendenz aber wohlwollend. Seit dem Cochrane-Review aus dem Jahre 2007, der dem Blatt-Extrakt aufgrund der inkonsistenten Ergebnislage eine fehlende Wirksamkeit attestierte (2002 befand das Institut das Phytopharmakon noch als „promising“), hat sich in dem Feld einiges getan. Ein IQWiG-Gutachten aus dem Jahr 2008 sah eine Verbesserung der Aktivität des täglichen Lebens und identifizierte Hinweise auf einen Nutzen im Hinblick auf Kognition, psychopathologische Symptome und Lebensqualität bei einer täglichen Dosis von 240 mg. Neuere Studien und Übersichtsarbeiten zeigen in eine ähnliche Richtung und berichten von verbesserten kognitiven Parametern und Kennzahlen der Alltagsfunktion durch den Ginkgo-Extrakt im Vergleich zu Placebo [16, 17]. Das Problem der heterogenen Studienlage im Hinblick auf die Dosis, die gemessenen Parameter und die heterogene Patientenkollektive erschweren aber nach wie vor eindeutige Aussagen. Da die Sicherheit der Therapie aber bestätigt ist und ausreichend Hinweise auf einen möglichen Benefit bestehen, verwehrt sich die Demenz-Leitlinie diesem Ansatz nicht und spricht eine Kann-Empfehlung aus [8]. Auch das Cochrane-Institut plant eine Neubewertung der aktuellen Evidenz. Die Therapie mit dem Phytopharmakon ist in der Tagesdosis von 240 mg erstattungsfähig und sollte über mindestens acht Wochen durchgeführt werden. Die Wirksamkeit geringerer Dosen ist nicht belegt.
Auch die Psyche leidet
Flankiert wird der kognitive Verfall der Alzheimer-Patienten zusätzlich von Veränderungen im psychischen Erleben und durch Verhaltensänderungen. Die Krankheit selbst stellt die Betroffenen vor große Herausforderungen. Sie finden sich zum Beispiel weniger in ihrer Umwelt zurecht oder müssen körperliche Einschränkungen verkraften. Gleichzeitig verändern die degenerativen Prozesse im Gehirn der Erkrankten die Funktionsfähigkeit verschiedener Hirnareale und triggern Neurotransmitter-Ungleichgewichte [8]. Die aus der Balance geratene Psyche reagiert unkontrollierter auf belastende Reize. Depressionen, Wutanfälle, Ängste oder Wahnvorstellungen sind die Folge.
Werden Pharmaka eingesetzt, so muss vorsichtig agiert werden. Demenz-Patienten sind aufgrund der neurologischen Veränderungen, ihres Alters wegen und aufgrund eventueller Komorbiditäten besonders vulnerabel für Nebenwirkungen von Psychopharmaka. Die S3-Leitlinie „Demenzen“ definiert deshalb verschiedene Grundsätze, die beachtet werden müssen, wenn Demenz-Patienten mit psychotropen Wirkstoffen behandelt werden [8]. Substanzen mit anticholinerger Wirkkomponente sind zu meiden, da sie das ohnehin schon bestehende cholinerge Defizit verstärken und delirogene Wirkungen sowie negative Effekte auf die Kognition ausüben. Sedierende Pharmaka sollten ebenso wenig eingesetzt werden. Sie verstärken die Sturzgefahr und beeinträchtigen die kognitive Leistung. Die Indikationsstellung für Antipsychotika sollte besonders streng erfolgen, da sie mit einem erhöhten Risiko für Mortalität und zerebrovaskuläre Ereignisse assoziiert sind [8]. Selbstverständlich beachtet werden sollten außerdem Regeln zur Medikation älterer Menschen (z. B. Priscus-Liste) und mögliche Wechselwirkungen.
Bringt Aducanumab die Wende?
Antidementiva und Psychopharmaka stoßen allerdings oft an ihre Grenzen, gerade im fortgeschrittenen Stadium der Erkrankung. Die Behandler greifen deshalb zusätzlich auf vielfältige nicht-pharmakologische, psychosoziale Therapieformen zurück. Beispielsweise üben Formen der kognitiven Stimulation, Reminiszenztherapien oder künstlerische Therapien günstige Effekte auf die Symptome aus. Für einen echten Fortschritt in der Behandlung werden aber krankheitsmodifizierende Wirkstoffe benötigt. Die FDA hat im Juni 2021 mit dem therapeutischen Antikörper Aducanumab (Aduhelm) ein solches Arzneimittel zugelassen, die Europäische Arzneimittel-Agentur (EMA) hat die Zulassung von Aducanumab bisher abgelehnt. Ob Aducanumab dem Label „disease-modifying“ wirklich gerecht wird, muss noch bestätigt werden. Bis jetzt steht nur fest, dass es die Amyloid-Plaques im Gehirn reduzieren kann. Ob und wie dieser Befund in Beziehung zu verbesserten kognitiven Endpunkten steht, wird derzeit in einer Phase-IV-Studie untersucht. Bis im Jahre 2026 Ergebnisse feststehen, bleibt es dabei, die Betroffenen mit den derzeitig erhältlichen pharmakologischen und psychosozialen Maßnahmen so gut wie möglich zu versorgen. |
Literatur
[1] Sengupta U et al. The Role of Amyloid-β Oligomers in Toxicity, Propagation, and Immunotherapy. E Bio Medicine 2016;6:42-49
[2] Long JM und Holtzmann DM. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies. Cell 2019;179:312-339
[3] Nelson PT et al. Correlation of Alzheimer Disease Neuropathologic Changes With Cognitive Status: A Review of the Literature. J Neuropathol Exp Neurol. 2012;71:362-381
[4] Niu H et al. Prevalence and incidence of Alzheimer‘s disease in Europe: A meta-analysis. Neurologia 2017;32:523-532
[5] Livingston G et al. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 2020;396:413-446
[6] Cholinesterasehemmer bei Alzheimer Demenz. Abschlussbericht A05-19A, 2007, Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) (Hrsg.)
[7] Cholinesterasehemmer bei Alzheimer Demenz: Ergänzungsauftrag Rivastigmin-Pflaster und Galantamin. Abschlussbericht A09-05, 2012, Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) (Hrsg.)
[8] Demenzen. S3-Leitlinie, Hrsg. Deutsche Gesellschaft für Psychiatrie, Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN) und Deutschen Gesellschaft für Neurologie (DGN), AWMF-Registernummer: 038-013, Stand Januar 2016, www.awmf.org/leitlinien
[9] McShane R et al. Memantine for dementia. Cochrane Database Syst Rev 2006;2:CD003154
[10] Schneider LS et al. Lack of Evidence for the Efficacy of Memantine in Mild Alzheimer Disease. Arch Neurol 2011;68:991-998
[11] Birks JS und Harvey RJ. Donepezil for dementia due to Alzheimer‘s disease. Cochrane Database Syst Rev 2018;6:CD001190
[12] Howard R et al.: Donepezil and memantine for moderate-to-severe Alzheimer‘s disease. N Engl J Med 2012;366:893-903
[13] Schneider LS. Discontinuing donepezil or starting memantine for Alzheimer‘s disease. N Engl J Med 2012;366:957-959
[14] Walsh S et al. France removes state funding for dementia drugs. BMJ 2019;367:l6930
[15] Luo Y et al. Inhibition of amyloid-beta aggregation and caspase-3 activation by the Ginkgo biloba extract EGb761. PNAS 2002;99:12197-12202
[16] Gauthier S und Schlaefke S. Efficacy and tolerability of Ginkgo biloba extract EGb 761® in dementia: a systematic review and meta-analysis of randomized placebo-controlled trials. Clin Interv Aging 2014;9:2065-2077
[17] Yuan Q et al. Effects of Ginkgo biloba on dementia: An overview of systematic reviews. J Ethnopharmacol 2017;195:1-9






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.