
- DAZ.online
- DAZ / AZ
- DAZ 35/2022
- Viel Gewicht – wenig ...
Pharmakotherapie
Viel Gewicht – wenig Wirkung
Körperfett kann die Effektivität von Arzneimitteln reduzieren
Mehr als die Hälfte der Deutschen ist zu dick, knapp ein Viertel gilt sogar als adipös, ein beileibe nicht nur auf die Bundesrepublik begrenztes Phänomen [1]. Nach Angaben der WHO ist die Adipositas weltweit auf dem Vormarsch. Seit 1975 hat sich die Prävalenz verdoppelt und ist längst nicht mehr nur ein Problem der reichen Staaten, der Anteil der Übergewichtigen in den Entwicklungs- und Schwellenländern wächst rasant [2]. Aber ab wann ist zu viel wirklich zu viel? Die WHO definiert die verschiedenen Gewichtsklassen mithilfe des BMI, also dem Verhältnis des Gewichts zum Quadrat der Körpergröße: Mit einem BMI zwischen 18,5 kg/m2 und unter 25 kg/m2 fällt man in die Kategorie Normalgewicht, entsprechend wird ein BMI < 18,5 kg/m2 als Untergewicht klassifiziert und > 25 kg/m2 als Übergewicht. Ab einem Grenzwert von 30 kg/m2 beginnt die Adipositas, die sich in drei Schweregrade auffächert:
- Grad I: BMI > 30 kg/m2,
- Grad II: BMI > 35 kg/m2 und
- Grad III: BMI > 40 kg/m2.
Als behandlungsbedürftig zählen alle Schweregrade. Überflüssige Pfunde stellen ein globales Gesundheitsproblem dar. Übergewicht und Fettleibigkeit sind Risikofaktoren für kardiovaskuläre Erkrankungen, Osteoarthritis, Demenz, Depression, Krebserkrankungen und anderes.
Mit Blick auf die Arzneimitteltherapie bei Übergewichtigen und Adipösen sind die Konsequenzen auf die Pharmakokinetik vieler Wirkstoffe offensichtlich, vordergründig ein erhöhtes Verteilungsvolumen und eine veränderte Clearance der Arzneistoffe. In den meisten Fällen muss die Therapie nicht angepasst werden, da viele Wirkstoffe eine genügend große therapeutische Breite aufweisen, die diese Unterschiede abfedert. Kritische Wirkstoffklassen, bei denen das Gewicht aber eine Rolle spielt, sind beispielsweise Zytostatika, Antiinfektiva oder niedermolekulare Heparine. Über einen Kamm geschert werden können diese Wirkstoffe aber nicht, da die Auswirkungen des Übergewichts auf den Weg der Arzneistoffe durch den Körper von den physikochemischen Eigenschaften der Moleküle abhängen. Verschiedene Gewichtsmaße tragen dieser Tatsache Rechnung. Die Dosierung kritischer Wirkstoffe erfolgt neben der Anpassung an das reale Körpergewicht beispielsweise auch nach der Körperoberfläche, dem Idealgewicht, dem fettfreien Körpergewicht oder der Nierenfunktion.
Lernziele
In diesem Beitrag erfahren Sie unter anderem:
- wie sich Übergewicht und Adipositas auf das Immunsystem auswirken
- welche Zelltypen dabei eine besondere Rolle spielen
- wie eine übergewichtsassoziierte Inflammation die Pharmakotherapie beeinflussen kann
- wie Adipositas Asthma vortäuschen kann
Fettgewebe ist immunologisch aktiv
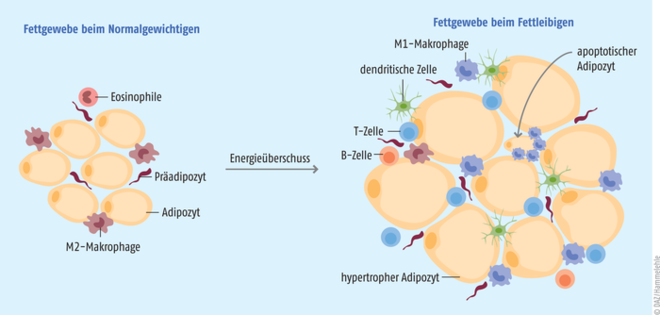
Der Einfluss des Fettgewebes auf die Pharmakotherapie endet aber nicht bei der Pharmakokinetik. Als metabolisch und endokrinologisch aktives Gewebe beeinflusst das Fettgewebe den gesamten Organismus und greift aktiv in die Pathophysiologie verschiedener Krankheiten ein. Den überflüssigen Pfunden könnte so eine entscheidende Rolle beim Therapieerfolg zukommen. Wenn wir vom Fettgewebe sprechen, meinen wir in der Regel das weiße Fettgewebe. Braunes und beiges Fettgewebe dienen in erster Linie der Wärmeproduktion. Neben seiner Rolle als Depotfett, Isolier- und Baufett sezerniert das weiße Körperfett als stoffwechselaktives Gewebe auch endokrin und parakrin aktive Hormone und Zytokine, sogenannte Adipokine. Damit stehen die Fettdepots in direkter Kommunikation mit anderen Organen, z. B. dem Gehirn, der Leber, dem kardiovaskulären System, aber auch dem Immunsystem (s. Tab.). Zum Gesundheitsrisiko wird das weiße Fett erst, wenn es überhandnimmt (s. Abb. 1). Bei einem Energieüberschuss wachsen die Adipozyten, sowohl in Größe als auch in ihrer Zahl. Kurzfristig kein Problem, chronisch aber führen Umbauprozesse im Fettgewebe zu fibrotischen Veränderungen und zur Hypertrophie bzw. zum Absterben von Adipozyten [3]. Hypertrophe Adipozyten wiederum setzen vermehrt Leptin und proinflammatorische Zytokine wie z. B. IL-6 frei und weniger antiinflammatorische Peptide wie Adiponektin [3]. Angelockt von all diesen Prozessen, wandern Immunzellen in das Gewebe ein, die zusätzlich Entzündungsmediatoren freisetzen. Insbesondere einwandernde Monozyten, die sich zu proinflammatorischen Makrophagen differenzieren, sezernieren signifikante Mengen TNF-alpha, IL-1b und IL-6 [4]. Die Fettdepots werden zu Herden einer systemischen Entzündung, die mit verschiedenen Folgen wie z. B. der InsulinResistenz oder kardiovaskulären Erkrankungen assoziiert ist. Als besonders gefährlich gilt das viszerale Fettgewebe, welches sich im Bauchraum zwischen den Organen befindet. Warum das so ist, darüber ist sich die Fachwelt noch nicht einig. Einerseits scheinen die viszeralen Fettdepots metabolisch aktiver zu sein, andererseits spielt möglicherweise die zentrale Lage eine Rolle, da die vom viszeralen Fett abgegebenen Moleküle direkt in den Portalvenen drainiert werden und so in besonders hoher Konzentration in der Leber anfluten [3]. Die Zusammenhänge zwischen der Entzündungsreaktion im Fettgewebe und verschiedenen Krankheiten sind komplex und noch lange nicht verstanden. Es zeichnet sich aber ab, dass auch die Pharmakotherapie von der Inflammation beeinträchtigt werden könnte.
Adipokin | Herkunft | Funktion | Einfluss der Adipositas |
|---|---|---|---|
Adiponektin | Adipozyten | verringerte Gluconeogenese erhöhte Insulin-Sensitivität antiinflammatorisch | verringerte Freisetzung |
Adipsin | Adipozyten | proinflammatorisch | verringerte Freisetzung |
Interleukin 6 (IL-6) | Adipozyten, Makrophagen, Immunzellen | proinflammatorisch und antiinflammatorisch je nach Zelltyp | vermehrte Freisetzung |
Leptin | Adipozyten | verringerter Hunger erhöhte Gluconeogenese verminderte Insulin-Resistenz proinflammatorisch | vermehrte Freisetzung |
Retinol binding protein 4 (RBP4) | Adipozyten | erhöhte Insulin-Resistenz proinflammatorisch | vermehrte Freisetzung |
Resistin | Adipozyten, Makrophagen | erhöhte Insulin-Resistenz proinflammatorisch | vermehrte Freisetzung |
Visfatin | Adipozyten, Makrophagen, Immunzellen | proinflammatorisch proapoptotisch | vermehrte Freisetzung |
Abb. 1: Chronische Inflammation bei Adipositas, vereinfacht nach [21]. Auch im gesunden Fettgewebe (links) sind Immunzellen anzutreffen, vor allem regulatorische T-Zellen und antiinflammatorische M2-Makrophagen. Adipozyten sezernieren mehr Adiponektin, das mit antiinflammatorischen Eigenschaften verbunden ist und die Insulin-Sensitivität verbessert. Herrscht im Organismus ein steter Energieüberschuss, so kippt das antiinflammatorische Gleichgewicht und proinflammatorische Prozesse werden angestoßen. Adipozyten vermehren sich und wachsen bzw. werden hypertroph. Hypoxie, absterbende Adipozyten und von Adipozyten freigesetzte Zytokine locken Immunzellen an, vor allem Monozyten, die sich zu den proinflammatorischen M1-Makrophagen polarisieren und signifikante Mengen an TNF-alpha, IL-1b und IL-6 freisetzen. Eine erhöhte Leptin-Freisetzung durch Adipozyten aktiviert Immunzellen ebenfalls dazu, proinflammatorische Zytokine freizusetzen.
Höhere Infektionsneigung und geringerer Impferfolg
Spätestens seit der Sars-CoV-2-Pandemie weiß jeder Laie, dass Übergewicht ein Risikofaktor für einen schwereren Verlauf einer Infektion darstellt. Nicht zuletzt steht die chronische Inflammation des Fettgewebes im Verdacht, die Immunantwort zu beeinträchtigen. Verschiedene Zusammenhänge werden diskutiert. B-Zellen z. B. funktionieren in diesem Entzündungsumfeld nicht optimal und produzieren ihrerseits mehr proinflammatorische Zytokine und weniger antiinflammatorische [5]. Die Gleichgewichte zwischen den Immunzellen im Blut verschieben sich, z. B. zugunsten proinflammatorischer T-Zellen auf Kosten von antiinflammatorischen regulatorischen B-Zellen [5]. Weitere Hypothesen diskutieren den Einfluss von Leptin, welches ebenfalls verschiedene Immunzellen dazu anhält, proinflammatorische Zytokine auszuschütten, oder eine suboptimale Versorgung mit Omega-3-Fettsäuren, die für die Funktion der B-Zellen unabdinglich sind [5]. Adipöse Menschen sind deshalb aufgrund ihres geschwächten Immunsystems anfälliger für Infektionen mit Bakterien, Viren und Pilzen. Bei Atemwegsinfektionen kommt hinzu, dass die Lungenfunktion eingeschränkt ist. Adipösen Menschen fällt es schwerer, die Lunge ausreichend zu belüften. Das Fettgewebe drückt auf die Lunge und verändert die Atemmechanik. Betroffene empfinden die Atmung als anstrengend und atmen deshalb häufiger und flacher.
Dass auch Impfstoffe nur suboptimal wirken können, wenn B-Zellen in ihrer Funktion eingeschränkt sind, erscheint da nur logisch. Und tatsächlich verbanden verschiedene Studien die Adipositas auch mit einer verminderten Wirksamkeit von Impfstoffen. Beispielsweise induzierte die Influenzaimpfung in jungen und alten adipösen Probanden eine signifikant geringere Antikörperantwort als in ihren normalgewichtigen Altersgenossen [5]. Auch Hepatitis-B-Impflinge hatten einer weiteren Untersuchung zufolge eine achtmal höhere Chance, dass die Impfung nicht anschlug, wenn sie übergewichtig waren [6]. Ähnliche Befunde lassen sich für viele weitere Impfstoffe identifizieren. Auch die Einführung der COVID-19-Impfstoffe war von ähnlichen Befürchtungen begleitet. Subgruppen-Analysen zu adipösen Patienten in den Zulassungsstudien der Impfstoffe Comirnaty®, Spikevax® und Jcovden® ergaben aber zumindest kurzfristig keine Wirksamkeitsunterschiede (AstraZeneca hat für seinen Impfstoff Vaxzevria® keine entsprechende Untersuchung durchgeführt) [7]. Aktuellere Untersuchungen zum Comirnaty®-Impfstoff legen mittlerweile wohl doch eine geringere Antikörper-Antwort und auch eine schnellere Abnahme der Antikörper-Titer bei übergewichtigen Menschen nahe [8, 9].
Geringere Wirksamkeit der Biologicals bei Übergewicht
Eine auf der anderen Seite überschießende Immunabwehr liegt den Autoimmunerkrankungen zugrunde. Ob rheumatoide Arthritis, Psoriasis, oder die chronisch-entzündlichen Darmerkrankungen Morbus Crohn und Colitis ulcerosa – fehlgeleitete Immunzellen greifen körpereigene Strukturen an und sorgen für lokale Entzündungsherde mit den entsprechenden Krankheitsfolgen. Moderne Therapeutika, die sogenannten Biologicals, sollen direkt in die Immunantwort eingreifen, z. B. die Antikörper gegen TNF-alpha, Infliximab (Remicade®) oder Adalimumab (Humira®). Beeinflusst die chronische Inflammation des Fettgewebes womöglich auch die Wirksamkeit von Biologicals? Verschiedene Studien deuten in diese Richtung. Eine Metaanalyse untersuchte z. B. den Effekt des Übergewichts bzw. der Adipositas auf den Behandlungserfolg mit traditionellen disease-modifying anti-rheumatic drugs (DMARD) und Biologika bei den rheumatischen Erkrankungen rheumatoide und Psoriasis-Arthritis [10]. Während die Hälfte der normalgewichtigen Patienten eine Krankheitsremission erreichte, war dies nur bei 30% der Patienten mit einem BMI über 30 kg/m2 der Fall. Die Chance für übergewichtige Patienten, ihre Symptome ausreichend in den Griff zu bekommen, war somit um 55% kleiner als die Chance auf Krankheitsremission bei Normalgewichtigen (OR 0,447; p < 0,001). Andere Befunde für die Therapie weiterer chronisch-entzündlicher Krankheiten sprechen eine ähnliche Sprache: Die Chance, dass Psoriasis-Patienten mit systemischen Biologika ihr Therapieziel erreichten, also den Psoriasis-Area-and-Severity-Index (PASI) um 75% oder 90% reduzierten, war einer aktuellen Studie zufolge um 25 bis 30% niedriger, wenn der Patient adipös war [11]. Auch bei Morbus-Crohn-Patienten ließ sich in einer Studie beobachten, wie die Therapie mit Infliximab schon frühzeitig versagte oder gar nicht erst ansprach [12]. Bei der Hälfte der untersuchten übergewichtigen und adipösen Patienten musste das Infliximab-Regime schon frühzeitig, also innerhalb der ersten zwölf Monate, intensiviert werden, sei es dadurch, dass die Dosis erhöht oder das Infusionsintervall verkürzt wurde. Normalgewichtige benötigten nur in einem Fünftel der Fälle eine Anpassung ihrer Therapie. Eine mögliche, attraktive Erklärung für diese Befunde liefert das chronische Entzündungsgeschehen im Fettgewebe, das die lokalen Krankheitsvorgänge der Autoimmunerkrankungen mutmaßlich fördert. Sicherlich spielen daneben eine Vielzahl an möglichen Gründen eine Rolle, die zu der geringeren Wirksamkeit beitragen, auch pharmakokinetische Überlegungen. Dass aber das nach Körpergewicht dosierte Infliximab bei Übergewicht schlechter zu wirken scheint, spricht zum Beispiel aber gegen die Auswirkung eines höheren Verteilungsvolumens. Wohl aber könnte das erhöhte Entzündungsgeschehen die Clearance der Antikörper beeinflussen. Exprimiert der Organismus durch das Fettgewebe mehr TNF-alpha, wird z. B. Infliximab schneller gesättigt. Die entstehenden Antigen-Antikörper-Komplexe werden abgebaut und eine geringere freie Fraktion bleibt übrig [13]. Einen möglichen Ausweg aus der Misere weisen eventuell Antikörper, die nicht an TNF-alpha angreifen. Aus noch unbekannten Gründen nimmt zum Beispiel die Wirkung des Immunmodulators Abatacept (Orencia®) und des Interleukin-6-Rezeptor-Antagonisten Tocilizumab (RoActemra®) mit zunehmendem Gewicht nicht ab [13].
Adipositas-Paradoxon bei Krebserkrankungen
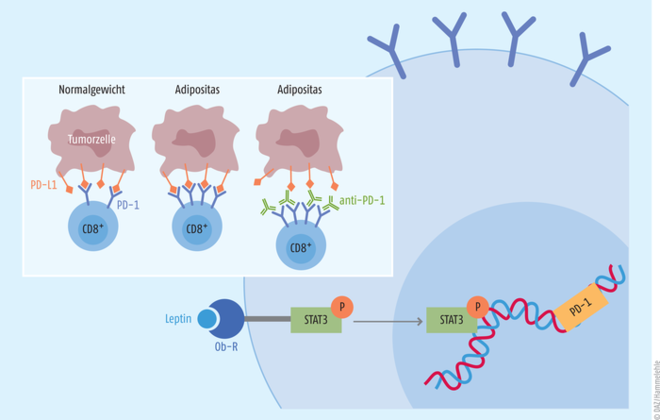
Dass es auch andersherum geht, also adipöse Menschen im Vorteil sein können, beweist das Beispiel der Checkpoint-Inhibitoren, die bei Tumoren angewendet werden. In erster Linie stellt Übergewicht für das Entstehen und Fortschreiten einer Krebserkrankung zunächst einen Risikofaktor dar. Möglicherweise spielen die chronische Inflammation oder auch durch Adipozyten sezernierte Hormone und Wachstumsfaktoren bei der Kanzerogenese eine Rolle. Man sollte also annehmen, dass Übergewicht die Krebssterblichkeit erhöht. Nicht immer wird diese Erwartung aber erfüllt. Das auf den Namen Adipositas-Paradoxon getaufte Phänomen besagt, dass Übergewicht nachgewiesenermaßen auch das Überleben bei bestimmten Krebsarten erhöht, z. B. bei Magenkrebs, Leukämie oder Lungenkrebs [14]. Ob Übergewicht einfach nur vor Tumorkachexie schützt oder ob adipöse Menschen harmlosere Karzinome entwickeln oder andere Gründe bestehen, darüber wird noch diskutiert. Checkpoint-Inhibitoren nun, darauf weisen mittlerweile mehrere Publikationen hin, scheinen bei fettleibigen Krebspatienten aber besser anzuschlagen. Beispielsweise zeigte eine vor Kurzem veröffentlichte Studie, dass das Gesamtüberleben von adipösen Krebspatienten, die mit Checkpoint-Inhibitoren behandelt wurden, 33% über dem von normalgewichtigen lag und über 18% über dem von übergewichtigen Patienten [15]. Vor allem bei den PD-1- und PD-L1-Inhibitoren (Inhibitoren des Programmed cell death protein 1 bzw. dessen Liganden) wie z. B. Nivolumab (Opdivo®) oder Atezolizumab (Tecentriq®) kristallisiert sich eine mögliche Theorie für diesen Befund heraus (s. Abb. 2). Normalerweise wird der auf T-Zellen befindliche PD-1-Rezeptor durch seine natürlichen Liganden PD-L1 und PD-L2, welche auch von Tumorzellen exprimiert werden, aktiviert. Die Immunaktivität der zytotoxischen T-Zelle wird gedämpft, ein wichtiger Vorgang im Rahmen der immunologischen Eigentoleranz des Organismus, der Autoimmunkrankheiten verhindert. Wird der PD-1-Rezeptor durch die Checkpoint-Inhibitoren aber gehemmt, erhöht das die Aktivität des Immunsystems und die Tumore können angegriffen werden. Die T-Zellen adipöser Menschen wiederum altern aufgrund der chronischen Inflammation schneller und exprimieren, wahrscheinlich hervorgerufen durch Leptin, mehr PD-1-Rezeptoren an ihrer Oberfläche und können durch die PD-1- bzw. PD-L1-Inhibitoren umso stärker aktiviert werden [16].
Abb. 2: Einfluss der Adipositas auf die Therapie mit PD-1/PD-L1-Checkpoint-Inhibitoren Leptin bindet an seinen Rezeptor (Ob-R) auf CD8+-zytotoxischen T-Zellen und induziert damit die Phosphorylierung des Transkriptionsfaktors STAT3. Dieser transloziert daraufhin in den Zellkern und sorgt dafür, dass der PD-1-Rezeptor (Programmed cell death protein 1) verstärkt an der Zelloberfläche exprimiert wird. links oben: Durch die größere Zahl an PD-1-Rezeptoren auf der Oberfläche binden die zytotoxischen T-Zellen von Adipösen stärker an die PD-L1-Liganden auf der Tumoroberfläche, was die gegen den Tumor gerichtete Immunantwort beeinträchtigt. Checkpoint-Inhibitoren (anti-PD-1-Antikörper) können diese verstärkte Interaktion aufheben, sodass die T-Zellen effektiver agieren können (nach [22]).
Erschwerte Atmung bei Adipositas
Komplex ist zudem die Beziehung zwischen dem Asthma bronchiale und der Adipositas. Wurde früher angenommen, dass eine geringere Fitness durch Asthma zu überflüssigen Pfunden führt, weiß man mittlerweile, dass der Pfeil auch in die entgegengesetzte Richtung zeigt: Übergewicht zählt zu den Risikofaktoren des Asthmas. Die Inzidenz der Atemwegserkrankung ist bei Adipösen doppelt so hoch [17]. Darüber hinaus leiden adipöse Asthmatiker unter stärkeren Symptomen, einem schlechter kontrollierten bzw. therapierefraktären Asthma und einer erhöhten Hospitalisierungsrate [18]. Ein Grund könnte möglicherweise sein, dass Dosieraerosole und Pulverinhalate aufgrund der mechanisch bedingten Veränderung der Luftwege schlechter am Wirkort ankommen. Die Interaktionen zwischen Asthma und Adipositas reichen allerdings wohl weiter. Denkbar ist, dass der Crosstalk zwischen den vom Fettgewebe ausgeschütteten Entzündungsmediatoren und den Bronchien bestehendes Asthma verkompliziert bzw. erst zur Auslösung bringt, indem die lokale Entzündung in den Bronchien beeinflusst wird [18]. Oftmals wird Asthma bei Adipösen aber auch einfach fehldiagnostiziert: Das Fett im Thorax, das auf die Atemwege drückt und die Atmung erschwert, führt oft zu Kurzatmigkeit und Atemnot, vor allem unter Belastung. Verschiedene Lungenparameter, z. B. der maximal exspiratorische Fluss oder der Atemwegswiderstand, können bei Adipösen derart verändert sein, dass manchmal vorschnell die Diagnose Asthma gestellt wird [19]. Die Allergiediagnostik oder Nachweise einer asthmatypischen Typ-2-Inflammation (erhöhtes Stickstoffmonoxid im Exhalat) oder einer Eosinophilie fallen bei diesen Patienten aber negativ aus [19]. Inhalative Glucocorticoide können in diesen Fällen deshalb nichts ausrichten und werden bei Nichtansprechen unnötig eskaliert. Die einzig wirklich wirksame Maßnahme in diesen Fällen stellt die Gewichtsreduktion dar. In besonders schweren Fällen, so konnte gezeigt werden, reduzierte eine bariatrische Operation (gewichtsreduzierende Chirurgie des Magen-Darm-Traktes) das Gewicht signifikant und verbesserte im Gegenzug die Kontrolle der Asthmaerkrankung, verschiedene Lungenfunktionsparameter, z. B. die Einsekundenkapazität (schnellstmöglich ausgeatmetes maximales Volumen innerhalb der ersten Sekunde), und die totale Lungenkapazität [20]. |
Disclaimer
Der Autor versichert, dass keine Interessenkonflikte bestehen.
Literatur
[1] Mensink GBM et al. Übergewicht und Adipositas in Deutschland – Ergebnisse der Studie zur Gesundheit Erwachsener in Deutschland (DEGS1). Bundesgesundheitsbl 2013;56:786-794
[2] Obesity. Informationen der Weltgesundheitsorganisation (WHO), www.who.int/health-topics/obesity#tab=tab_1
[3] Scheja L, Heeren J. The endocrine function of adipose tissues in health and cardiometabolic disease. Nat Rev Endocrinol 2019;15:507-524
[4] Russo L und Lumeng CN. Properties and functions of adipose tissue macrophages in obesity. Immunology 2018;155:407-417
[5] Frasca D, Blomberg BB. The Impact of Obesity and Metabolic Syndrome on Vaccination Success. Interdiscip Top Gerontol Geriatr 2020;43:86-97
[6] Young KM et al. Is Obesity a Risk Factor for Vaccine Non-Responsiveness? PLoS One 2013;8:e82779
[7] Butsch WS et al. COVID-19 vaccines are effective in people with obesity: A position statement from The Obesity Society. Obesity 2021;29:1575-1579
[8] Watanabe M et al. Central obesity, smoking habit, and hypertension are associated with lower antibody titers in response to COVID-19 mRNA vaccine. Diabetes Metab Res Rev 2022;38:e3465
[9] Malavazos AE et al. Antibody responses to BNT162b2 mRNA vaccine: Infection-naïve individuals with abdominal obesity warrant attention. Obesity 2022;30:606-613
[10] Lupoli R et al. Impact of body weight on the achievement of minimal disease activity in patients with rheumatic diseases: a systematic review and meta-analysis. Arthritis Res Ther 2016;18:297
[11] Enos CW et al. Comorbid obesity and history of diabetes are independently associated with poorer treatment response to biologics at 6 months: A prospective analysis in Corrona Psoriasis Registry. J Am Acad Dermatol 2022;86:68-76
[12] Guerbau L et al. Patients with Crohn‘s Disease with High Body Mass Index Present More Frequent and Rapid Loss of Response to Infliximab. Inflamm Bowel Dis 2017;23:1853-1859
[13] Moroni L et al. Obesity and its role in the management of rheumatoid and psoriatic arthritis. Clin Rheumatol 2020;39:1039-1047
[14] Cespeses Feliciano EM et al. The Obesity Paradox in Cancer: How Important Is Muscle? Annu Rev Nutr 2018;38:357-379
[15] Yoo SK et al. Outcomes Among Patients With or Without Obesity and With Cancer Following Treatment With Immune Checkpoint Blockade. JAMA Netw Open 2022;5:e220448
[16] Wang Z et al. Paradoxical effects of obesity on T cell function during tumor progression and PD-1 checkpoint blockade. Nat Med 2019;25:141-151
[17] Beuther DA und Sutherland ER. Overweight, Obesity, and Incident Asthma - A Meta-analysis of Prospective Epidemiologic Studies. Am J Respir Crit Care Med 2007;175:661-666
[18] Umetsu DT. Mechanisms by which obesity impacts upon asthma. Thorax 2017;72:174-177
[19] Haasler I, Traube C. Asthma und Adipositas. Pneumologe 2017;14:287-290
[20] Van Huisstede A et al. Effect of bariatric surgery on asthma control, lung function and bronchial and systemic inflammation in morbidly obese subjects with asthma. Thorax 2015;70:659-667
[21] Vieira-Potter VJ. Inflammation and macrophage modulation in adipose tissues. Cell Microbiol 2014;16:1484-1492
[22] Woodall MJ et al. The Effects of Obesity on Anti-Cancer Immunity and Cancer Immunotherapy. Cancers (Basel) 2020;12:1230






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.