
- DAZ.online
- DAZ / AZ
- DAZ 2/2023
- Längere Ü
DAZ aktuell
Längere Übergangsfristen
Neuregeln für Medizinprodukte
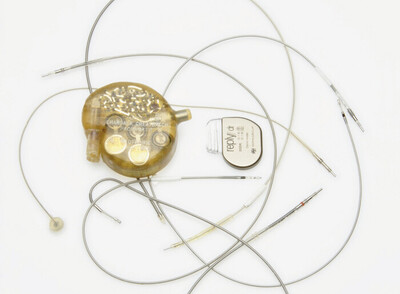
Die 2017 in Kraft getretene europäische Verordnung über Medizinprodukte – kurz „Medical Device Regulation“ (MDR) – wurde zum 26. Mai 2021 wirksam. Doch von Anfang an bereiteten die neuen europäischen Vorgaben Sorgen. Vor allem befürchteten Hersteller, die neu vorzunehmenden Zertifizierungen nicht rechtzeitig umsetzen zu können, weil es nicht ausreichend Benannte Stellen dafür gibt.
Nun hat die Europäische Kommission vorgeschlagen, mehr Zeit für diese Zertifizierung einzuräumen und so das Risiko von Engpässen zu mindern. Die kürzlich beschlossene Vorlage sieht längere Übergangsfristen für die Umstellung auf die neuen Vorschriften der MDR vor. Bislang war der Stichtag der 26. Mai 2024. Doch für Produkte mit höherem Risiko (wie Herzschrittmacher und Hüftimplantate) soll nun bis Ende 2027 Zeit sein und für Produkte mit mittlerem und geringerem Risiko (wie Spritzen oder wiederverwendbare chirurgische Instrumente) bis Ende 2028. Zum Vorschlag der Kommission gehört überdies, dass die Abverkaufsfrist, also das Datum, nach dem in Verkehr gebrachte Produkte vom Markt genommen werden müssen, gestrichen werden soll. |





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.