
- DAZ.online
- News
- Pharmazie
- Calcipotriol wird in UK ...
Switch
Calcipotriol wird in UK rezeptfrei
Remagen - 22.08.2017, 10:00 Uhr
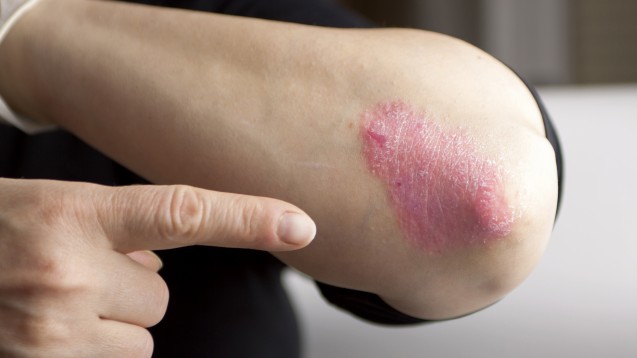
Psoriasis-Patienten in Großbritannien können in Zukunft Clacipotriol ohne Rezept in der Apotheke kaufen. (Foto: hriana / Fotolia)
Die britische Arzneimittelbehörde Medicines and Healthcare products Regulatory Agency (MHRA) hat der Entlassung von Calcipotriol (Dovonex® Psoriasis Ointment) aus der Verschreibungspflicht zugestimmt. Das Mittel gegen Schuppenflechte darf aber auch in Zukunft nur in Apotheken abgegeben werden.
Die äußerliche Behandlung mit dem Vitamin-D-Analogon Calcipotriol in einer Dosierung von 50 µg/g soll in Großbritannien in Zukunft auch ohne Rezept möglich sein. Konkret bezieht sich der jetzt von der britischen Arzneimittelbehörde genehmigte Switch auf das Arzneimittel „Dovonex® Psoriasis 50 microgram/g Ointment“ der Firma Leo Laboratories Limited. Die Entlassung aus der Verschreibungspflicht ist beschränkt auf Patienten mit leichter oder mittelschwerer Psoriasis, die älter als 18 Jahre sind. Die Anwendung darf nicht öfter als einmal täglich erfolgen und die maximale Menge pro Woche 60 g Salbe (Packungsgröße der Tube) nicht überschreiten. Die Anwendungsdauer im Rahmen der Selbstmedikation wird auf zwölf Wochen begrenzt. Danach sollen die Patienten ihren Arzt konsultieren, ob die Behandlung fortgesetzt werden soll.
Zwei Versionen nebeneinander, nur mit einem Namenszusatz
Außerdem soll das Mittel ohne Rezept nur nach Beratung in der Apotheke und nach vorheriger Diagnose der Erkrankung durch einen Arzt abgegeben werden dürfen. Die Apotheken werden mit entsprechenden Schulungsmaterialien versorgt, damit sie das Präparat bestimmungsgemäß ohne Rezept abgeben können. Die Apotheker seien Arzneimittelexperten und dazu in der Lage, sicherzustellen, dass die richtigen Patienten das Präparat bekämen, stellt die MHRA in einer Mitteilung zu dem Switch fest.
Wie dem dazugehörigen Public Assessment Report zu entnehmen ist, wurde Dovonex® Ointment in Großbritannien im Jahr 1991 erstmalig zugelassen. Der Zulassungsinhaber möchte diese rezeptpflichtige Zulassung, die zur Anwendung bei Patienten mit schweren Ausprägungen der Krankheit vorgesehen ist, auch weiterhin beibehalten. Das rezeptpflichtige Pendant darf im Gegensatz zu der neuen rezeptfreien Variante ein- oder zweimal pro Tag angewendet werden. Die Apotheker müssen sich im Rahmen ihrer Beratung kundig machen, ob ein Patient vorher die rezeptpflichtige Version eingesetzt hat und wie oft am Tag. Wenn ein Betroffener nachgewiesenermaßen eine zweimalige Auftragung pro Tag braucht, soll er zunächst wieder zurück an den Arzt verwiesen werden. Der Zusatz „Psoriasis“ wird als Unterscheidungsmerkmal zur der rezeptpflichtigen Version als ausreichend angesehen.
Mehr zum Thema
Das Beste aus 2017
Diese „mabs“ sollten Apotheker kennen
Kein Switch in Deutschland
Die stellvertretende Direktorin der Abteilung für Vigilance and Risk Management of Medicines bei der MHRA Sarah Branch sagt: „Psoriasis ist eine chronische Erkrankung, die die Lebensqualität der Betroffenen erheblich beeinträchtigen kann. Wenn das Arzneimittel besser verfügbar ist, können die Patienten ein Aufflackern der Symptome rasch behandeln, ohne dafür eine Verordnung zu brauchen.“
„Den Zugang zu Arzneimitteln zu erweitern, ist eine gute Nachricht für die Patienten“, kommentiert der Präsident der Royal Pharmaceutical Society Ash Soni den Switch. „Apotheker sind Arzneimittelexperten und gut ausgebildet, um die sichere Versorgung der Öffentlichkeit zu gewährleisten. Wir freuen uns, dass die Palette der Produkte, die wir bereits für die Behandlung der Psoriasis verkaufen dürfen, um die Dovonex Psoriasis Salbe erweitert wird.“
In Irland seit letztem Jahr OTC
Nach den Angaben in der Datenbank des europäischen Dachverbandes der Selbstmedikationsindustrie AESGP ist Calcipotriol bis dato lediglich in Irland rezeptfrei in Apotheken erhältlich. Die Zulassung für Dovonex® Psoriasis 50 Microgram/g Ointment wurde dort erst im letzten Jahr erteilt.
In Deutschland hatte der Ausschuss für Verschreibungspflicht sich im Jahr 2008 mit einem Switch-Antrag von Novartis Consumer Health für Calcipotriol befasst. Er bezog sich auf die äußerliche Anwendung in Konzentrationen bis 0,005 Prozent zur Behandlung von leichter bis mittelschwerer Psoriasis vulgaris mit einer Erkrankung von maximal 10 Prozent der Körperoberfläche und in Packungsgrößen bis zu 3 mg Calcipotriol. In der Diskussion hatten Sachverständige die Auffassung vertreten, dass Patienten für die Erstdiagnose einer Psoriasis in jedem Fall den Arzt aufsuchen würden, im Verlauf ihrer chronischen Psoriasis aber sehr gut über ihre Erkrankung und die Behandlungsmöglichkeiten informiert seien. Zudem erkrankten die meisten Patienten an einer weniger schweren Form mit entsprechend geringem Befall von Hautarealen, der unterhalb der 10-prozentigen Grenze bleibe. Wie dem Ergebnisprotokoll der 61. Sitzung des Ausschusses zu entnehmen ist, wurde der Antrag seinerzeit mehrheitlich angenommen. In der Folge hat das Bundesministerium für Gesundheit den Beschluss jedoch nicht weiterverfolgt, so dass Calcipotriol im Ergebnis weiter unter der Rezeptpflicht verblieb.
In Deutschland wird Calcipotriol unter den Handelsnamen Daivonex® und Psorcutan®, sowie in generischer Variante von Hexal und 1a Pharma vertrieben.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.