
- DAZ.online
- News
- Pharmazie
- FDA lässt erstes ...
Lofexidin bei Betäubungsmittelentzug
FDA lässt erstes Nichtopioid zum Entzug zu
Stuttgart - 23.05.2018, 16:00 Uhr

Mildert die körperlichen Symptome bei Opiodentzug: Lofexidin in Lucemyra. (Foto: Imago)
Die FDA hat Lucemyra® zugelassen. Das Arzneimittel mit dem Wirkstoff Lofexidin soll akute Entzugssymptome bei Betäubungsmittelabhängigen abmildern. Wichtig: Lucemyra® ist kein Substitutionsarzneimittel. Lofexidin erleichtert als α2-Adrenozeptor-Agonist und Antisympathotonikum den Abhängigen bei abruptem Absetzen des Suchtmittels den körperlichen Entzug.
Ein Betäubungsmittelentzug ist kein Zuckerschlecken, eine Opiatabhängigkeit besteht auf zwei Ebenen: Die Patienten leiden unter einer physischen und einer psychischen Sucht. Der Kampf gegen das psychische Verlangen – craving – ist ein langwieriger Prozess, der weitaus schwieriger zu schlagen ist, als der akut körperliche Entzug von der Substanz. Doch auch der körperliche Entgiftungsprozess stellt eine Strapaze für die Opiatsüchtigen dar: Sie leiden unter grippeähnlichen Symptomen – Fieber, Schüttelfrost, Muskelschmerzen – sind ängstlich und unruhig. Herzfrequenz und Blutdruck steigen, schließlich könnte Durchfall, Erbrechen und exzessives Schwitzen zu massiven Elektrolytentgleisungen führen und in lebensbedrohlichen Schockzuständen eskalieren. Die ersten drei Tage eines Entzugs sind die heftigsten. Entzugssymptome können jedoch über zwei Wochen andauern.
Die primäre Entgiftung führen die Abhängigen in Eigenregie durch oder mit ärztlicher Unterstützung im ambulanten oder stationären Bereich. Bestimmte Arzneimittel können Entzugssymptome abmildern: „Opiatabhängigkeit ist eine behandlungsbedürftige chronische Krankheit“, schreibt die Bundesärztekammer in ihren Richtlinien. Zwar beziehen sich die Mediziner hier vor allem auf die Substitutionspraxis und psychosoziale Betreuung Opiatabhängiger, doch auch die körperliche Entwöhnung von der Suchtsubstanz ist ein, zwar kürzerer, aber schwerer Weg. Für diese Zeit der Entgiftung hat die amerikanische Arzneimittelbehörde FDA nun ein Arzneimittel zugelassen.
Wie wirkt Lofexidin beim Opiatentzug?
Lofexidin in Lucemyra® ist das erste Nichtopiod, das in den Vereinigten Staaten Eingang in die medikamentöse Therapie des Opiatentzugs findet. Bislang setzen die US-amerikanischen Ärzte bei der Betäubungsmittelentwöhnung vornehmlich auf Opioide wie Methadon oder Buprenorphin. Wie wirkt nun Lofexidin?
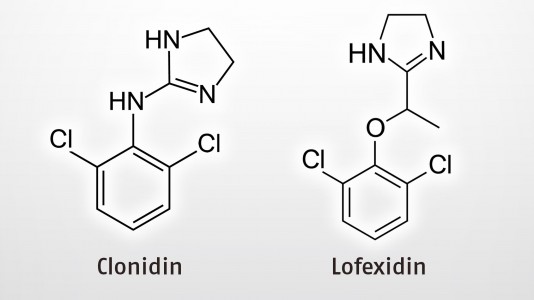
Der Wirkstoff ist ein selektiver α2-Adrenozeptor-Agonist. Lofexidin hemmt, wie Clonidin, als Antisympathotonikum die Sympathikusaktivität durch Angriff an zentralen, präsynaptischen α2-Rezeptoren. Präsynaptische α2-Rezetoren wirken bei Aktivierung autoinhibitorisch – das heißt: Agonisten an α2, wie Lofexidin, hemmen die Ausschüttung von Noradrenalin in den synaptischen Spalt und reduzieren auf diese Weise die Sympathikusaktivität.
Was hat ein α2-Agonist wie Lofexidin mit Opioiden zu tun?
Opiode wirken hemmend auf die Freisetzung von Noradrenalin – dauerhafter Opiatabusus führt dazu, dass kompensatorisch die Noradrenalinsynthese erhöht wird, um eine adäquate noradrenerge Funktion aufrecht zu erhalten. Durch abruptes Absetzen des Betäubungsmittels – sei es durch einen freiwilligen oder unfreiwilligen Entzug – fehlt plötzlich die hemmende Wirkung der Opiate auf die Freisetzung des Catecholamins. Was folgt? Die erhöhten Noradrenalin-Spiegel im Gehirn werden instant nicht mehr durch die Anwesenheit von Opioden ausgeglichen, der Abhängige entwickelt klassische und schmerzhafte Entzugssymptome. Lofexidin reduziert durch oben genannten Mechanismus die überschiessende Sympathikusaktivität.
Nebenwirkungen von Lofexidin beim Opiodentzug
Laut FDA sind die am häufigsten beobachteten Nebenwirkungen eines unterstützenden Entzugs mit Lucemyra® Hypotension, Bradykardie, Sedierung und Schwindel. Da Lucemyra® auf die Herzfrequenz wirkt, sind Herzrhythmusstörungen nicht ausgeschlossen. Nach Absetzen von Lucemyra® warnt die FDA vor starken Blutdruckanstiegen. Lofexidin wurde nicht an unter 17-Jährigen untersucht.
FDA lässt Wirksamkeit auch bei Schmerztherapie prüfen
Übernehmen die Vereinigten Staaten bei Erstzulassungen von Arzneimitteln meist eine Vorreiterrolle, verhält sich dies bei Lofexidin anders. Als BritLofex® ist Lofexidin bereits seit den 90er-Jahren in Großbritannien zur Opiatentwöhnung zugelassen. Auch eine der beiden für die FDA-Zulassung relevanten Phase-III-Studien schloss US WorldMeds, der pharmazeutische Unternehmer hinter Lucemyra®, schon 2008 ab. Dafür ging es seit 2017 umso fixer: Die FDA gewährte Lofexidin Priority Review und Fast-Track-Verfahren, um einen schnellstmöglichen Marktzugang von Lucemyra® zu ermöglichen. Jedoch fordert die Arzneimittelbehörde 15 Post-Marketing-Studien, um unter anderem Langzeitdaten zur klinischen Sicherheit, die Wirksamkeit von Lucemyra® bei infantilem Opiatentzugssyndrom Neugeborener von betäubungsmittelabhängigen Müttern und die Langzeittoxizität auf die Leber zu prüfen. Darüber hinaus soll auch untersucht werden, ob Lofexidin für Patienten, die im Rahmen einer indizierten Schmerztherapie beim Absetzen der Opiode Entzugserscheinungen entwickeln, ebenfalls hilfreich sein kann.


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.