
- DAZ.online
- News
- Wirtschaft
- BAH-Forderung: BfArM soll...
Verkaufsabgrenzung
BAH-Forderung: BfArM soll allein über OTC-Switches entscheiden
Berlin - 21.05.2019, 17:00 Uhr

Aus Sicht des BAH soll das Verfahren für OTC-Switches eine reine Zulassungsangelegenheit werden. Basierend auf einem Rechtsgutachten der Kanzlei Sträter schlägt der Lobbyverband vor, dass künftig das BfArM über die Verkaufsabgrenzung von Arzneimitteln entscheiden soll. (c / Foto: DAZ/eda)
Pharmaunternehmen finden das Verfahren für OTC-Switches zu intransparent und unberechenbar. Der Bundesverband für Arzneimittelhersteller (BAH) will das ändern und hatte die Kanzlei Sträter Rechtsanwälte mit der Entwicklung einer Alternativlösung beauftragt. Dem Gutachten zufolge, das der BAH am heutigen Dienstag vorstellte, soll künftig nur noch das BfArM produktbezogen über Herstelleranträge zur Entlassung aus der Verschreibungspflicht entscheiden. In das derzeitige Rechtssetzungsverfahren sind neben dem BfArM das BMG, das Bundeslandwirtschaftsministerium, das Bundeswirtschaftsministerium und der Bundesrat involviert.
Das Verfahren, wie OTC-Switches in Deutschland ablaufen, stammt aus dem Jahr 1978. Seitdem hat sich die regulatorische Landschaft grundlegend verändert. Pharmaunternehmen beklagen mangelnde Transparenz und wirtschaftliche Anreize beim derzeitigen Prozess.
Zeit für eine Neuerung, findet der Bundesverband der Arzneimittelhersteller (BAH). Um eine alternative Lösung zu entwickeln, hatte der Pharmaverband die Kanzlei Sträter Rechtsanwälte mit einem Rechtsgutachten beauftragt. Diesem Gutachten zufolge, das der BAH vor wenigen Wochen beim BMG eingereicht hatte, sollen OTC-Switches ähnlich wie bei einer Änderungsanzeige beim BfArM ablaufen.
Worin die wesentlichen Unterschiede zum derzeitigen Rechtssetzungsverfahren liegen und welche Verbesserungen sich aus Sicht der Hersteller ergeben, stellte der BAH am heutigen Dienstag in Berlin vor. Bei der Veranstaltung referierten unter anderem der BAH-Geschäftsführer im Bereich Wissenschaft Dr. Elmar Kroth, BfArM-Präsident Professor Karl Broich, Michaela Oppold (Leiterin der Zulassungsabteilung bei GSK) und Rechtsanwalt Markus Ambrosius (Sträter Rechtsanwälte).
BAH: „Zu viele Akteure im derzeitigen Switch-Verfahren“
Der Wunsch des Lobbyverbandes ist es, das Switch-Verfahren für Pharmafirmen attraktiver zu gestalten, zu vereinfachen und zu entbürokratisieren. „Zurzeit sind zu viele Akteure an der Entscheidung zur Entlassung von Wirkstoffen aus der Verschreibungs- in die Apothekenpflicht beteiligt“, so Kroth.
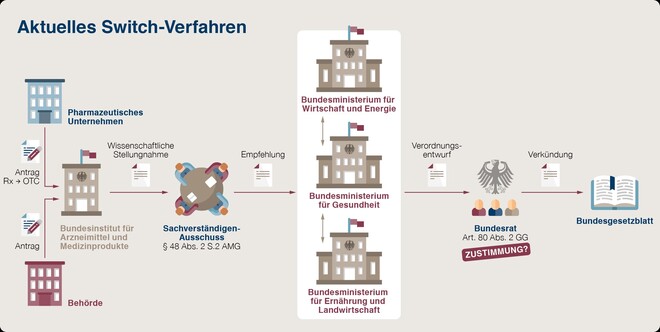
Das derzeitige Verfahren startet in der Regel mit einem Antrag des Herstellers an das BfArM, das eine Stellungnahme abgibt und dann das Thema auf die Agenda des Sachverständigen-Ausschusses für Verschreibungspflicht abgibt. Dieses Expertengremium, das nur zweimal im Jahr tagt, arbeitet eine Empfehlung aus, die ans BMG weitergeleitet wird. Das BMG erstellt im Einvernehmen mit dem Bundeswirtschaftsministerium und bei Tierarzneimitteln in Abstimmung mit dem Landwirtschaftsministerium einen Verordnungsentwurf, der dem Bundesrat zur Abstimmung vorgelegt wird. Erst nach Zustimmung der Bundesländer und nach Veröffentlichung im Bundesgesetzblatt tritt die Änderung der Arzneimittelverschreibungsverordnung (AMVV) in Kraft. Sofern nicht einer der beteiligten Instanzen zuvor die Änderung abgelehnt hat, wovon das initiierende Pharmaunternehmen jedoch nicht benachrichtigt wird.
GSK-Managerin: „Wir sind eher Bittsteller als Antragsteller“
Oppold beklagte, dass der aktuelle Prozess intransparent sei und keine Möglichkeit für Nachbesserungen im laufenden Verfahren biete. „Wir sind eher Bittsteller als Antragssteller“, so die Pharmaexpertin. Außerdem fehlten wirtschaftliche Anreize, weil das Verfahren wirkstoffbasiert erfolge. Denn von dem Aufwand eines Herstellers, die Antragsunterlagen aufzubereiten oder gar Studiendaten zu erstellen, profitieren Wettbewerber mit wirkstoffgleichen Präparaten automatisch mit.
Sträter: „Verkaufsabgrenzung ist keine politische Frage“
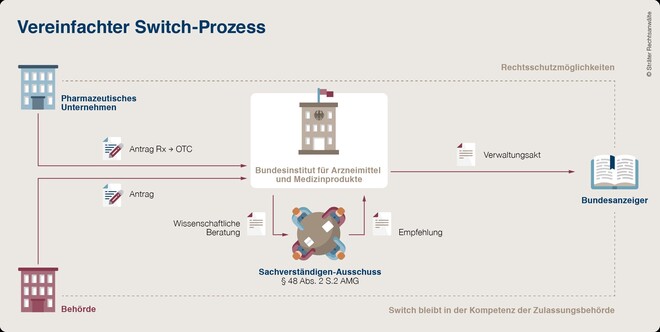
BAH und die Sträter-Kanzlei schlagen ein vereinfachtes, produktbezogenes Verfahren ohne Beteiligung von Ministerien und Bundesrat vor. Die Entscheidungskompetenz soll alleinig beim BfArM liegen. „Die Entscheidung über die Verkaufsabgrenzung ist eine wissenschaftliche und keine politische Frage“, findet Rechtsanwalt Ambrosius. In seinem Entwurf orientierte sich die Kanzlei am zentralen europäischen Verfahren, bei dem über die Verschreibungspflicht die EMA ohne Beteiligung von politischen Gremien entscheidet. Übertragen auf das nationale System sollen die Hersteller ihre Anträge, ähnlich wie bei einer zustimmungspflichtigen Änderungsanzeige, beim BfArM einreichen. Der Sachverständigen-Ausschuss soll die Bundesoberbehörde nach wie vor beraten.
Die Entscheidung des BfArM, die sich auf das Produkt des Herstellers und nicht auf einen Wirkstoff beziehen sollte, soll in einem Verwaltungsakt im Bundesanzeiger veröffentlicht werden. Der Stellenwert der AMVV wäre in dem Zusammenhang hinfällig. Möchten Mitbewerber mit wirkstoffgleichen Arzneimitteln ebenfalls einen OTC-Switch, müssten sie separate Anträge stellen. Hat der initiale Antragsteller relevante Studiendaten erstellt, soll deren Nutzung für den Wettbewerb drei Jahre gesperrt sein. Antragsteller sollen im laufenden Verfahren auf mögliche Mängel in ihren Unterlagen hingewiesen werden, um darauf reagieren zu können.
BfArM offen für Neuerungen
BfArM-Präsident Broich kann den Kritikpunkt der Hersteller, dass beim jetzigen Verfahren zu wenig Transparenz herrsche, nachvollziehen. „Wir sind bereit, mit Ihnen mehr Austausch zu pflegen.“ Der Behördenchef verwies auch auf die Möglichkeit für Hersteller, das Switch-Vorhaben vor Einreichung in einem sogenannten Scientific Advice mit dem BfArM zu besprechen, was im vergangenen Jahr allerdings nur in zehn Fällen genutzt wurde.
Grundsätzlich sei die Behörde für eine Vereinfachung des Verfahrens offen. So sei auch eine Verkürzung der Sitzungsperioden des Sachverständigen-Ausschusses denkbar. Auch sperre sich das BfArM nicht gegen vermehrte OTC-Switches, sofern die Patientensicherheit gewahrt sei. „Wir schätzen dabei die hohe Kompetenz der Apothekerschaft in der Beratung“, betonte Broich. Allerdings ist es aus Sicht der Behörde wünschenswert, wenn die Switches nach wie vor wirkstoffbezogen erfolgen würden.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.