
- DAZ.online
- News
- Spektrum
- Erster Corona Antigen-...
Bald Entlastung im angespannten Testgeschehen?
Erster Corona Antigen-Schnelltest geht in klinische Studie
Remagen - 26.08.2020, 17:50 Uhr
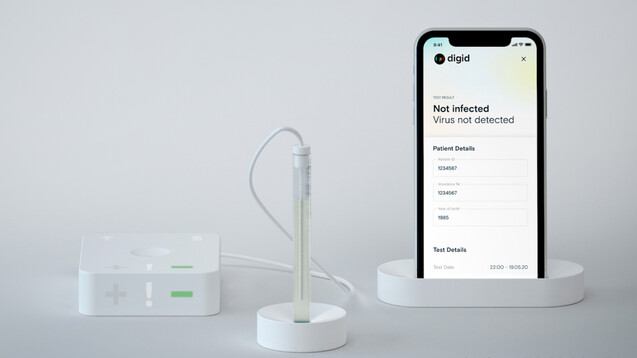
Der Digid Cantisense™ SARS-CoV-2 Test wird jetzt klinisch erprobt. (Foto: Dgital Diagnostics AG)
Das Gesundheitstechnologie-Unternehmen Digital Diagnostics AG darf seinen Digid Cantisense™ SARS-CoV-2 Test klinisch erproben. Sowohl das BfArM als auch die zuständige Ethikkommission haben die Genehmigung dafür erteilt. Der Antigen-Test soll besonders gut für Zugangskontrollen und Schnelltestungen zum Beispiel an Flughäfen, in Kliniken oder auch bei Großveranstaltungen geeignet sein.
Anfang Juni 2020 hatte das Start-up Digital Diagnostics AG aus Mainz beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) die Zulassung für seinen Digid Cantisense™ SARS-CoV-2 Test für Deutschland beantragt. Davor musste es allerdings noch seine Leistungsfähigkeit unter Beweis stellen, eine entscheidende Hürde im Zulassungsverfahren in Deutschland. Das BfArM hat nun die Durchführung klinischer Prüfungen nach § 20 Abs. 1 des Medizinproduktegesetzes (MPG) gestattet. Auch ein positives Votum der Ethikkommission der Landesärztekammer Rheinland-Pfalz liegt vor.
Studie untersucht Vergleichbarkeit mit herkömmlichen PCR-Tests
Mit der Durchführung der Studie wurde nach Medienberichten das Pfützner Science & Health Institute in Mainz beauftragt. Die geplanten Testreihen sollen zeigen, dass der Test genauso zuverlässig ist wie herkömmliche PCR-Tests. In der Studie werden die Probanden parallel mit einer Standard-PCR Methode und mit dem auf dem Antigennachweis beruhenden Digid Cantisense™ SARS-CoV-2 Test getestet. Dazu nimmt medizinisches Personal einen Rachenabstrich vor. Die Probe wird direkt vor Ort innerhalb weniger Minuten mit dem Digid-Soforttest analysiert. Danach wird das Ergebnis mit dem Resultat eines PCR-Tests aus einem Referenzlabor verglichen. Das Design der Studie soll den Vorgaben der FDA und der EU-Kommission für In-vitro-Messverfahren zum Nachweis von SARS-CoV-2 entsprechen. Die Messungen sollen sowohl lokal, wie auch in Corona-Hotspots innerhalb Deutschlands durchgeführt werden.
Mehr zum Thema

Statt Hightech-Verfahren
Virologe Kekulé setzt auf Corona-Schnelltests in Apotheken
Im Gegensatz zu den PCR-Verfahren soll der neue Antigen-Test, der nach Unternehmensangaben in eine Westentasche passt, schon nach fünf Minuten eine eindeutige elektronische „Ja“- oder „Nein“-Information liefern. Wie er genau funktioniert, können Sie hier nachlesen.
Viele mögliche Einsatzgebiete
Der Test macht nicht nur den aufwendigen Weg über ein Labor überflüssig. Er spart auch wertvolle Zeit bei der Diagnose. Vordringliche Einsatzgebiete könnten Zugangskontrollen zum Beispiel an Flughäfen, in Kliniken oder auch bei Großveranstaltungen sein. Das erhobene Messergebnis wird drahtlos zu einem mobilen Endgerät übertragen. Durch die Anbindung an die Digid-Analyseplattform könnten die Daten sicher und anonym weiterverarbeitet werden. Das verhindert Übermittlungsfehler und Pannen.
Wichtig auch zur Verfolgung der Epidemie
Auch epidemiologische Fragen könnten damit schneller beantwortet werden. „Durch die Anbindung des digitalen Sensors an eine sichere Datenbank können Sensordaten zudem mit Geodaten verknüpft und für Großdatenanwendungen anonymisiert verarbeitet werden“, erklärt Konstantin Kloppstech, Chief Technology Officer bei Digital Diagnostics AG. „Dies wiederum würde auch dabei helfen, regionale Hotspots präzise zu ermitteln, um neu auftretende Infektionsketten zu unterbinden und die Einschränkung der Bewegungsfreiheit flexibler zu begrenzen.“
Wann könnte der Test auf den Markt kommen?
Die klinischen Tests des digitalen Biosensors und des Messgerätes sollen voraussichtlich Anfang Oktober 2020 abgeschlossen sein. Bei positiven Resultaten könnte der Soforttest schon kurze Zeit später zugelassen werden. Erst dann kann die Digital Diagnostics AG die Tests in Millionen-Stückzahl auf den Markt bringen. Laut Unternehmensangaben werden die notwendigen Produktionskapazitäten bereits aufgebaut, damit sie rechtzeitig zur Zulassung einsatzbereit sind.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.