
- DAZ.online
- News
- Spektrum
- Erster Corona Antigen-...
Bald Entlastung im angespannten Testgeschehen?
Erster Corona Antigen-Schnelltest geht in klinische Studie
Remagen - 26.08.2020, 17:50 Uhr
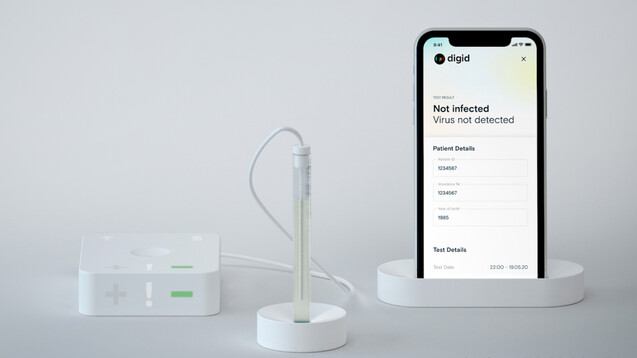
Der Digid Cantisense™ SARS-CoV-2 Test wird jetzt klinisch erprobt. (Foto: Dgital Diagnostics AG)
Das Gesundheitstechnologie-Unternehmen Digital Diagnostics AG darf seinen Digid Cantisense™ SARS-CoV-2 Test klinisch erproben. Sowohl das BfArM als auch die zuständige Ethikkommission haben die Genehmigung dafür erteilt. Der Antigen-Test soll besonders gut für Zugangskontrollen und Schnelltestungen zum Beispiel an Flughäfen, in Kliniken oder auch bei Großveranstaltungen geeignet sein.
Anfang Juni 2020 hatte das Start-up Digital Diagnostics AG aus Mainz beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) die Zulassung für seinen Digid Cantisense™ SARS-CoV-2 Test für Deutschland beantragt. Davor musste es allerdings noch seine Leistungsfähigkeit unter Beweis stellen, eine entscheidende Hürde im Zulassungsverfahren in Deutschland. Das BfArM hat nun die Durchführung klinischer Prüfungen nach § 20 Abs. 1 des Medizinproduktegesetzes (MPG) gestattet. Auch ein positives Votum der Ethikkommission der Landesärztekammer Rheinland-Pfalz liegt vor.
Studie untersucht Vergleichbarkeit mit herkömmlichen PCR-Tests
Mit der Durchführung der Studie wurde nach Medienberichten das Pfützner Science & Health Institute in Mainz beauftragt. Die geplanten Testreihen sollen zeigen, dass der Test genauso zuverlässig ist wie herkömmliche PCR-Tests. In der Studie werden die Probanden parallel mit einer Standard-PCR Methode und mit dem auf dem Antigennachweis beruhenden Digid Cantisense™ SARS-CoV-2 Test getestet. Dazu nimmt medizinisches Personal einen Rachenabstrich vor. Die Probe wird direkt vor Ort innerhalb weniger Minuten mit dem Digid-Soforttest analysiert. Danach wird das Ergebnis mit dem Resultat eines PCR-Tests aus einem Referenzlabor verglichen. Das Design der Studie soll den Vorgaben der FDA und der EU-Kommission für In-vitro-Messverfahren zum Nachweis von SARS-CoV-2 entsprechen. Die Messungen sollen sowohl lokal, wie auch in Corona-Hotspots innerhalb Deutschlands durchgeführt werden.
Mehr zum Thema

Statt Hightech-Verfahren
Virologe Kekulé setzt auf Corona-Schnelltests in Apotheken
Im Gegensatz zu den PCR-Verfahren soll der neue Antigen-Test, der nach Unternehmensangaben in eine Westentasche passt, schon nach fünf Minuten eine eindeutige elektronische „Ja“- oder „Nein“-Information liefern. Wie er genau funktioniert, können Sie hier nachlesen.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.