
- DAZ.online
- News
- Pharmazie
- Comirnaty-Booster nicht f...
FDA genehmigt Auffrischimpfung
Comirnaty-Booster nicht für jeden
Stuttgart - 23.09.2021, 09:15 Uhr
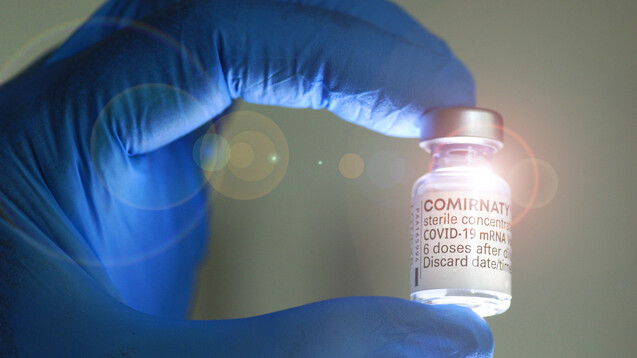
Die FDA genehmigte eine Pfizer/Biontech-Auffrischimpfung für ab 65-Jährige, ab 18-Jährige mit hohem Risiko für eine schwere COVID-19-Erkrankung und mit beruflicher Exposition gegenüber SARS-CoV-2. (Foto: IMAGO / CHROMORANGE)
Nicht jeder benötigt eine Auffrischimpfung mit dem Pfizer/Biontech-Impfstoff Comirnaty, findet die FDA. Sie ließ eine einzige Boosterdosis Comirnaty im Rahmen einer Notfallzulassung nur für bestimmte Personen, unter anderem ältere Menschen ab 65 Jahren, zu. Auch scheint eine Nebenwirkung nach Boosterdosis häufiger aufzutreten als nach der zweiten Impfung.
Der Beratungsausschuss für Impfstoffe und verwandte biologische Produkte (Vaccines and Related Biological Products Advisory Committee, VRBPAC) der FDA hatte es am 17. September bereits empfohlen, nun ist die US-amerikanische Arzneimittelbehörde diesem Rat am 22. September gefolgt: Die FDA lässt eine Auffrischungsdosis vom Pfizer/Biontech-Impfstoff Cominaty® zu – allerdings nur für bestimmte Personen.
Mehr zum Thema
Für Schwangere nur Comirnaty
COVID-19-Impfstoff von Moderna – wann welche Dosis und für wen?
Der geänderten Notfallzulassung entsprechend, dürfen nach Abschluss der ersten Impfserie, bestehend aus zwei Dosen Comirnaty®, fortan
- Personen im Alter von 65 Jahren und älter,
- Personen im Alter von 18 bis 64 Jahren mit hohem Risiko für eine schwere COVID-19-Erkrankung und
- Personen im Alter von 18 bis 64 Jahren, die aufgrund ihrer beruflichen Exposition gegenüber SARS-CoV-2 ein hohes Risiko für schwerwiegende Komplikationen von COVID-19, einschließlich schweres COVID-19, aufweisen,
eine einzige Booster-Dosis erhalten. Diese soll mindestens sechs Monate nach Abschluss der ersten Impfserie verabreicht werden.
Erst ab 18 Jahren
Anders als die primäre Impfserie, die für ab 16-Jährige seit dem 23. August bereits regulär zugelassen und für Zwölf- bis 15-Jährige notfallzugelassen ist, darf die Booster-Impfung erst ab einem Alter von 18 Jahren geimpft werden. Zudem hatte die FDA bereits im August den Weg für Drittimpfungen bei immungeschwächten Menschen geebnet und dafür die Notfallzulassungen von Comirnaty® und Spikevax® (Moderna) angepasst.
Mehr zum Thema

mRNA-Impfstoffe von Pfizer/Biontech und Moderna
FDA ebnet Weg für Drittimpfung für Immungeschwächte
Keine reine Notfallzulassung mehr
FDA erteilt Comirnaty reguläre Zulassung
EMA prüft Booster-Impfungen von Biontech und Moderna
Auffrischimpfungen bald auch in der EU
Die FDA stützt die Genehmigung einer Auffrischungsdosis auf mehrere Daten zur Sicherheit und Wirksamkeit der Vakzine, zum einen auf Studiendaten, zum anderen auf nationale und internationale Real-World-Daten, unter anderem von der CDC, dem Vereinigten Königreich und aus Israel. So zeigte eine Untersuchung an etwa 200 Teilnehmern im Alter von 18 bis 55 Jahren, die sechs Monate nach der zweiten Comirnaty®-Dosis eine dritte Dosis erhalten hatten, eine „Auffrischungsreaktion“ bei den Antikörpern verglichen mit nur zweifach Geimpften.
Weniger Durchbruchinfektionen
Zudem untersuchten Pfizer/Biontech auf Wunsch der FDA die Durchbruchinfektionen von ursprünglichen Studienteilnehmern der zulassungsrelevanten Studie, die mit zwei Impfdosen – jedoch zu unterschiedlichen Studienzeitpunkten – geimpft worden waren. Betrachtet wurde der Zeitraum von Juli 2021 bis August 2021, als die Delta-Variante das Infektionsgeschehen in den USA bereits dominierte. Laut der FDA zeigte diese Analyse mehr Durchbruchinfektionen bei zu früheren Zeitpunkten Geimpften als bei denen, die ihre Impfdosen später erhalten hatten: „Die FDA kam zu dem Schluss, dass die in diesem Zeitraum gemeldete Durchbruchrate von COVID-19 eine leichte Abnahme der Wirksamkeit des Impfstoffs bei den früher Geimpften bedeutet“
Mehr geschwollene Lymphknoten
Zur Sicherheit der Auffrischungsdosis gibt es Daten von 306 Studienteilnehmern zwischen 18 und 55 Jahren sowie zwölf weiteren ab 65-Jährigen. Sie wurden nach der Impfung im Durchschnitt zwei Monate lang nachbeobachtet. Am häufigsten berichteten die Geimpften über Schmerzen, Rötungen und Schwellungen an der Injektionsstelle und Müdigkeit, Kopfschmerzen, Muskel- oder Gelenkschmerzen und Schüttelfrost. Bemerkenswert sei, erklärt die FDA, dass geschwollene Lymphknoten in der Achselhöhle nach der Auffrischungsdosis häufiger beobachtet wurden als nach der ersten Serie von zwei Dosen.
„Die heutige Maßnahme zeigt, dass die Wissenschaft und die derzeit verfügbaren Daten weiterhin die Entscheidungsgrundlage der FDA für COVID-19-Impfstoffe während dieser Pandemie bilden. Nach Abwägung der Gesamtheit der verfügbaren wissenschaftlichen Beweise und der Überlegungen unseres beratenden Ausschusses unabhängiger, externer Experten hat die FDA die EUA für den COVID-19-Impfstoff von Pfizer/Biontech geändert, um eine Auffrischungsdosis für bestimmte Bevölkerungsgruppen wie Mitarbeiter des Gesundheitswesens, Lehrer und Kindertagesstättenpersonal, Beschäftigte in Lebensmittelbetrieben und in Obdachlosenunterkünften oder Gefängnissen zuzulassen“, sagte die amtierende FDA-Kommissarin Janet Woodcock, M.D..





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.