
- DAZ.online
- News
- Pharmazie
- Titandioxid – welche ...
FAH-Informationsveranstaltung (Bildergalerie)
Titandioxid – welche Ersatzstoffe es gibt und wie die Tabletten aussehen
Zunächst hat die kritische Diskussion um den Hilfsstoff Titandioxid nur Lebensmittel tangiert, spätestens seit dem Verbot des Farbstoffs in Lebensmitteln muss sich aber auch die pharmazeutische Industrie mit Ersatzstoffen auseinandersetzen. Doch was würde ein Wechsel des Hilfsstoffs konkret und optisch bedeuten – beispielsweise bei der Fertigarzneimittelprüfung in der Apotheke? Wie würden die Tabletten künftig aussehen?
Der in Arzneimitteln breit eingesetzte Hilfsstoff Titandioxid ist nach einer lang geführten Diskussion ab 7. August 2022 in Lebensmitteln verboten. Nach diesem Zeitpunkt dürfen Titandioxid-enthaltende Lebensmittel noch bis zu ihrem Mindesthaltbarkeits- oder Verbrauchsdatum auf dem Markt bleiben. In Arzneimitteln darf Titandioxid hingegen vorerst weiterhin als Hilfsstoff zum Einsatz kommen. Allerdings soll die europäische Arzneimittelbehörde EMA noch vor dem 24. April 2024 eine weitere Bewertung von Titandioxid durchführen. Denn wenn innerhalb der nächsten drei Jahre die Arzneimittelindustrie Titandioxid nicht durch einen anderen Hilfsstoff ersetzt oder zumindest damit beginnt, sollten nur noch „objektive, nachprüfbare Gründe für die Undurchführbarkeit seiner Ersetzung berücksichtigt werden“. Das geht aus der Verordnung (EU) 2022/63 hinsichtlich des Lebensmittelzusatzstoffs Titandioxid (E 171) hervor.
Mehr zum Thema

Kein TiO2 in Lebensmitteln ab 2022
EMA: So wichtig ist Titandioxid für Arzneimittel

Neubewertung für Arzneimittel in drei Jahren
Titandioxid in Lebensmitteln ab August 2022 verboten

In Lebensmitteln verboten, in Arzneimitteln erlaubt
Kosmetik wie Zahnpasta – besser ohne Titandioxid?
Die Arzneimittelindustrie muss sich also mit dem Thema Titandioxid in Arzneimitteln auseinandersetzen. Das hat sie beispielsweise am 2. März auf einer virtuellen Informationsveranstaltung der Forschungsvereinigung der Arzneimittel-Hersteller (FAH) getan, unter dem Titel: „REACH: Titandioxid und vergleichbare Herausforderungen für Arzneimittel- und Medizinprodukte-Hersteller“.
Die REACH-Verordnung ist bereits seit dem Jahr 2007 in Kraft. REACH steht dabei für „Regulation concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals“, die Verordnung regelt also die Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe – und folgt dem Grundsatz, dass Hersteller, Importeure und nachgeschaltete Anwender die Verantwortung für ihre Chemikalien übernehmen. Ohne Registrierung und entsprechende Sicherheitsdaten dürfen Chemikalien seitdem nicht mehr auf den Markt gebracht werden.
Wie die FAH in seiner Einladung zur aktuellen Informationsveranstaltung erklärte, trat am 1. Juni 2018 die letzte Registrierungsphase von REACH in Kraft, „d.h. Hersteller oder Importeure, welche Stoffe als solche und/oder Stoffe in Zubereitungen mit mehr als einer Tonne pro Jahr in Europa herstellen oder einführen, müssen diese registrieren“. Und so erläuterte auch FAH-Geschäftsführerin Dr. Heike Wollersen zu Beginn der Veranstaltung, dass die Regulierung von Stoffen durch REACH einen immer größeren Stellenwert einnehme: Sowohl Hersteller von Medizinprodukten als auch von Arzneimitteln müssten ihren Fokus darauf wenden – auch wenn Arzneimittel prinzipiell aus der REACH-Verordnung ausgenommen seien. Das macht der Fall Titandioxid aktuell deutlich.
Titandioxid mittlerweile auch außerhalb der EU ein Thema
Wie Dr. Daniela Allhenn vom Bundesverband der Arzneimittel-Hersteller (BAH) in ihrem Vortrag erläuterte, schwelt die Diskussion rund um Titandioxid bereits seit dem Jahr 2010. Sie verwies auf eine Analyse der Europäischen Arzneimittel-Agentur EMA zum Ersatz von Titandioxid in Arzneimitteln, über welche die DAZ bereits berichtete, und machte darauf aufmerksam, dass Titandioxid mittlerweile auch außerhalb der EU ein Thema ist. Das „Joint FAO/WHO Expert Committee on Food Additives“ (JECFA) habe für 2022 eine umfassende Sicherheitsüberprüfung angekündigt. Arzneimittel- und Medizinproduktehersteller müssten sich in Zukunft also überlegen, wie und ob man Titandioxid in einigen pharmazeutischen Formulierungen zur weiteren Verwendung schützen kann, zum Beispiel wenn es zur Stabilisierung des Wirkstoffs benötigt wird. Und man müsse sich natürlich über geeignete Alternativen Gedanken machen. Dr. Hendrik Schütte von der Krewel Meuselbach GmbH hat dies bereits getan und berichtete in seinem anschließenden Vortrag über geeignete Ersatzstoffe.
Praxis-Beispiele von Krewel Meuselbach
Laut Schütte enthalten etwa 91.000 Humanarzneimittel und 800 Tierarzneimittel Titandioxid. Es zeichne sich dadurch aus, dass es durch seinen hohen Brechungsindex schon in niedriger Konzentration ein helles Weiß erzeuge. Es handle sich zudem um ein inertes Farbpigment mit stark deckenden Eigenschaften, das also einen Lichtschutz bietet. Titandioxid habe gute Verarbeitungseigenschaften und sei von hoher Reinheit. Es komme nicht nur in Tabletten, sondern auch in der Hülle von Hart- und Weichkapseln zum Einsatz sowie in Pasten und Suspensionen. Der Einfachheit wegen konzentrierte sich Schütte in seinen Ausführungen aber auf die Tabletten.
Beispiele für alternative Farbpigmente aus dem Arzneibuch
Beispiele für alternative (im Arzneibuch monographierte) mineralische Farbpigmente seien
- Calciumcarbonat und
- Magnesiumcarbonat, organisch kämen
- Stärke,
- Fettsäuren und
- PEG-Fettsäureester
infrage. Schon die EMA hatte erklärt, dass Calciumcarbonat, Talkum und Stärke zwar mögliche Alternativen seien, diese aber Nachteile mit sich bringen. So könnten keine ausreichend dünnen Filmüberzüge erreicht werden, es gebe Probleme in der Lieferkette und auch ein Verunreinigungsrisiko. Jedes betroffene Arzneimittel müsse zudem individuell hinsichtlich Alternativen, Neuformulierung, Auflösungs- und Stabilitätsdaten sowie potenziell Bioäquivalenz untersucht werden. All das müsse dann durch die zuständigen Zulassungsbehörden nochmals bewertet werden, hieß es.
Optische Unterschiede in Realität kaum sichtbar?
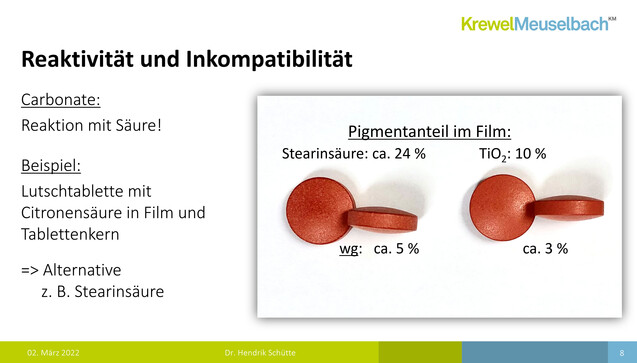
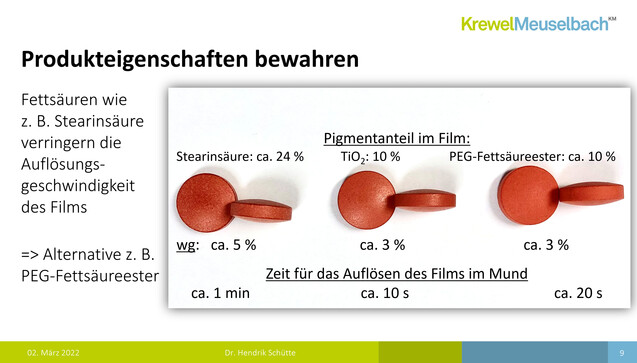
Doch wie sieht so etwas praktisch aus? Das stellte Schütte in mehreren Fotos dar – von Tabletten, die bei Krewel Meuselbach mit verschiedenen Ersatzstoffen überzogen wurden (siehe Bildergalerie). So sollen etwa bei einem Calciumcarbonat-Überzug leicht die Kanten der Tabletten durchscheinen. Das sei in der Realität jedoch deutlich weniger sichtbar als auf den Fotos. Eine solche Optik sei also zwar nicht gewünscht, aber vielleicht doch akzeptabel? Ein Problem sei jedoch, die erniedrigte Robustheit durch eine erhöhte Partikelzahl. Die Tablettenfilme könnten also aufplatzen. Mischfarben seien wiederum deutlich einfacher umzusetzen (siehe Galerie). Jedoch sei nicht nur an die Optik zu denken. Carbonate reagieren beispielsweise mit Säuren. Es ist also mit einem anderen Auflöseverhalten der Tabletten zu rechnen. Am Beispiel einer Lutschtablette machte Schütte deutlich, dass sich Filme mit PEG-Fettsäureester schneller auflösten, als mit Fettsäuren wie Stearinsäure.
Nicht zu kompliziert denken!
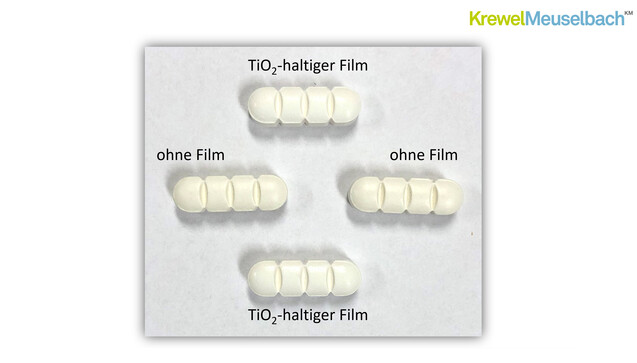
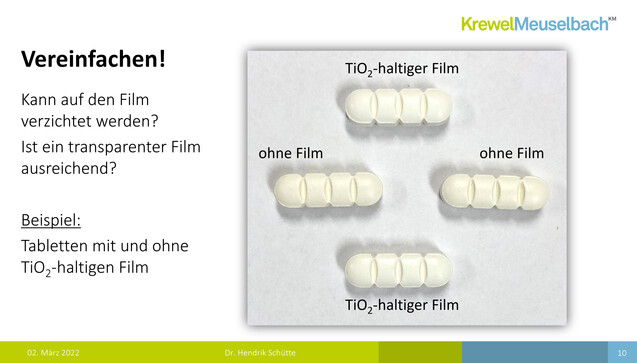
Dann mahnte Schütte seine Zuhörer:innen, nicht zu kompliziert zu denken. An einem weiteren Beispielbild verdeutlichte er, dass bei manchen Tabletten ganz auf einen Film verzichtet werden könne, oder zumindest auch ein transparenter Film ausreichend sein könnte. Natürlich muss man aber auch an Argumente wie die Schluckbarkeit und etwa eine Geschmacksmaskierung denken. Schließlich lautet Schüttes Fazit, dass es akzeptable Ersatzstoffe für Titandioxid gibt, jedoch keine Universallösung. Oft seien dann Kompromisse wie eine höhere Prozesszeit, höhere Hilfsstoffmengen, ein weniger brillantes Weiß und die geringere Robustheit einzugehen.
Insgesamt steige die Diversität an Hilfsstoffen im Portfolio, eine Gruppierung von verschiedenen Fällen könnte dann vielleicht in Zukunft bei der Umsetzung und Argumentation gegenüber der EMA helfen. Auf die Industrie kommen also ein erhebliches Stück Arbeit und wohl auch Kosten zu.
























2 Kommentare
Titandioxid in Arzneimitteln
von Joachim Maurice Mielert am 11.03.2022 um 8:11 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Titandioxid in Arzneimitteln
von Agitator am 11.03.2022 um 8:50 Uhr
Das Kommentieren ist aktuell nicht möglich.