
- DAZ.online
- News
- Pharmazie
- Weiteres präventives ...
Tixagevimab/Cilgavimab in Evusheld
Weiteres präventives Antikörper-Duo gegen COVID-19 für Europa
Stuttgart - 25.03.2022, 12:45 Uhr
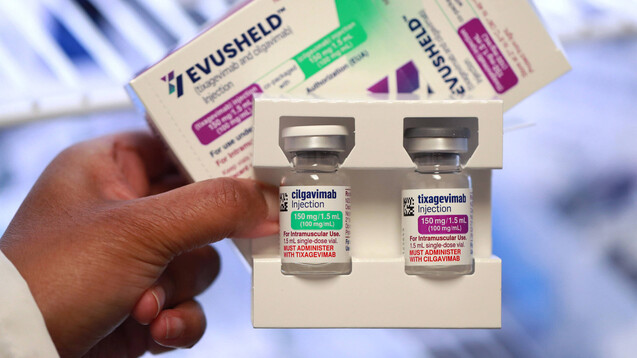
Laborstudien sollen zeigen, dass das Antikörperduo gegen Omikron BA.1 möglicherweise weniger effektiv ist als gegen BA.2. (x / Foto: IMAGO / ZUMA Wire)
Mit steigenden Infektionszahlen werden für Menschen, bei denen die COVID-19-Impfung nicht ausreichend wirkt, präventive Arzneimittel immer wichtiger. Die EMA hat nun ein weiteres zur Zulassung empfohlen – ein Antikörper-Duo. Allerdings ist noch nicht klar, ob die Dosierung hinsichtlich der Omikron-Variante angepasst werden muss.
Der Präsident des Robert Koch-Instituts (RKI), Professor Lothar Wieler, hat angesichts der aktuellen Rekord-Infektionszahlen seine Appelle für eine Impfung und rücksichtsvolles Verhalten wiederholt: „Die Pandemie ist noch nicht vorbei, im Gegenteil“, sagte Wieler am Freitag in Berlin mit Blick auf das sich verschärfende Infektionsgeschehen.
Schon zuvor hatte die Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie DGHO darauf hingewiesen, dass Krebspatient:innen in der Pandemie weiterhin besonderen Schutz benötigen. Außerdem machte die DGHO auf eine notwendige und frühzeitige Therapie von Menschen mit aktiver Krebserkrankung oder immunsuppressiver Therapie aufmerksam. Die Therapie sollte mit antiviralen Arzneimitteln oder Antikörperpräparaten innerhalb von drei bis fünf Tagen nach Symptombeginn für Menschen mit einem erhöhten Risiko für einen schweren COVID-19-Verlauf beginnen, hieß es. Zur Verfügung stünden hierfür:
- zwei monoklonale Antikörper als Injektion bzw. Infusion (Sotrovimab (Xevudy®), Tixagevimab/Cilgavimab (AZD7442, Evusheld™))
- drei Virostatika in Tablettenform (Molnupiravir (Lagevrio®), Nirmatrelvir/Ritonavir (Paxlovid®), Remdesivir (Veklury®)).
Mehr zum Thema
Tixagevimab/Cilgavimab in Evusheld
UK lässt prophylaktisches Antikörperduo zu
Zugelassen werden soll das Präparat von AstraZeneca zur Vorbeugung von COVID-19 bei Erwachsenen und Jugendlichen ab zwölf Jahren mit einem Körpergewicht von mindestens 40 kg. Das bedeutet: Die Anwendung erfolgt vor einer möglichen Exposition mit SARS-CoV-2.
Das Präparat besteht aus einer Kombination zweier monoklonaler Antikörper: Tixagevimab und Cilgavimab, die beide am Spike-Protein – an zwei verschiedenen Stellen – angreifen. So soll das Virus am Eindringen in die Zellen und seiner Vermehrung gehindert werden, was schließlich eine COVID-19-Infektion verhindert.
Sechs Monate Schutz vor COVID-19
Wie die EMA in einer Mitteilung erklärt, basiert die Empfehlung auf einer Studie mit mehr als 5.000 Proband:innen. Wurde diesen Evusheld™ mit zwei Injektionen verabreicht (150 mg Tixagevimab und 150 mg Cilgavimab), verringerte dies ihr Risiko für eine COVID-19-Infektion um 77 Prozent. Die Dauer des Schutzes wurde auf sechs Monate geschätzt.
Die erwachsenen Proband:innen waren alle nicht geimpft und zuvor nie an Corona erkrankt, auch hatten sie keine anderen präventiven Therapien erhalten. Verglichen wurde gegen Placebo (Scheininjektion). Das Ergebnis: Bei acht von 3.441 mit Evusheld™ Behandelten wurde ein COVID-19-Durchbruch im Labor bestätigt (0,2 Prozent). Unter Placebo waren es hingegen 17 von 1.731 (1 Prozent).
Dosierung je nach Variante?
Allerdings wurden die Studiendaten noch vor dem Auftreten der Corona-Variante erhoben. Laborstudien sollen zeigen, dass das Antikörperduo gegen Omikron BA.1 möglicherweise weniger effektiv ist als gegen BA.2. Die EMA will in den kommenden Wochen Daten auswerten, um zu beurteilen, ob ein alternatives Dosierungsschema geeignet sein könnte.
Die Nebenwirkungen werden als gering beschrieben: Nur wenige Personen sollen über Reaktionen an der Injektionsstelle oder Überempfindlichkeitsreaktionen berichtet haben. Die Zulassungsempfehlung wird nun an die Europäische Kommission für die finale Zulassung weitergeleitet, was als Formalie gilt.
Mehr zum Thema
Antikörper gegen SARS-CoV-2
EMA-Zulassungsempfehlung für Casirivimab/Imdevimab und Regdanvimab

EMA prüft neuen Corona-Antikörper
Sotrovimab soll auch bei Omikron-Variante wirken

Nur für Covid-19-Risikopatient:innen
Casirivimab und Imdevimab: WHO empfiehlt erste Präventivtherapie gegen COVID-19
Mit Ronapreve® – Casirivimab plus Imdevimab – hatte die EU im November 2021 die ersten Antikörperpräparate gegen COVID-19 zugelassen. Das Antikörperduo Casirivimab und Imdevimab darf sowohl zur Behandlung wie auch zur Vorbeugung von COVID-19 angewendet werden. „Erste In-vitro-Neutralisationsassays zeigen jedoch eine deutlich verringerte Neutralisierungsaktivität gegenüber der Omikron-Variante des SARS-CoV-2 und deuten damit auf geringere Wirksamkeit hin“, erklärte das PEI im Januar. Die WHO empfiehlt die Therapie damit deshalb nur noch, wenn klar ist, welche Variante vorliegt.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.