
- DAZ.online
- DAZ / AZ
- AZ 36/2011
- Gemeinschaftsaktion gegen...
Gesundheitspolitik
Gemeinschaftsaktion gegen Arzneimittelfälschungen
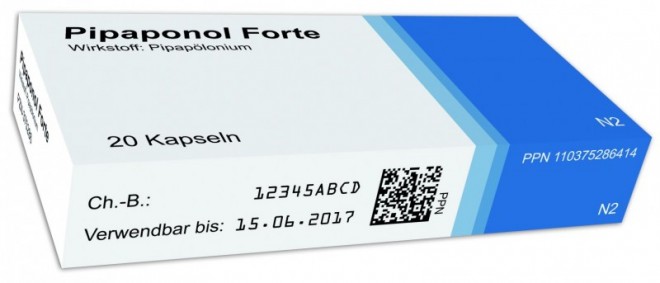
Kern des neuen Sicherheitskonzeptes ist ein DataMatrix-Code auf der Arzneimittelverpackung, der eine fälschungssichere Seriennummer enthält. Beim Scannen in der Apotheke kann so vor Abgabe an den Patienten die Echtheit des Arzneimittels zweifelsfrei festgestellt werden: "Ist die Seriennummer ordnungsgemäß, wird das vom System bestätigt und die Nummer in der Datenbank als abgegeben vermerkt. Eine unbekannte oder eine bereits zuvor von einer Apotheke abgegebene Packungsnummer löst hingegen einen Alarm aus: Der Patient erhält dann eine andere, korrekte Packung; und dem Fälschungsverdacht wird nachgegangen", so Dr. Reinhard Hoferichter, designierter Geschäftsführer von securPharm.
Außerdem sollen die Verpackungen gegen Manipulationen gesichert werden. Gedacht wird hier an Klebepunkte oder Klebesiegel, an Zellophanhüllen und perforierte Öffnungslaschen. Damit sollen die Packungen gegen unbefugte Öffnung gesichert werden.
"Überschaubare" Umstellungskosten für Apotheken
Mit der Umsetzung der EU-Richtlinie kommen auf die Arzneimittelhersteller laut securPharm "sechsstellige" Investitionen zu. Für die Apotheken stehen "sehr überschaubare" Umstellungskosten für neue Scanner und Apothekensoftware ins Haus. Laut ABDA-Vizepräsident Dr. Peter Homann belaufen sich die Kosten für eine durchschnittliche Apotheke auf 1500 Euro: "Sehr viel mehr wird es nicht sein."
Mit der Initiative securPharm greifen die deutschen Verbände der Umsetzung der EU-Richtlinie voraus. Die EU-Richtlinie wurde zwar in diesem Jahr verabschiedet. Aber erst im Jahr 2013/14 wird die EU die technische Umsetzung präzisieren. Die Markteinführung ist im Jahr 2016/17 vorgesehen. Zum DataMatrix-Code der deutschen Verbände gibt es zwei konkurrierende Systeme: Die Chip-Technik und die von Paketdiensten bekannte "Track and Trace"-Methode.
Offenbar besteht auf deutscher Seite die Erwartung, mit der Entwicklung der DataMatrix-Code-Technik einen Vorsprung zu gewinnen und später diese Technik in der gesamten EU durchsetzen zu können. Nach Angaben von securPharm-Geschäftsführer Hoferichter steht die deutsche Initiative in engem Kontakt mit den politischen Entscheidungsträgern in Berlin und auf EU-Ebene. Es gebe klare positive Signale für die deutsche Technik.
"securPharm befindet sich derzeit in Gründung", so Hoferichter. "Wesentliche Eckpunkte des geplanten Sicherheitssystems sind bereits festgelegt." Demzufolge sollen beim geplanten Pilotversuch mehrere Hersteller die Packungen einiger ausgewählter rezeptpflichtiger Arzneimittel mit einem DataMatrix-Code ausstatten; solche Codes sind beispielsweise auch bei Bahntickets gängig. Der Code wird unter anderem eine Packungs-individuelle Seriennummer enthalten, die auch in einer Datenbank gespeichert wird. "Damit wird jede Packung zu einem Unikat", sagte Hoferichter.
Am Pilotversuch teilnehmende Apotheken werden mit DataMatrix-Scannern ausgestattet, mit denen der Code gelesen werden kann. Sie scannen damit jedes gekennzeichnete Präparat, ehe sie es an einen Patienten aushändigen, und lösen damit eine geschützte Abfrage im Datenbank-System aus. "Ein Medikament wird also zweimal erfasst: beim Eintritt in und beim Austritt aus der Vertriebskette. Solch eine End-to-End-Kontrolle mit DataMatrix-Technologie kann Fälscher zuverlässig abschrecken", erklärte Hoferichter. Zusätzlich soll das securPharm-System auch dem Großhandel die Möglichkeit bieten, die Identität einzelner Packungen zu verifizieren. Das Pilotprojet soll mit einer "begrenzten Zahl von Teilnehmern" durchgeführt werden. Mit im Boot sein werden Hersteller, Großhändler und Apotheken. Es soll zwei bis fünf Modellregionen geben. Dem Datenschutz wird laut securPharm ebenfalls Rechnung getragen. Bei der Abfrage der neuen Seriennummer bei der Abgabe in der Apotheke erhält der Hersteller keine Informationen weder über die Identität der Apotheke noch über Patientendaten.
Im Juli 2011 wurde die EU-Richtlinie zur Bekämpfung von Arzneimittelfälschungen veröffentlicht. Europaweit sollen ihr zufolge Arzneimittel mit Sicherheitsmerkmalen versehen werden, die die Identifizierung und Authentizität der einzelnen Packung in der legalen Vertriebskette sicherstellen; welche Arzneimittel das betrifft, wird die EU-Kommission noch bestimmen.
Grundsätzlich müssen danach alle Rx-Arzneimittel die neuen Sicherheitsmerkmale tragen. Ausnahmen sollen nur für rezeptpflichtige Arzneimittel mit einem geringen Fälschungsrisiko gewährt werden. OTC-Produkte fallen grundsätzlich nicht unter die neuen Sicherheitsbestimmungen. Nur OTC-Produkte mit einem bekannt hohen Fälschungsrisiko sollen ebenfalls die neuen Sicherheitsmerkmale tragen müssen.
Die Kosten für das Gemeinschaftsprojekt securPharm tragen die beteiligten Verbände paritätisch. In Kürze soll ein technischer Dienstleister benannt werden, der die Umsetzung übernimmt.
Laut securPharm beschränkt sich die EU-Richtlinie und damit das Pilotprojekt ausschließlich auf die Arzneimittelfälschungen in der legalen Vertriebskette und beispielsweise nicht den illegalen Internethandel. Bei der Abgabe von jährlich 1,4 Milliarden Arzneimittelpackungen in Deutschland wurden zwischen 1996 und 2008 nur 40 Arzneimittelfälschungen aktenkundig. Derzeit wird in vier Fällen wegen des Inverkehrbringens von gefälschten Arzneimitteln ermittelt. Keine Schätzungen bestehen hinsichtlich der Dunkelziffer.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.