
- DAZ.online
- DAZ / AZ
- DAZ 39/2011
- Antikörper Teplizumab ...
Arzneimittel und Therapie
Antikörper Teplizumab bei Typ-1-Diabetes
Auslöser eines Typ-1-Diabetes sind nach heutigem Erkenntnisstand T-Zell-vermittelte Autoimmunreaktionen gegen die Betazellen des Pankreas, die verschiedene, auch genetische Ursachen haben können. Die Idee, Immuntherapeutika bei Typ-1-Diabetes einzusetzen, ist nicht ganz neu. Bereits Mitte der 80-er Jahre wurde das Immunsuppressivum Ciclosporin in Studien erfolgreich gegen das Fortschreiten einer frisch diagnostizierten Erkrankung angewendet. Mit dem chimären (Mensch/Ratte) anti-CD3-Antikörper Otelixizumab wurden placebokontrollierte Untersuchungen durchgeführt, bei denen der Insulinbedarf der Diabetiker unter der Behandlung abnahm.
Phase-II/III-Studie mit Teplizumab
Auch für den humanisierten monoklonalen anti-CD3-Antikörper Teplizumab gab es derartige ermutigende Ergebnisse aus kleineren Untersuchungen. Die kürzlich in der Fachzeitschrift Lancet publizierte randomisierte, kontrollierte, doppelblinde, multizentrische vierarmige Phase-II/III-Studie hatte das Ziel, die Effektivität und Sicherheit von Teplizumab zu prüfen. Die auf zwei Jahre angelegte Untersuchung schloss Patienten im Alter zwischen acht und 35 Jahren ein, deren Diabetes maximal zwölf Wochen zuvor diagnostiziert worden war. Rekrutiert wurden sie an 83 Kliniken in Nordamerika, Europa (darunter Deutschland), Israel und Indien.
Den Patienten der Behandlungsarme verabreichte man zu Studienbeginn sowie nach 26 Wochen drei verschiedene Teplizumab-Regime i.v.: eine Normaldosis über sechs bzw. 14 Tage (kumulative Teplizumab-Dosis 2426 µg/m2 bzw. 9034 µg/m2) sowie eine reduzierte Dosis (2985 µg/m2 über 14 Tage). Der primäre Endpunkt setzte sich zusammen aus dem prozentualen Anteil der Patienten mit einem Insulinverbrauch von weniger als 0,5 U/kg pro Tag und einem HbA1c -Wert unter 6,5% nach einem Jahr.
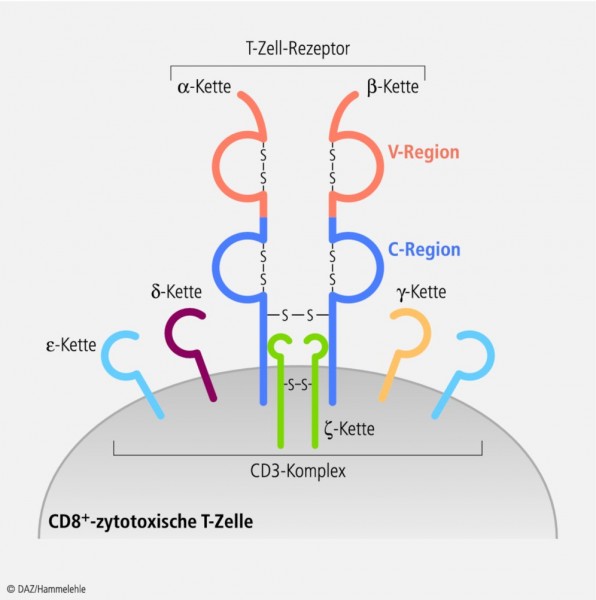
Wie wirkt Teplizumab?Beim Typ-1-Diabetes findet eine fortschreitende Zerstörung der Insulin-sezernierenden Inselzellen des Pankreas durch autoreaktive T-Lymphozyten statt. Teplizumab ist ein humanisierter monoklonaler Antikörper, der an ein Epitop der ε-Kette des CD3-Proteins von diesen Immunzellen bindet. Die Proteine des CD3-Komplexes sind für die Expression des T-Zellrezeptors auf der Oberfläche von T-Lymphozyten verantwortlich. Normalerweise senden sie Signale in das Zellinnere, nachdem eine Antigenbindung stattgefunden hat. Bindet Teplizumab an den T-Lymphozyten, ist diese transmembranäre Signalübertragung blockiert. Man erhofft sich, dass dadurch die Zerstörung der Beta-Zellen behindert wird. Zusätzlich werden durch Teplizumab regulatorische CD8-positive Zellen zur Proliferation angeregt. Das soll ebenfalls dazu beitragen, das Fortschreiten des Diabetes zu verlangsamen. |
C-Peptid bestimmt
In den Blutproben der Patienten bestimmte man neben dem HbA1c -Wert auch die C-Peptid-Spiegel (nach Glucosebelastungstest), da die mittlere Veränderung in der AUC des C-Peptids (siehe Kasten) nach einem Jahr zu den sekundären Endpunkten der Studie zählte. Außerdem wurde die Viruslast bezüglich Eppstein-Barr- und Cytomegalie-Virus dokumentiert.
C-PeptidDas C-Peptid besteht aus 31 Aminosäuren und verbindet die A-Kette des Insulins mit der B-Kette. Bei der Umwandlung von Proinsulin in Insulin wird es enzymatisch abgespalten und gelangt ins Blut, wo es als Marker für die Betazellfunktion dienen kann. |
Primären Endpunkt verfehlt
Zwischen den vier Gruppen (n = 513) gab es keine Unterschiede bezüglich des Anteils der Patienten, der den primären Endpunkt erreichte. Er lag bei 19,8% (41 von 207 Patienten) in der 14-Tage-Normaldosisgruppe, bei 13,7% (14 von 102) in der 14-Tage-Niedrigdosisgruppe, bei 20,8% (22 von 106) in der 6-Tage-Normaldosisgruppe und bei 20,4% (20 von 98) unter Placebo. In den Teplizumab-Gruppen benötigten nach einem Jahr 19 von 415 Patienten kein Insulin mehr, in der Placebogruppe betraf dies keinen Patienten (p = 0,03). Die unerwünschten Wirkungen waren in den vier Gruppen annähernd gleich verteilt. Das häufigste unerwünschte Ereignis unter Teplizumab, das bei 53% der Patienten (Placebo: 20%) auftrat, war Rash.
Unterschiede nach Subgruppenanalyse
Obwohl die Studie damit ihren primären Endpunkt verfehlt hat, weisen die Autoren doch auf positive Ergebnisse in einigen Subgruppenanalysen hin. Legt man beispielsweise eine Grenze von 0,25 U Insulin/kg pro Tag anstelle von 0,5 U/kg pro Tag als Cut-off zugrunde, so war der Anteil der Patienten in der 14-Tage-Normaldosis-Gruppe signifikant höher als in der Placebogruppe (p = 0,02). Ein weiterer Unterschied fand sich bei der Abnahme der mittleren AUC der C-Peptid-Konzentration. Sie war geringer bei Patienten im Alter zwischen 8 und 11 Jahren, bei US-amerikanischen Patienten sowie bei denen mit "frischer" Diagnose (weniger als sechs Wochen vor Rekrutierung gestellt). Bei diesen Patienten war in der 14-Tage-Normaldosis-Gruppe auch der Anteil der Patienten, die einen HbA1c unter 7% und einen Insulinverbrauch unter 0,25 U/kg pro Tag hatten niedriger als unter Placebo. Dies führt die Autoren zu der Überzeugung, dass es Subgruppen gibt, die von einer Teplizumab-Behandlung besonders profitieren: jüngere Patienten, mit US-Herkunft und solche mit frühzeitigem Behandlungsbeginn. Auf diese Patientengruppen sollte sich der Fokus zukünftiger Untersuchungen richten.
QuelleSherry, N, et al.: Teplizumab for treatment of type 1 diabetes (Protégé study): 1-year results from a randomized, placebo-controlled trial. Lancet 378: 487 – 497 (2011).Bach, J-F: Anti-CD3 antibodies for type 1 diabetes: beyond expectations. Lancet 378: 459 – 460 (2011).
Apothekerin Dr. Claudia Bruhn





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.