
- DAZ.online
- DAZ / AZ
- DAZ 7/2016
- Ciclopoli® mehr als ...
Arzneimittel und Therapie
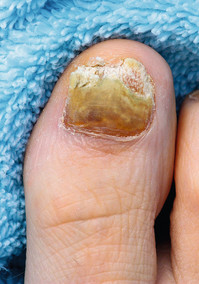
Ciclopoli® mehr als doppelt so wirksam?
Rechtsstreit zwischen Ciclopoli®-Hersteller Taurus und Loceryl®-Hersteller Galderma
Im März 2015 wurden im Rahmen einer Posterpräsentation des 12th EADH Spring Symposiums in Valenzia die Ergebnisse einer Head-to-Head-Studie von Ciclopirox 8% versus Amorolfin 5% vorgestellt mit folgenden Schlussfolgerungen: Die komplette Heilungsrate ist mit Ciclopoli® im Vergleich zur Amorolfin nach 48 Wochen dreimal höher, die Responderrate nach dieser Zeit doppelt so hoch. Unter Berufung auf diese Ergebnisse startete Ciclopoli®-Hersteller Taurus eine breit angelegte Werbekampagne. Anfang Oktober 2015 ist die Open-label-Studie vollständig veröffentlicht worden [1], fälschlich ausgewiesen als randomisiert kontrollierte Doppelblindstudie. Eine Steilvorlage für Galderma, Hersteller des Amorolfin-Nagellackes Loceryl®. So hat Galderma beim Landgericht Hamburg eine einstweilige Verfügung erwirkt, die Taurus untersagt, unter Berufung auf diese Studie mit der Aussage zu werben: „Ciclopoli® – Mehr als doppelt so wirksam bei Nagelpilz.“
„Irreführende Werbeaussage“
Die Werbung wurde nicht nur wegen des falschen Titels als irreführend gewertet. Die „streitgegenständliche Werbeaussage sei auch deshalb irreführend, so das Landgericht Hamburg, weil die Studie nicht hinreichend aussagekräftig sei und ein wissenschaftlicher Nachweis fehle. Dabei wird auf den primären Studienendpunkt verwiesen, der im Prüfplan als negative mykologische Kultur nach zwölf Wochen definiert worden war. Zu diesem Zeitpunkt gab es keine statistisch signifikanten Unterschiede zwischen Ciclopirox und Amorolfin. Ein Rückgriff auf die nachträglich im Prüfplan ergänzten sekundären Studienendpunkte nach 24 und 48 Wochen bei Verfehlen des primären Studienendpunkts sei nicht statthaft, so das Gericht.
Taurus wehrt sich
Taurus Pharma verweist in einer Stellungnahme darauf, dass in einem Erratum der Fehler im Titel korrigiert worden ist. „Double-Blind“ wurde gestrichen. Wie dieser Fehler zustande kam, ist Taurus Pharma nicht klar. Es wird jedoch darauf verwiesen, dass der Beitrag selbst das Studiendesign richtig beschreibt. Für Taurus Pharma sind die Studienergebnisse nicht infrage zu stellen, da die nachträglich erhobenen sekundären Endpunkte nach 24 und 48 Wochen wie der primäre Endpunkt ebenfalls als Wechsel zu einer negativen mykologischen Kultur definiert gewesen seien. Galderma hält dieses Vorgehen jedoch für unzulässig (s. Kasten). Taurus Pharma wird gegen die einstweilige Verfügung Widerspruch einlegen und zeigt sich zuversichtlich, das Landgericht von der Aussagekraft der Studie überzeugen zu können.
„Schluss auf Überlegenheit unzulässig“
Eine Stellungnahme der Firma Galderma
Der ursprüngliche Titel der klinischen Studie laut Prüfplan lautete „Randomized, open-label, controlled study on the efficacy of Ciclopoli® (ciclopirox 8% nail lacquer) versus Loceryl® (amorolfine 5% nail lacquer) on the culture conversion to negative in patients with onychomycosis.“ (einzusehen im europäischen Clinical Trials Register unter der EudraCT Nummer 2011-003087-70). Weder die Patienten noch die Prüfärzte waren in der Studie verblindet. Lediglich die Auswertung der Fotografien der betroffenen Zehennägel hinsichtlich der klinischen Besserung/Heilung erfolgte nach Woche 24 und 48 durch einen verblindeten Prüfer.
Ausweislich der Angaben im Prüfplan war der alleinige primäre Endpunkt der Studie von Iorizzo M et al. der Wechsel zur negativen mykologischen Kultur („conversion to negative culture“) nach zwölf Wochen, da die Studie ursprünglich nur auf zwölf Wochen angelegt war. Die diversen sekundären Endpunkte waren nach dem nach Studienbeginn geänderten Prüfplan nach 4, 8, 12, 24 und 48 Wochen zu erheben. Der im Prüfplan angegebene primäre Endpunkt (Wechsel zur negativen mykologischen Kultur („conversion to negative culture“) nach zwölf Wochen) wird in der Publikation von Iorizzo M et al. nicht als solcher bezeichnet. Stattdessen werden – ohne dass nach primären und sekundären Endpunkten unterschieden würde – lapidar nur als „main efficacy variables“ die komplette Heilungsrate, Behandlungserfolg und mykologische Heilung aufgeführt. Da die Ergebnisse des primären Endpunktes keine statistische Signifikanz ergaben, ist der Schluss auf Überlegenheit in einem sekundären Endpunkt von vornherein unzulässig. Da das Studiendesign nicht auf die Feststellung bzw. Auswertung der sekundären Endpunkte angelegt ist, müssen Auswertungen in Bezug auf die sekundären Endpunkte stets mit Vorsicht betrachtet werden. Überdies haben sekundäre Endpunkte nicht dieselbe statistische Aussagekraft wie primäre Endpunkte, und es ist wahrscheinlicher, dass positive Änderungen in den sekundären Endpunkten auf Zufall zurückzuführen sind. Die Ergebnisse untersuchter sekundärer Endpunkte können ausschließlich als Hilfe zur Interpretation der primären Studienergebnisse oder als Informationen oder Hinweise für künftige Forschung verwendet werden.
Sekundäre Endpunkte dienen in der medizinischen Wissenschaft u.a. zur Generierung wissenschaftlicher Hypothesen, die gegebenenfalls in geeigneten doppelblinden, placebokontrollierten, randomisierten klinischen Studien verifiziert oder falsifiziert werden müssen.
Folgende Punkte können als mögliche Gründe für die statistisch signifikanten Unterschiede in den sekundären Endpunkten genannt werden:
- Fehlende Compliance der Patienten, v. a. aufgrund der nachträglichen Verlängerung der Studie von ursprünglich zwölf auf 48 Wochen. Alle Patienten, die das Produkt mindestens einmal angewendet haben, wurden in die Auswertung eingeschlossen.
- Drop-Out-Rate: Diese lag laut dem Antwortschreiben von Taurus Pharma auf die ursprüngliche Abmahnung hin angeblich bei null, was jedoch mit Blick auf die lange, von zwölf auf 48 Wochen erweiterte Studiendauer sehr unwahrscheinlich erscheint. Da auch Studienabbrecher in die Intention-To-Treat-Analyse einbezogen wurden, könnte eine höhere Drop-Out-Rate in der Loceryl®-Gruppe im Vgl. zur Ciclopoli®-Gruppe zu einer Verzerrung und so zu schlechteren Ergebnissen geführt haben.
- Mangelhafte Informationen zur Patientenpopulation: Es werden keine Informationen zur Patienten-Anamnese (Erkrankungsdauer, Nagelpilzinfektionen in der Vergangenheit, weitere Erkrankungen wie Diabetes etc.) oder zu einer etwaigen mechanischen Vorbehandlung der betroffenen Nägel (z. B. Schleifen) gegeben, die aber Einfluss auf den Heilungsverlauf nehmen.
- Fehlende Angaben zur etwaigen Durchführung einer systemischen antimykotischen Therapie vor Studienbeginn: Aus dem Prüfplan geht hervor, dass die Patienten bis 30 Tage vor Studienbeginn keine topischen antimykotischen Präparate und während der Studie weder topische noch systemische Antimykotika anwenden durften. Dabei ist jedoch keine Rede von systemischen Antimykotika, z. B. Terbinafin. Gemäß den Angaben im „Clinical Study Report“, der uns auszugsweise im Antwortschreiben von Taurus Pharma auf unsere ursprüngliche Abmahnung übermittelt wurde, wurde eine quantitative Analyse von Terbinafin in Nagelproben der Patienten durchgeführt. Das deutet an, dass alle/bestimmte Patienten gezielt bis zum Studienstart systemisch vorbehandelt wurden.
Galderma Laboratorium GmbH, Georg-Glock_str. 8, 40474 Düsseldorf
Quelle
[1] Iorizzo M et al. Ciclopirox 8% HPCH nail lacquer in the treatment of mild-to-moderate onychomycosis: a randomized, amorolofine controlled study using a blinded evaluator. Skin Appendage Disord 2015;1:134-140




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.