
- DAZ.online
- DAZ / AZ
- DAZ 25/2023
- Safety First bei oraler ...
Arzneimittel und Therapie
Safety First bei oraler Tumortherapie
Wie sich ausgehend von Erlangen und Bonn ein Sicherheitsnetz über Deutschland spannen soll
Seit der Zulassung von Capecitabin (Xeloda®, Prodrug von 5-Fluorouracil), im Jahr 2001 spielen orale Tumortherapeutika eine immer wichtigere Rolle, und zahlreiche neue Wirkstoffe sind auf den Markt gekommen. Dazu gehören Kinase-Inhibitoren wie Osimertinib (Tagrisso®, EGFR-assoziierter Tyrosinkinase-Inhibitor) oder Palbociclib (Ibrance®, Cyclin-abhängiger Proteinkinase-Inhibitor), antineoplastische Arzneistoffe wie Olaparib (Lynparza®, Poly-ADP-Ribose-Polymerase-Inhibitor), Immunmodulatoren wie Lenalidomid (Revlimid®) oder Hormonantagonisten wie Abirateronacetat (Zytiga®) [2].
Wer leitet das Projekt?
Das AMTS-Kompetenzzentrum ausgehend vom Uniklinikum Erlangen, der Universität Bonn und dem Comprehensive Cancer Center Erlangen-EMN (EMN, Europäische Metropolregion Nürnberg) wird die 24 beteiligten Standorte in ganz Deutschland schulen und das Projekt koordinieren.
- Prof. Dr. Frank Dörje, Universitätsklinikum Erlangen, koordiniert das Gesamtprojekt
- Prof. Dr. Ulrich Jaehde, Klinische Pharmazie Universität Bonn, koordiniert die Praxen
- Prof. Dr. Martin F. Fromm, Klinische Pharmakologie und Klinische Toxikologie Universität Erlangen-Nürnberg, koordiniert die Kliniken
Eigenverantwortung birgt Risiken
Für die Patienten eröffnen die oralen Antitumortherapien die Möglichkeit, ihre Arzneimittel zu Hause einzunehmen. Sie sind selbstständiger, Arztbesuche werden seltener, es wird kein intravenöser Zugang benötigt, und die Erkrankung zu behandeln, nimmt weniger Zeit in Anspruch. Auf der anderen Seite birgt die Eigenverantwortung auch Probleme, denn die Therapeutika sind mit einem hohen Risiko behaftet. Die Einnahmeschemata sind komplex, und Interaktionen mit anderen Arzneimitteln wie magensäurehemmenden Wirkstoffen, CYP-Induktoren oder CYP-Inhibitoren sowie mit Nahrungsmitteln wie Alkohol oder Grapefruit können auftreten. Beispielsweise führt die gleichzeitige Gabe des Protonenpumpen-Inhibitors Omeprazol mit Dasatinib zu einer 43%igen Reduktion der Plasmakonzentration. Bei circa 50% der oralen Onkologika müssen Hinweise zu Wechselwirkungen mit Nahrungsmitteln beachtet werden. Außerdem ist die Adhärenz bei einem Teil der Patienten unzureichend und es besteht die Gefahr, dass Angehörige der Krebspatienten oder Pflegepersonal versehentlich mit den Zytostatika in Kontakt kommen. Auch das Nebenwirkungsmanagement erweist sich als schwieriger, da die Kontakte zum Arzt seltener stattfinden [2, 3].
Erfolge in AMBORA-Studie verzeichnet
Ein therapiebegleitendes Schulungs- und Betreuungskonzept könnte eine Möglichkeit sein, Patienten zu unterstützen und die Arzneimitteltherapiesicherheit zu verbessern. Dass das gelingen kann, zeigten vergangene Studien, so auch die AMBORA-Studie (Arzneimitteltherapiesicherheit bei der Behandlung mit neuen oralen Antitumorwirkstoffen), die von 2017 bis 2020 durchgeführt wurde. An dieser prospektiven, randomisierten, multizentrischen Studie nahmen 202 Patientinnen und Patienten teil. Durch eine verbesserte Betreuung (Medikationsmanagement, Nebenwirkungsmanagement und Adhärenzförderung) wurden die arzneimittelbezogenen Probleme im Zusammenhang mit den Antitumor-Wirkstoffen um 34% (3,85 vs. 5,81 [Mittelwert], p < 0,001) reduziert, und die Patientenzufriedenheit, die mit einem Fragebogen erfasst wurde, war in der Interventionsgruppe höher (91,6 vs. 74,4 [Mittelwert], p < 0,001) [4].
Stärkung der Kompetenz vor Ort
Die AMBORA-Studie wurde regional in Erlangen an verschiedenen Zentren durchgeführt. Das Projekt Safety First soll nun zeigen, dass das Konzept der intensivierten klinisch-pharmazeutischen Betreuung auch national greift. Dazu sollen bundesweit an 24 Standorten Tandems gebildet werden: Teams aus onkologischen Praxen mit öffentlichen Apotheken sowie Teams aus Kliniken/Medizinischen Versorgungszentren mit Krankenhausapotheken sollen Patientinnen und Patienten zu ihrer oralen Tumortherapie schulen und betreuen. Ein sogenanntes AMTS-Kompetenzzentrum koordiniert das gesamte Projekt (s. Kasten „Wer leitet das Projekt?“) und schult die teilnehmenden Tandems aus Ärzten und Apothekern in zwei Blöcken. Zunächst darüber, wie die Studie abläuft, wie die Daten strukturiert erhoben und dokumentiert werden. Im zweiten Block dazu, wie die Interventionen durchzuführen sind, sodass sie an den Standorten etabliert werden können. Sind die Tandems geschult, sollen die Patienten eine intensivierte Betreuung erhalten und davon profitieren. Die Leistungen umfassen vier Kernelemente:
- Die Patienten werden zu ihren oralen Tumortherapeutika geschult.
- Die Adhärenz der Patienten wird optimiert.
- Die Patienten erhalten ein Medikationsmanagement.
- Ein Nebenwirkungsmanagement wird mit den Patienten durchgeführt.
Start einer Therapie als Einschlusskriterium
Im Januar 2024 soll mit der intensiven Betreuung des ersten Probanden gestartet, insgesamt sollen 600 Teilnehmer rekrutiert werden. Der Beginn einer Therapie mit einem oralen Antitumorwirkstoff ist das zentrale Einschlusskriterium, um an Safety First teilnehmen zu können. An welcher Tumorart die Teilnehmerinnen und Teilnehmer erkrankt sind, ist nicht relevant. Die Patienten sollen bis zu fünf Gespräche erhalten: Darunter ein Initialgespräch (Woche 0), bei Änderungen zwei Kurzgespräche (Woche 1, 8) und zwei Folgegespräche (Woche 4, 12). Treten Komplikationen wie arzneimittelbezogene Probleme auf, ist die interprofessionelle Zusammenarbeit zwischen Ärzte- und Apothekerschaft gefragt, um die pharmazeutischen bzw. pharmakologischen Empfehlungen abzugleichen. Patienten der Kontrollphase durchlaufen die übliche klinische Routine, ohne dass die genannten Interventionen durchgeführt werden (außer es treten ethische Bedenken auf). Für sie kommen nur Termine zur Erhebung der Daten hinzu, anhand derer der Status quo ermittelt wird. Dokumentiert wird schriftlich und elektronisch (eCRF, elektronische Case Report Form) [1].
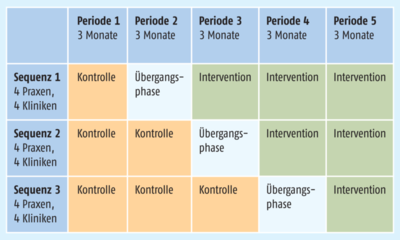
Die Studie soll Cluster-randomisiert im Stepped-Wedge-Design ablaufen. Jeder Standort startet mit einer Kontrollphase und tritt im Anschluss zu unterschiedlichen Zeiten in die Interventionsphase über. Der Zeitraum, über den sich die Kontrollphase im Vergleich zur Interventionsphase erstreckt, ist dabei in den Gruppen unterschiedlich lange (s. Abb.). Zwischen Kontroll- und Interventionsphase ist eine Übergangsphase geschaltet. Insgesamt läuft die Studie über fünf Perioden ab, eine Periode ist drei Monate lang und entspricht der Zeit, die ein Patient betreut wird. Das Stepped-Wedge-Design ermöglicht es jedem Standort, sowohl die Kontroll- als auch die Interventionsphase zu durchlaufen. So hat jeder Standort die Möglichkeit, sich zu vernetzen und ein interprofessionelles Betreuungskonzept aufzubauen, von dem zukünftig Patientinnen und Patienten mit oraler Tumortherapie profitieren könnten [1].
Abb.: Im Stepped-Wedge-Design wird die Studie Safety First ablaufen. Teilnehmen sollen insgesamt 600 Patientinnen und Patienten, die mit einer oralen Tumortherapie begonnen haben. Patienten in der Kontrollphasen durchlaufen die übliche klinische Routine. In der Interventionsphase erhalten die Patienten eine intensivierte Betreuung bestehend aus einem Medikationsmanagement, einer Adhärenzoptimierung und einem Nebenwirkungsmanagement.
Was soll erreicht werden?
Der primäre Studienendpunkt von Safety First setzt sich aus vier Teilzielen zusammen: Schwerwiegende Nebenwirkungen, Behandlungsabbrüche, ungeplante Hospitalisierungen und Todesfälle sollen um mindestens 25% reduziert werden. Ziel ist es, die Sicherheit einer oralen Tumortherapie zu erhöhen, die Zusammenarbeit von Ärzten und Apothekern zu stärken sowie das Wissen der Patientinnen und Patienten zu ihrer Therapie zu verbessern [1]. Wir sprachen mit Studienleiter Prof. Dr. Frank Dörje auf S. 30 in dieser DAZ über das Projekt. |
Literatur
[1] Pressekonferenz „Modellprojekt zur Implementierung und Evaluierung einer Interventionsstrategie zur Verbesserung der AMTS bei Patienten und Patientinnen unter oraler Tumortherapie“, 28. April 2023
[2] Schlichting K, Dürr P, Dörje F, Fromm MF. Arzneimitteltherapiesicherheit bei neuen oralen Antitumortherapeutika. Dtsch Arztebl 2019;116:775-782, doi: 10.3238/arztebl.2019.0775
[3] Schlichting K, Dürr P, Cuba L, Fromm MF, Dörje F. Die AMBORA-Studie: Ein Versorgungsforschungsprojekt zur Verbesserung der Arzneimitteltherapiesicherheit (AMTS) bei mit neuen oralen Antitumor-Wirkstoffen behandelten Patienten. Information des Uniklinikums Erlangen, Stand: 2021
[4] Dürr P, Schlichting K, Kelz C et al. The Randomized AMBORA Trial: Impact of Pharmacological/Pharmaceutical Care on Medication Safety and Patient-Reported Outcomes During Treatment With New Oral Anticancer Agents. J Clin Oncol 2021;39(18):1983-199



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.