
- DAZ.online
- News
- Politik
- Neue Warnhinweise auf ...
Analgetika-Warnhinweis-Verordnung
Neue Warnhinweise auf Schmerzmitteln im Bundesrat
Berlin - 27.04.2018, 16:30 Uhr
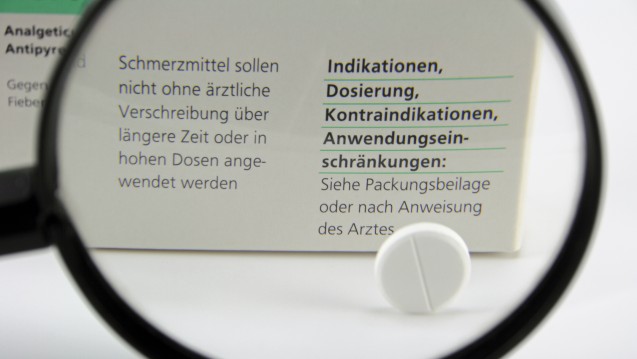
Künftig sollen bei OTC-Schmerzmitteln schon auf der Packung deutliche Warnhinweise zur Einnahmedauer zu sehen sein. Doch es gibt großzügige Übergangfristen. (Foto: Schlierner / stock.adobe.com)
OTC-Schmerzmittel müssen künftig einen Warnhinweis auf der Verpackung tragen, der Verbraucher mahnt, das Arzneimittel nicht länger ohne ärztlichen Rat einzunehmen, als in der Packungsbeilage vorgeschrieben. Dies schreibt die Analgetika-Warnhinweis-Verordnung vor, deren Entwurf das Bundesgesundheitsministerium jetzt dem Bundesrat zugeleitet hat.
Das Bundesministerium für Gesundheit (BMG) hat dem Bundesrat seinen Entwurf einer Analgetika-Warnhinweis-Verordnung zugeleitet. Dort wird sich nun der Gesundheitsausschuss mit der Verordnung befassen. Anschließend muss das Bundesratsplenum noch zustimmen.
Doch worum geht es in der neuen Verordnung? Um Arzneimittel gegen Schmerzen und Fieber mit den Wirkstoffen Acetylsalicylsäure, Diclofenac, Ibuprofen, Naproxen, Paracetamol, Phenazon oder Propyphenazon. Sie gibt es rezeptfrei in Apotheken – gefahrlos ist ihre Einnahme jedoch nicht. Ohne ärztlichen Rat dürfen sie nur drei oder vier Tage angewendet werden, sonst drohen erhebliche Nebenwirkungen. So steht es in den entsprechenden Packungsbeilagen.
Der frühere Bundesgesundheitsminister Hermann Gröhe (CDU) hat bereits vor zwei Jahren für mehr Patientensicherheit sorgen wollen und den ersten Verordnungsentwurf einer Analgetika-Warnhinweis-Verordnung vorgelegt. Ausgangspunkt war und ist, dass Verbraucher die in Packungsbeilagen genannten Warnhinweise und Kontraindikationen von rezeptfreien Analgetika nicht immer ausreichend beachten. Eine Studie des Robert-Koch-Instituts hat vielmehr gezeigt, dass in Deutschland von denjenigen, die rezeptfreie Analgetika länger als vier Tage anwenden, ein Fünftel der Frauen und fast ein Drittel der Männer die Anwendungsempfehlungen nicht kennen. Daher soll schon auf der Packung vor einer zu langen eigenmächtigen Anwendung gewarnt werden.
Zweijährige Entstehungsgeschichte
Der erste Verordnungsentwurf erntete reichlich Kritik seitens der betroffenen Verbände – auch der ABDA. Die Warnhinweise waren sehr kleinteilig, die Übergangsfristen kurz. Das Ministerium besserte daraufhin nach und legte im August 2017 einen überarbeiteten und entschärften Entwurf vor. Dieser schaffte in der vergangenen Legislaturperiode allerdings nicht mehr den Weg in den Bundesrat, sondern geriet in die Warteschleife. Doch nun ist die Hürde zur Länderkammer genommen. Dabei hat sich der jetzt vorliegende Entwurf seit dem vergangenen Sommer nicht mehr verändert.
Demnach dürfen die fraglichen OTC-Analgetika nach Ablauf der Übergangsfrist künftig nur noch dann in Verkehr gebracht werden, wenn auf der äußeren Umhüllung oder, sofern nur ein Behältnis vorhanden ist, auf dem Behältnis der Warnhinweis steht:
„Bei Schmerzen oder Fieber ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgeschrieben!“
Für Defektur- oder Rezepturarzneimittel gibt es einen modifizierten Warnhinweis:
„Bei Schmerzen oder Fieber ohne ärztlichen Rat nicht länger anwenden als vom Apotheker oder von der Apothekerin empfohlen!“
Diese Warnhinweise sind in gut lesbarer Schrift dauerhaft auf der Vorderseite der äußeren Umhüllung oder, sofern nur ein Behältnis vorhanden ist, auf dem Behältnis anzubringen.
Apotheken dürfen bis zum Verfall abverkaufen
Die Übergangsfristen hat das BMG mittlerweile verlängert: Der neue Entwurf bestimmt, dass der pharmazeutische Unternehmer Arzneimittel mit den betroffenen Wirkstoffen noch bis zum 24. auf die Verkündung folgenden Kalendermonat unverändert in Verkehr bringen dürfen – also auch ohne den Warnhinweis. Für Großhändler und Apotheken gibt es keine solche Frist. Hier zählt also das Verfallsdatum. Für die Rezeptur- oder Defekturarzneimittel gilt, dass diese ohne den Warnhinweis noch bis zum 12. auf die Verkündung folgenden Kalendermonat in Verkehr gebracht werden dürfen. Damit wolle man wirtschaftliche Verluste minimieren, heißt es in der Begründung des Verordnungsentwurfs.
Mit einem Inkrafttreten der Verordnung ist frühestens am 1. Juli 2018 zu rechnen. Voraussichtlich wird sich das Bundesratsplenum bei seiner Sitzung am 8. Juni mit dem Thema befassen. Erfolgt dann die Veröffentlichung im Bundesanzeiger im Laufe des Juni, ist der 1. Juli Starttag. Doch selbst dann bleibt ausreichend Zeit für eine Umstellung. Nach Ablauf der Übergangsfrist sollten Apotheken aber aufpassen: Die Missachtung der neuen Vorschriften kann als Ordnungswidrigkeit mit einer Geldbuße bis zu 25.000 Euro geahndet werden.
BAH: Sinn erschließt sich nicht, aber...
Dr. Elmar Kroth, Geschäftsführer Wissenschaft beim Bundesverband der Arzneimittel-Hersteller e.V. (BAH), begrüßt die Entschärfung gegenüber dem ersten Entwurf. Allerdings: „Den Sinn des geplanten Warnhinweises ‚Bei Schmerzen oder Fieber ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgeschrieben‘ können wir nach wie vor nicht so recht erkennen, da Patienten ja auch bisher schon angehalten waren, so zu verfahren. Zudem unterliegen die betroffenen Arzneimittel ja der Apothekenpflicht, womit der Patient immer die Möglichkeit einer kompetenten Beratung hat.“ Immerhin seien die Verlängerung der ursprünglich sehr kurzen Fristen „akzeptable Regelungen“.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.