
- DAZ.online
- News
- Pharmazie
- Migräne-Antikörper ...
Trotz Mängeln beim Hersteller
Migräne-Antikörper Fremanezumab erhält nun doch US-Zulassung
Stuttgart - 18.09.2018, 11:30 Uhr
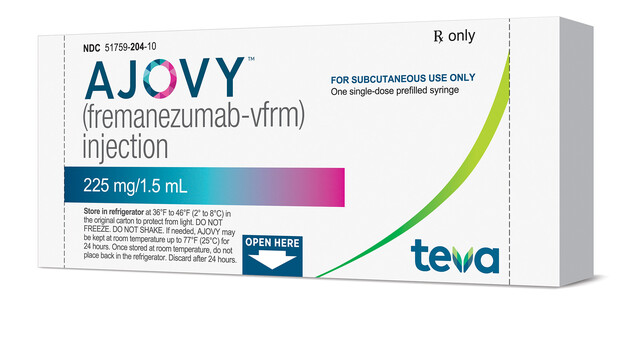
Nach Erenumab wurde in den USA ein weiterer Antikörper zur Migräne-Prophylaxe zugelassen: Fremanezumab unter dem Markennamen Ajovy™. ( r / Foto: Business Wire)
Am vergangenen Freitag gab Teva Pharmaceutical Industries Ltd. bekannt, dass die US-amerikanische Arzneimittelbehörde FDA einen neuen Migräne-Antikörper unter dem Markennamen Ajovy™ zur Prävention von Migräne bei Erwachsenen zugelassen hat. Eine Woche zuvor hatten Börsenbeobachter noch eine erfolgreiche Zulassung angezweifelt. Grund dafür waren Mängel beim koreanischen Wirkstoffhersteller Celltrion.
Laut der Nachrichtenagentur Reuters hatte Teva in den USA schon im Juni 2018 auf die Zulassung ihres Migräne-Antikörpers Ajovy™ durch die US-amerikanische Arzneimittelbehörde FDA gehofft. Die US-Behörde äußerte aber Bedenken im Zusammenhang mit der Produktion des Wirkstoffs in Südkorea. Nun gab Teva in einer Pressemitteilung vom vergangenen Freitag die erfolgreiche US-Zulassung von Fremanezumab bekannt.
Der humanisierte monoklonale Antikörper Fremanezumab-vfrm bindet an CGRP (calcitonin gene-related peptide) und kann vierteljährlich oder monatlich verabreicht werden. CGRP spielt im pathophysiologischen Geschehen der Migräne eine maßgebliche Rolle. Die CGRP-These wird dadurch erhärtet, dass Injektionen des Neuropeptids bei Migränikern Anfälle auslösen können. Ajovy™ ist laut Teva die erste und einzige anti-CGRP-Therapie zur Migräne-Prävention, die vierteljährlich (675 mg) oder monatlich (225 mg) injiziert werden kann. Ebenfalls gegen CGRP gerichtet und in der EU bereits zur Migräneprophylaxe zugelassen ist der Antikörper Erenumab (Aimovig®) von Novartis. Er wird monatlich injiziert.
Mehr zum Thema

Antikörper zur Migräne-Prophylaxe
Fremanezumab bessert chronische Migräne
Zur Prophylaxe
Migräne-Antikörper Erenumab in der EU zugelassen

Migräne-Prophylaxe
FDA erteilt Migräne-Antikörper Erenumab die Zulassung
Teva-Manager zeigten sich eine Woche vor der erfolgreichen FDA-Zulassung zuversichtlich, dass diese auch gelingen würde. Laut dem Nachrichtenportal FiercePharma bestand aber auch durchaus Anlass zur Sorge. Denn es gab wohl Zweifel, dass es tatsächlich zur Zulassung kommen würde. Grund dafür waren Mängel beim Wirkstoffhersteller Celltrion in Südkorea.
Probleme mit dem koreanischen Wirkstoffhersteller
So soll ein Börsenbeobachter von Credit Suisse noch eine Woche vor der erfolgreichen FDA-Zulassung von Fremanezumab seine Klienten darüber informiert haben, dass es scheinbar ungelöste Probleme beim koreanischen Wirkstoffhersteller gebe. Im Juli waren bei einer Kontroll-Inspektion durch die FDA acht Mängelbeobachtungen in einem 483-Formular der FDA festgehalten worden. Zu dieser Inspektion war es gekommen, weil zuvor bereits ein „Warning Letter“ von der FDA an den koreanischen Wirkstoffhersteller adressiert worden war.
Zwar habe sich der „Warning-Letter“ nicht auf den Produktionsbereich von Fremanezumab bezogen, heißt es, – dennoch habe die Inspektion im Juli im Anschluss an den „Warning-Letter“ als Vorabinspektion vor der Zulassung des Migräne-Antikörpers gedient: „Es ist eine riesige Anlage, aber der Teil, der inspiziert wurde, war der Teil in dem abgefüllt und verpackt wird, nicht der, in dem Wirkstoffe hergestellt werden“, wurde Teva’s CEO Kåre Schultz zitiert, „Aber regulatorisch betrachtet ist es derselbe Standort.“ Man habe mit der weiteren Inspektion klären wollen, ob die Zulassung von Fremanezumab weiterhin erfolgen könne. Dies war nun offenbar der Fall, auch wenn in dem 483-Formular der FDA einige Mängel domkumentiert wurden: In den acht festgehaltenen Beobachtungen kommt unter anderem zum Ausdruck, dass zum Beispiel Glasbruch und der Umgang damit ein Problem des koreanischen Wirkstoffherstellers darstellen. Zudem sei das Personal für seine Tätigkeiten nicht ausreichend ausgebildet, wie es heißt.
Konkurrenz in der Migräne-Prävention
Ajovy™ soll laut Reuters für 575 Dollar pro Monat erhältlich sein. Zum gleichen Preis bieten die Konkurrenten Amgen und Novartis ihr Migräne-Medikament Aimovig® seit Mai auf dem US-Markt an. Ajovy™ sei für die wirtschaftliche Erholung von Teva sehr wichtig. Denn der weltgrößte Generika-Hersteller sei hoch verschuldet. So soll die Aktie in den vergangenen drei Jahren rund zwei Drittel ihres Wertes eingebüßt haben. Ein weiterer Hoffnungsträger von Teva soll Austedo™ sein, eine experimentelle Behandlung der Huntington-Krankheit.
Mehr zum Thema

Chorea Huntington
EMA: Fokus auf neuem Huntington-Wirkstoff
Als Ziel gelte es jetzt, Fremanezumab im Migräne-Markt zu etablieren, bevor Galcanezumab von Eli Lilly oder Eptinezumab von Alder Biopharmaceuticals auf den Markt kommen. Deshalb hätte jede weitere Verzögerung der Zulassung von Fremanezumab für Teva weitreichende Konsequenzen bedeutet. In der EU hat die europäische Arzneimittelagentur EMA bislang nur den Antrag zur Zulassung für Fremanezumab angenommen, das gab Teva im Februar 2018 bekannt.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.