
- DAZ.online
- News
- Pharmazie
- Opioid-Sucht: EU-...
CHMP
Opioid-Sucht: EU-Zulassungsempfehlung für Buprenorphin-Implantat
Berlin - 29.04.2019, 14:00 Uhr
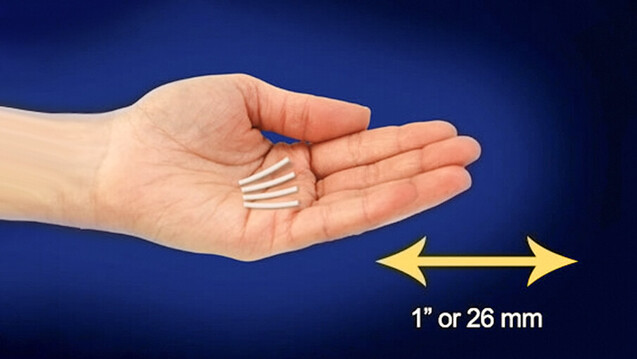
Die neue Subsitutionsmethode Sixmo soll stabile Patienten und Apotheker entlasten. ( r / Foto: Probuphine)
Implantat wirksamer als Sublingualtabletten
Die Wirksamkeit und Sicherheit des Implantats wurden in drei Zulassungsstudien mit insgesamt 626 erwachsenen Patienten untersucht. In einer der drei Studien mit 177 Opioidabhängigen, die von ihren behandelnden Ärzten als klinisch stabil eingestuft wurden, wurde die sublinguale mit der subdermalen Anwendung verglichen. Die Ergebnisse zeigten, dass 96,4 Prozent der Patienten in der Sixmo-Gruppe auf die Behandlung ansprachen, verglichen mit 87,6 Prozent der Patienten, die mit sublingualem Buprenorphin behandelt wurden. Auch die Abstinenzraten für Opioid-Beikonsum waren unter dem Implantat höher als unter der oralen Darreichungsform (85,7 versus 71, 9 Prozent).
Mehr zum Thema

Einfachere Opioidsubstitution mit Buvidal
Buprenorphin-Depot: nur einmal pro Woche oder Monat
Weitere Sicherheitsstudie gefordert
Die häufigsten unerwünschten Ereignisse im Zusammenhang mit diesem Arzneimittel waren Kopfschmerzen, Verstopfung und Schlaflosigkeit, welche auf den Wirkstoff zurückzuführen sind. Hinzu kamen lokale Nebenwirkungen aufgrund der Anwendung wie beispielsweise Schmerzen, starker Juckreiz und Hämatome an der Implantationsstelle. Der Antragsteller muss nun eine zusätzliche Studie durchführen, um die Risiken zu evaluieren, mit der Insertion und Entfernung der Implantate verbunden sind.
November 2018: Erstes Depot-Buprenorphin erhält EU-Zulassung
Mit dem Depot-Buprenorphin Buvidal® ist bereits eine nur wöchentliche oder monatliche Gabe von Buprenorphin möglich geworden. Die EU-Zulassung für Buvidal® erhielt Hersteller Camurus bereits im November 2018, seit Februar ist das Depot-Buprenorphin auch in Deutschland verfügbar. Buvidal® enthält Buprenorphin auf Basis einer Fluid-Crystal®-Technologie, die Verabreichung erfolgt ausschließlich ärztlich als subkutane Injektion.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.