Wie wirkt Remdesivir?
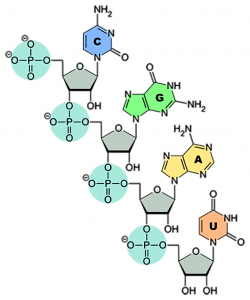
Remdesivir zählt zu den Virostatika. Der Arzneistoff hemmt die Vermehrung bestimmter Viren – unter anderem Ebola- und Coronaviren –, indem Remdesivir das für die Vermehrung erforderliche Enzym, die virale RNA-Polymerase, blockiert. In SARS-CoV-2 liegt die Erbinformation – anders als beim Menschen – in Form von Ribonukleinsäure (RNA) vor. Bei der RNA handelt es sich um eine lange Zucker-Phosphat-Kette, an die einzelne Nukleinbasen – nämlich Adenin, Cytosin, Guanin und Uracil – angeknüpft sind (siehe Abb.). Als Zuckerbaustein nutzt die RNA Ribose, daher auch der Name Ribonukleinsäure.
Will sich ein Virus vermehren, muss es zunächst seine Erbinformation für die Nachfolgegeneration verdoppeln, dabei hilft die viruseigene RNA-Polymerase. Sie nutzt die vorhandene RNA als Vorlage und knüpft eine neue Kette, wieder bestehend aus Zucker-Phosphat und daran angehängt Adenin, Cytosin, Guanin oder Uracil. Remdesivir ähnelt der Nukleinbase Adenin und wird so als „falscher“ Baustein in die neue RNA des „Virus-Nachkommens“ eingebaut. Die Folge: Die RNA- und folglich die Virus-Vermehrung ist gestört.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.