
- DAZ.online
- News
- Pharmazie
- UK lässt ...
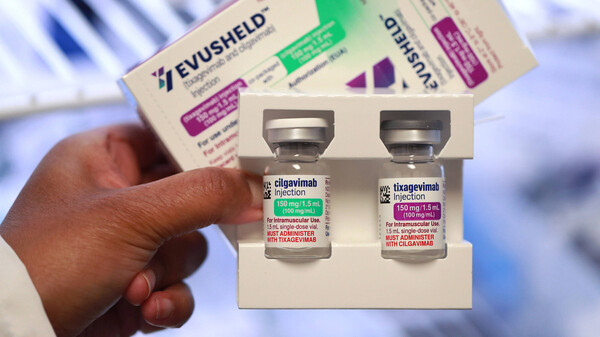
Tixagevimab/Cilgavimab in Evusheld
UK lässt prophylaktisches Antikörperduo zu
Stuttgart - 21.03.2022, 14:30 Uhr
In den USA und dem Vereinigten Königreich gibt es die Präexpositionsprophylaxe mit Tixagevimab/Cilgavimab bereits, die EMA prüft die Antikörperkombination derzeit noch. (x / Foto: Kateryna_Kon / AdobeStock)
Tixagevimab/Cilgavimab soll vor einer Infektion mit COVID-19 schützen und hat nun als Präexpositionsprophylaxe im Vereinigten Königreich die Zulassung erhalten, in der EU hat AstraZeneca die Zulassung bereits beantragt. Allerdings dürfen das prophylaktische Antikörperduo von AstraZeneca nur ausgewählte Menschen bekommen.
Antikörper zur Behandlung von Menschen mit COVID-19 gibt es mittlerweile – besser wäre jedoch, wenn Hochrisikopatienten eine SARS-CoV-2-Infektion erst gar nicht ereilt. Stichwort: Präexpositionsprophylaxe. Die britische Arzneimittelbehörde MHRA (Medicines and Healthcare Products Regulatory Agency) hat am 17. März 2022 im Vereinigten Königreich das Antikörperduo Tixagevimab/Cilgavimab in Evusheld® von AstraZeneca zur Vorbeugung von COVID-19 zugelassen. Die FDA in den USA hatte Evusheld® bereits am 8. Dezember 2021 die Zulassung erteilt.
Erwachsene mit unzureichender Impfantwort
Indiziert ist Evusheld ausschließlich bei Erwachsenen, bei denen davon ausgegangen werden muss, dass sie auf eine Corona-Impfung nur unzureichend Antikörper bilden und ihr Immunsystem nicht ausreichend auf eine Impfung reagiert. Möglich ist eine Präexpositionsprophylaxe mit Tixagevimab/Cilgavimab außerdem nach allergischen Reaktionen auf eine erfolgte Corona-Impfung. Zudem sollten die Evusheld-Empfänger bei Antikörpergabe weder akut mit SARS-CoV-2 infiziert sein noch Kontakt zu einem Infizierten gehabt haben.
Mehr zum Thema
Tixagevimab/Cilgavimab bei unzureichendem Impfschutz
USA lassen präventives Antikörper-Duo zu

Rolling-Review-Verfahren
Vorbeugung von COVID-19 mit Tixagevimab und Cilgavimab

Nur für Covid-19-Risikopatient:innen
Casirivimab und Imdevimab: WHO empfiehlt erste Präventivtherapie gegen COVID-19
Beide Antikörper in Evusheld – Tixagevimab und Cilgavimab – richten sich gegen das Spikeprotein von SARS-CoV-2, binden dort aber an unterschiedliche Stellen. Dies soll verhindern, dass SARS-CoV-2 über sein Spikeprotein an menschliche Zellen bindet und diese infiziert. Ursprünglich gewonnen wurden die humanen Antikörper von genesenen COVID-19-Patienten. AstraZeneca hat die Antikörper sodann optimiert – ihre Halbwertszeit verlängert, sodass die Wirkdauer von Evusheld dreifach höher als bei natürlichen Antikörpern ist. Zudem reduzierte AstraZeneca für eine bessere Verträglichkeit die Fc-Rezeptorbindung an das Komplement C1q. Dadurch soll die antikörperabhängige Verschlimmerung der Erkrankung verhindert werden. Denn teilweise können virusspezifische Antikörper eine Erkrankung auch verschlechtern, statt sie zu bessern.
Antikörperschutz über sechs Monate
Die für eine Präexpositionsprophylaxe infrage kommenden Menschen erhalten einmalig je 150 mg Tixagevimab und 150 mg Cilgavimab, wobei die intramuskulären Injektionen separat und aufeinanderfolgend verabreicht werden. In Studien konnte die Antikörperkombination verglichen mit Placebo das relative Risiko, symptomatisch an COVID-19 zu erkranken, um 77 Prozent reduzieren. Ausgewertet wurden Daten von 5.172 Teilnehmer:innen, die entweder Evusheld (3.441) oder Kochsalzlösung (1.731) erhalten hatten. In der Evusheld-Gruppe erkrankten acht Teilnehmer:innen symptomatisch an Corona, in der Placebogruppe waren es 17. Datenerhebung war nach 83 Tagen. Allerdings bestätigen auch spätere Auswertungen, eine schützende Wirkung nach sechs Monaten. In der Antikörpergruppe erkrankte kein Patient schwer oder verstarb, unter Placebo kam es hingegen zu fünf schweren COVID-19-Verläufen und zwei coronabedingten Todesfällen.
Wirksamkeit bei Omikron?
Wie sieht es mit der Wirksamkeit bei Omikron aus? AstraZeneca räumt hier die Möglichkeit einer höheren Dosierung ein: „Bei einigen SARS-CoV-2-Varianten (z. B. Omicron BA.1, Omicron BA.1.1) kann eine höhere Dosis von 600 mg der Antikörperkombination, d. h. 300 mg Tixagevimab und 300 mg Cilgavimab, angemessener sein“, teilt das Unternehmen mit und zitiert damit Professor Sir Munir Pirmohamed, Vorsitzender der Humanarzneimittelkommission beim MHRA. Derzeit gibt es laut MHRA jedoch „noch nicht genügend Daten, um zu wissen, wie wirksam Evusheld gegen Omikron ist oder wie lange seine Wirkung gegen diese Variante anhält“. Gemeinsam mit AstraZeneca wolle man dies noch ermitteln.
Auch in der EU könnte Evusheld bald verfügbar werden: AstraZeneca hat die Zulassung bei der Europäischen Arzneimittelbehörde EMA bereits beantragt. Der Ausschuss für Humanarzneimittel (CHMP) prüft das Arzneimittel seit 15. März 2022. AstraZeneca zufolge hat das Bundesministerium für Gesundheit (BMG) bereits ein Kontingent des Antikörperduos geordert.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.