
- DAZ.online
- DAZ / AZ
- DAZ 48/2008
- Männer im ...
Andrologie
Männer im Testosterondefizit
Das Ganze verwundert nicht, denn die Lebensumstände in den Industrienationen haben sich erheblich geändert: das Ausmaß an körperlicher Aktivität hat abgenommen, gleichzeitig besteht ein Überangebot an hochkalorischer, fetthaltiger Nahrung. Die Folge: immer mehr Menschen sind übergewichtig. Die Akkumulation von viszeralem Fett als einem endokrin hochaktiven Organ stellt hier ein besonderes Problem dar, das sich als komplexe pathologische Entität mit Störungen des Blutdrucks, des Fettstoffwechsels und der Glucosetoleranz manifestiert. Es wird als metabolisches Syndrom bezeichnet. Das viszerale Fett schüttet unter anderem inflammatorische Zytokine, pro-koagulative Substanzen sowie das Angiotensin-Aldosteron-System aktivierende Stoffe aus. Das führt dazu, dass Menschen mit dem metabolischen Syndrom ein dreifach erhöhtes Risiko für klinisch manifeste kardiovaskuläre Ereignisse oder Schlaganfälle haben. Das Risiko zur Entwicklung eines Diabetes mellitus Typ 2 ist fünffach erhöht [1–3].
Die International Diabetes Federation hat die Kriterien zur Diagnose des metabolischen Syndroms angepasst und den Bauchumfang als Maß des viszeralen Fettgewebes als zentralen Faktor identifiziert. Dabei ist als Grenzwert für europäische Männer ein Bauchumfang von 94 cm angegeben worden (s. Kasten).
Metabolisches SyndromNeudefinition der International Diabetes Federation: Bauchumfang über 94 cm für Männer plus zwei der folgenden vier Faktoren:
|
Testosteron, Adipositas, metabolisches Syndrom
Bei Männern ist die zentrale Adipositas als Schlüsselkomponente des metabolischen Syndroms häufig mit einem Testosteronmangel assoziiert. Entsprechend zeigen longitudinale epidemiologische Studien, dass ein Testosterondefizit einen unabhängigen Prädiktor für die Entwicklung eines metabolischen Syndroms bei Männern darstellt; auch umgekehrt stellt ein metabolisches Syndrom ein Risiko für die Entwicklung eines Testosterondefizits dar. Dies ist offenbar nicht nur bei Männern mit einem erhöhten Body-Mass-Index der Fall, sondern auch bei normalgewichtige Personen mit einem erhöhten Bauchumfang [4 – 6]. Besonders betroffen sind vor allem ältere, jedoch auch zunehmend jüngere Männer. Da die Inzidenz des Hypogonadismus mit dem Alter zunimmt, taucht der Begriff "Andropause" gelegentlich in Publikationen auf: er spielt auf die Menopause an und suggeriert, dass die Sezernierung gonadaler Steroide beim Mann ähnlich wie bei der Frau rasch und unwiderruflich sistiert. Bei älteren Männern wird häufig die Hormonkonstellation erniedrigter Spiegel von Testosteron in Zusammenhang mit niedrig normalen, also inadäquaten, Spiegeln von Luteinisierungs-Hormon (LH) angetroffen. Die Funktion der Leydig-Zellen ist eingeschränkt und der hypothalamisch-hypophysäre Pulsgenerator ist gestört. Man findet eine Degeneration der Ordnung und Amplitude von LH-Pulsen bei gleichzeitiger Zunahme der Frequenz. Es gibt deutliche Hinweise dafür, dass dieses Phänomen mit dem Alterungsprozess, aber auch mit dem Gesundheitszustand des Mannes, ganz besonders mit Faktoren des metabolischen Syndroms [7] verknüpft ist: die Bezeichnung "Altershypogonadismus" ist daher meist zutreffend. Weil auch jüngere Männer das oben beschriebene Risikoprofil der viszeralen Adipositas aufweisen können, sollte besser von einem Testosterondefizit-Syndrom gesprochen werden, das in diesem Fall weder rein primär oder sekundär, sondern gemischter Natur ist. Einen Imperativ zur Substitutionstherapie stellen aber weder die Bezeichnung noch die Hormonkonstellation dar. Sie sind vielmehr eine notwendige Bedingung, die durch die entsprechende Symptomatik und den Ausschluss von Kontraindikationen komplettiert werden muss.
Neue Erkenntnisse in der Pathophysiologie des Testosteronmangels sowie der Pharmakogenetik [8, 9] legen nahe, dass eine labortechnisch definierte Grenze für das Testosterondefizit nicht existiert: vielmehr lässt sich ein Testosterondefizit als absoluter oder relativer Mangel an Androgenwirkung definieren, der zu einer Symptomatik führt, die dafür als typisch beschrieben ist – und zwar unabhängig vom Alter [10].
Eine rasche Abnahme der Androgenproduktion bei gesunden Männern kann generell allerdings nicht beobachtet werden, die Verarmung an Sexualhormonen ist vielmehr ein langsamer, interindividuell sehr unterschiedlich ablaufender Prozess, der durch vielfältige somatische, psychische und äußerliche Einflüsse moduliert wird: dazu gehört eben in immer stärkerem Maße auch das metabolische Syndrom. Eine Umkehrung dieses pathogenetischen Kreislaufs durch eine externe Testosteronsubstitution wird daher physiologisch sinnvoll.
Pathophysiologische Grundlagen
Entsprechende Korrelate zeigen sich in vitro darin, dass mesenchymale pluripotente Stammzellen, die die Möglichkeit zur Weiterentwicklung entweder in Adipozyten oder Myozyten besitzen, im Zustand des Androgenmangels den Weg in die adipogene Linie einschlagen. Dagegen fördert eine Testosterongabe dosisabhängig die Differenzierung in Muskelzellen [11]. Entsprechend nimmt unter Testosterongabe bei hypogonadalen Männern das viszerale Fett ab und die Muskelmasse zu. Das konnte durch Untersuchungen in der weltweit größten Placebo-kontrollierten Studie mittels Testosterongel belegt werden [12].
Testosteron bessertInsulinsensitivität
Es ist daher nicht überraschend, dass sich unter der Gabe von Testosteron auch die Insulinsensitivität bessert, denn diese ist sowohl maßgeblich von der mitochondrialen Funktion innerhalb der Muskelzellen als auch von Androgenrezeptor-vermittelten Prozessen in Fettzellen abhängig. Bei Männern mit einem Diabetes mellitus Typ 2 konnte daher in einer Placebo-kontrollierten Studie mit intramuskulär injiziertem Testosteron eine signifikante Besserung der Insulinresistenz und der glykämischen Kontrolle sowie eine Abnahme des viszeralen Fettanteils und eine Minderung der Dyslipidämie dargestellt werden [13].
Dies wird durch Langzeitbeobachtungen von hypogonadalen Männern, die über mehrere Jahre Testosteronundekanoat als intramuskuläres, lang wirksames Depot erhielten, unterstützt: Fettstoffwechsel und Blutdruckprofile zeigten signifikante Änderungen in Richtung einer Normalisierung [14].
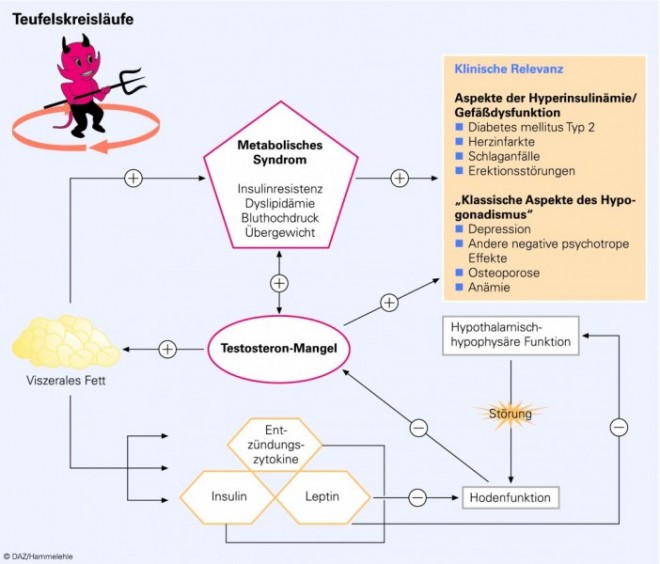
Der Zusammenhang zwischen metabolischem Syndrom und Testosterondefizit ist ein wechelseitiger, der über mindestens zwei ineinandergreifende, sich selbst verstärkende pathophysiologische Mechanismen entsteht (s. Grafik Teufelskreisläufe). Dementsprechend zeigen Studien, bei denen Männer mit metabolischem Syndrom gleichzeitig Sport und Diät zur Reduktion des viszeralen Fettanteils in Kombination mit einer Testosterongabe durchführen, die deutlichsten positiven Aspekte. Dabei verstärken sich die beiden therapeutischen Ansätze [15].
Ausblick
Diese Beobachtungen sind interessant und vielversprechend, beziehen sich aber immer noch auf Sub-Komponenten des metabolischen Syndroms in kleineren Kohorten. Längerfristige, multizentrische Studien zur Testosterongabe bei hypogonadalen Männern mit Endpunkten wie Änderung der Körperzusammensetzung, des Glucosestoffwechsels und letztendlich der kardiovaskulär bedingten Mortalität, sind daher erforderlich und werden auch zur Zeit durchgeführt.
Literatur[1] Anderson PJ, Critchley JA, Chan JC, Cockram CS, Lee ZS, Thomas GN, Tomlinson B: Factor analysis of the metabolic syndrome: obesity vs. insulin resistance as the central abnormality. Int J Obesity 2001; 25: 1782–8.[2] Eisenmann JC: Secular trends in variables associated with the metabolic syndrome of North American children and adolescents: a review and synthesis. Am J Hum Biol 2003; 15: 786–94.[3] Cassells HB, Haffner SM: The metabolic syndrome: risk factors and management. J Cardiovasc Nurs 2006; 21: 306–13.[4] Muller M, Grobbee DE, den Tonkelaar I, Lamberts SW, van der Schouw YT: Endogenous sex hormones and metabolic syndrome in aging men. J Clin Endocrinol Metab 2005; 90: 2618–23.[5] Laaksonen DE, Niskanen L, Punnonen K, Nyyssonen K, Tuomainen TP, Valkonen VP, Salonen R, Salonen JT: Testosterone and sex hormone-binding globulin predict the metabolic syndrome and diabetes in middle-aged men. Diabetes Care 2004; 27: 1036–41.[6] Kupelian V, Page ST, Araujo AB, Travison TG, Bremner WJ, McKinlay JB: Low sex hormone-binding globulin, total testosterone, and symptomatic androgen deficiency are associated with development of the metabolic syndrome in non-obese men. J Clin Endocrinol Metab 2006; 91: 843–50.[7] Mulligan T, Frick MF, Zuraw QC, Stemhagen A, McWhirter C: Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract. 2006 60:762 –9.[8] Zitzmann M, Faber S, Nieschlag E: Association of specific symptoms and metabolic risks with serum testosterone in older men. J Clin Endocrinol Metab 2006; 91:4335 –4343.[9] Zitzmann M: Mechanisms of disease: pharmacogenetics of testosterone therapy in hypogonadal men. Nat Clin Pract Urol 2007; 4:161–166.[10] Carruthers M: The paradox dividing testosterone deficiency symptoms and androgen assays: a closer look at the cellular and molecular mechanisms of androgen action. J Sex Med. 2008; 4:998 –1012.[11] Woodhouse LJ, Gupta N, Bhasin M, Singh AB, Ross R, Phillips J, Bhasin S: Dose-dependent effects of testosterone on regional adipose tissue distribution in healthy young men. J Clin Endocrinol Metab 2004; 89: 718–26.[12] Bouloux P: European TestoGel Study. J Men‘s Health & Gender 2007; 4(3): 373 – 374.[13] Kapoor D, Goodwin E, Channer KS, Jones TH: Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006; 154: 899 – 906.[14] Zitzmann M, Nieschlag E: Androgen receptor gene CAG repeat length and body mass index modulate the safety of long-term intramuscular testosterone undecanoate therapy in hypogonadal men. J Clin Endocrinol Metab 2007; 92:3844 –3853.[15] Heufelder A: The Dimalite Study. Endocrine Society Abstract Book 2007; 151.
Anschrift des Verfassers:Privatdozent Dr. Michael ZitzmannCentrum für Reproduktionsmedizin und AndrologieDomagkstraße 1148129 Münster






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.