
- DAZ.online
- DAZ / AZ
- DAZ 24/2010
- Repellenzien auf ...
Prophylaxe
Repellenzien auf Fernreisen und in der Freizeit
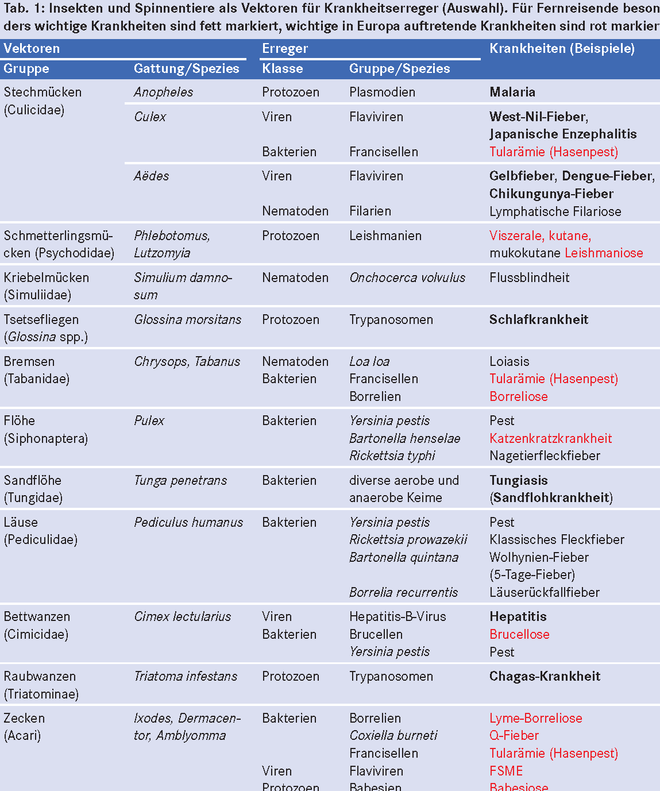
Insekten und Spinnentiere sind Vektoren für eine große Zahl krankmachender Mikroorganismen – von Viren über Bakterien bis zu Protozoen – und Nematoden (Tab. 1). Weltweit infizieren Stechmücken, Fliegen, Läuse, Flöhe, Zecken und Wanzen jedes Jahr mehr als 700 Millionen Menschen [18]. Einzelne Vektoren können häufig mehrere Erregerspezies übertragen, andererseits nutzen identische Erreger unterschiedliche Vektoren. So wird Francisella tularensis , der Verursacher der Tularämie (Hasenpest), je nach Endemiegebiet durch eine Vielzahl von Zeckenspezies oder unterschiedliche Stechmückenarten übertragen. Einige per Vektor übertragbare Krankheiten sind geographisch beschränkt, andere kommen weltweit vor oder breiten sich aus. So sind die neuerdings auf Korsika vorkommenden Aëdes albopictus -Populationen hochkompetente Vektoren für das Chikungunya- und das Dengue-Virus [24].
Zahlreiche der durch Insekten und Spinnentiere übertragenen Krankheiten sind gefährlich, einige sogar lebensbedrohlich. Nur für die Malaria gibt es die Möglichkeit der Chemoprophylaxe und nur für einige wenige vektorübertragene Viruserkrankungen eine Impfprophylaxe. Der Expositionsprophylaxe kommt somit eine kardinale Bedeutung zu. Doch sind Fernreisende häufig nicht darüber informiert. So führten nur 54% der befragten Rucksacktouristen in einem Hoch-Malariagebiet in Südostasien eine Expositionsprophylaxe gegen Anopheles -Mücken durch [30].
In Teilen Europas von besonderer Bedeutung ist die Expositionsprophylaxe gegenüber Zecken, weil sie die Erreger der Lyme-Borreliose und der Frühsommer-Meningoenzephalitis (FSME) übertragen können. Allein in Deutschland treten jedes Jahr 60.000 bis 80.000 neue Fälle von Lyme-Borreliose und rund 300 Fälle von FSME auf.
Was ist ein Repellent?
Repellere (lat.) bedeutet abwehren, fernhalten. Repellenzien sind Stoffe, die Insekten fernhalten. Im Gegensatz zu Insektiziden, welche Insekten durch Kontakt abtöten, bilden Repellenzien durch Verdampfung einen wenige Millimeter dicken Schutzmantel über der Haut, welcher das olfaktorische System der Angreifer stört und diese fernhält.
Repellenzien sind entweder chemisch definierte Substanzen oder Pflanzenextrakte, die typischerweise ätherische Öle und Fettsäuren enthalten.
Von einzelnen Pflanzenextrakten ist die wirksame Komponente bekannt und kann synthetisiert werden, z. B. Citriodiol (= p-Menthan-3,8-diol) aus Corymbia citriodora (Zitroneneukalyptusbaum).
Eine Sonderstellung nehmen Pyrethroide wie Permethrin und Allethrin ein. Diese Insektizide mit einem neurotoxischen Wirkungsmechanismus haben auch eine gewisse Repellentwirkung. Neem-Öl aus den Früchten des Neem-Baums (Azadirachta indica) wirkt ebenfalls repellierend und insektizid [5].
Die Anforderungen an ein gutes Repellent sind hoch (s. Kasten "Anforderungen an ein optimales Repellent"). Das optimale Repellent – breites Wirkungsspektrum, lange Wirkungsdauer, kein toxisches Risiko, hochwirksam bei den unterschiedlichsten Umweltbedingungen – gibt es nicht. Ein entsprechendes Produkt ist derzeit auch nicht in Sicht.
Biologischer Hintergrund
Insekten und Spinnentiere nutzen unterschiedliche olfaktorische Stimuli bei der Findung eines geeigneten Wirts. Stechmücken (Culicidae) beispielsweise orientieren sich an einem CO2 -Gradienten. Gerüche, die durch den Stoffwechsel von Hautbakterien entstehen (typischer Schweißfußgeruch), und Milchsäure dienen ebenfalls als Stimuli [10, 14]. Damit ein Repellent sicher wirkt, muss der abweisende oder abschreckende Effekt größer sein als die Summe der olfaktorischen Stimuli der Person. Da Individuen olfaktorische Stimuli in unterschiedlicher Konzentration und Zusammensetzung aussenden, ist die Wirksamkeit eines Repellents a priori variabel. Außerdem ändern sich olfaktorische Stimuli einer Person durch körperliche Aktivitäten wie Schwitzen, wohingegen die Schutzwirkung eines auf die Haut aufgetragenen Repellents mit zunehmender Zeit überproportional abnimmt [15]. Gleichzeitig variiert das Flugverhalten von blutsaugenden Insekten in Abhängigkeit von physikalischen Variablen wie Lichteinstrahlung, Lufttemperatur und -feuchtigkeit über den Tag. Eine um 10 °C höhere Lufttemperatur oder ein starker Luftzug kann die Wirksamkeit eines Repellents um die Hälfte senken [14].
Die "Attraktivität" einzelner Menschen für Stechmücken einer definierten Art variiert erheblich [14]. In der Regel sind Erwachsene und Männer attraktiver als Kinder und Frauen. Kleine Menschen scheinen Stechmücken weniger anzulocken als große [14]. In Unkenntnis der komplexen Zusammenhänge machen Anwender häufig kategorische Aussagen, wie "das Produkt hatte keine Wirkung" oder "ich werde sowieso nie gestochen", die objektiv falsch sind.
Pflanzlich gleich unbedenklich?Repellenzien auf pflanzlicher Basis sind nicht automatisch auch toxikologisch unbedenklich. Zahlreiche ätherische Öle haben ein allergenes Potenzial, einige können die Haut lichtempfindlich machen oder die Schleimhäute reizen [2]. Teebaumöl (von Melaleuca alternifolia) schädigt in hoher Konzentration die Nieren und gilt als potenziell kanzerogen [11]. |
Nachweis der Wirksamkeit
Es ist ausgesprochen schwierig, die Wirksamkeit eines Repellents nachzuweisen. Das hängt damit zusammen, dass der molekulare Wirkungsmechanismus nahezu aller Substanzen unbekannt ist – und dies, obwohl einige Produkte seit mehr als 40 Jahren auf dem Markt sind [14, 23].
Die Wirksamkeit eines Repellents schwankt erheblich in Abhängigkeit von der Vektorengruppe und variiert zwischen einzelnen Spezies derselben Gattung [4, 8]. Bei Zecken hängt die Wirksamkeit außerdem auch von ihrem Entwicklungsstadium ab. So kann ein definiertes Repellent eine geringere Wirkung auf Nymphen (die ein größeres Infektionsrisiko in Bezug auf Borreliose und FSME darstellen) als auf Adulte haben [2]. Kein Repellent ist an allen krankheitsrelevanten Spezies von Insekten und Spinnentieren getestet. Meist ist die Wirksamkeit nur für eine bestimmte "Modellspezies" belegt, an der Bioassays oder Laborversuche relativ leicht durchgeführt werden können.
Die Wirksamkeit eines Repellents lässt sich mit unterschiedlichen Methoden nachweisen. Bioassays liefern einen ersten Anhaltspunkt für die Repellentwirkung von neuen synthetischen Substanzen oder von Pflanzenextrakten. Bei pflanzlichen Repellenzien ermöglichen sie, verschiedene Extraktionsverfahren, Lösungsmittel und Inhaltsstoffe miteinander zu vergleichen. Ein Problem der Bioassays ist, dass nur für wenige Vektoren standardisierte Prozeduren existieren und relativ geringe Änderungen im Versuchsaufbau das Wirksamkeitsprofil der getesteten Substanzen verändern können [6]. Einen Beweis für die Wirksamkeit eines Produktes in der Praxis liefern Bioassays nicht.
Praxisrelevanter sind Ergebnisse von Laborversuchen. Hier halten Versuchspersonen ihre Unterarme in einen Käfig mit "ausgehungerten" Vektoren, wobei auf dem einen Arm das Repellent aufgetragen ist und der andere, unbehandelte Arm als Kontrolle dient. Rutledge und Gupta [33] haben gezeigt, dass Labortests an mehr als 100 Personen durchgeführt werden müssten, wenn man eine Schutzdauer von acht Stunden mit hinreichender Genauigkeit bestimmen will. Tatsächlich wird die Repellentwirkung meist nur an wenigen Probanden und für eine relativ kurze Zeitdauer überprüft. Dementsprechend ist auch die Übertragbarkeit der Ergebnisse von Labortests in die Praxis begrenzt.
Das nächste – wesentlich aufwendigere – Verfahren ist der Nachweis der Wirksamkeit unter realen Bedingungen in Feldversuchen. Staub et al. [39] beispielsweise randomisierten Waldarbeiter in zwei Gruppen und ließen die Versuchspersonen morgens zwei unterschiedliche, gegen Zecken wirksame Repellenzien auf den Körper auftragen. Abends wurde dann die Zahl der auf der Haut festsitzenden bzw. in der Kleidung versteckten Zecken ausgezählt. Diese Art von Feldversuch gibt einen zuverlässigen Hinweis auf die Wirksamkeit eines Repellents unter bestimmten Umweltbedingungen. Ändern sich die Umweltbedingungen, so ist damit zu rechnen, dass sich auch die Wirksamkeit des Repellents ändert.
Bei Labor- und Feldversuchen wird die Wahrscheinlichkeit einer bestimmten Schutzdauer bei einer bestimmten Konzentration des Repellents ermittelt. Erstrebenswert ist ein mindestens 95%iger Schutz für mehr als sechs Stunden.
Entscheidend für die Beurteilung der Wirksamkeit eines Repellents ist, wie sicher es die Krankheit verhindert, die durch Insekten oder Spinnentiere übertragen wird, gegen die das Repellent schützen soll. Solche Protektionsstudien sind extrem aufwendig und werden deshalb von den Herstellern gescheut. Nur für drei Substanzen wurden bislang entsprechende aussagekräftige Studien durchgeführt.
Anforderungen an ein optimales Repellent
|
Fachgesellschaften
** Die Konzentrationsangaben in Klammern entsprechen den strengeren Empfehlungen
der kanadischen Gesundheitsbehörde/Fachgesellschaft
Galenische Zubereitung / Formulierung
Die meisten Repellenzien sind in unterschiedlichen Darreichungsformen verfügbar. DEET beispielsweise ist als Pumpspray, Lotion, Salbe, Flüssigkeit, Stift, Roll-on, Feuchttuch und als imprägniertes Armband auf dem Markt. Dies ist von Bedeutung, da die Darreichungsform die Wirksamkeit eines Repellents beeinflusst [8, 27]. Die Hersteller weisen darauf allerdings nicht hin.
Als allgemeine Regel gilt, dass Repellenzien, die auf die Haut aufgetragen werden, sinnvollerweise als Lotion eingesetzt werden. Will man verhindern, dass Vektoren von Kleidung bedeckte Körperstellen erreichen (Zecken!), ist ein Spray für die Kleidung das geeignete Mittel.
Synthetische Repellenzien
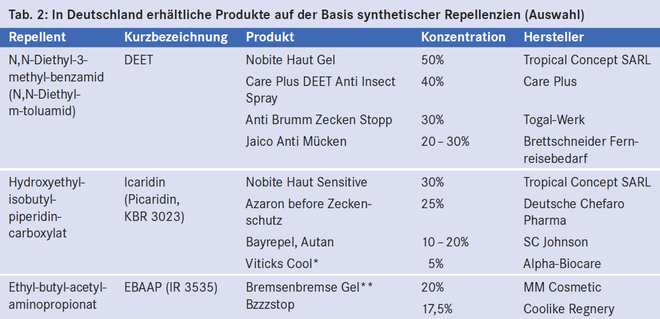
Die weltweit am häufigsten eingesetzten synthetischen Repellenzien sind DEET, Icaridin (Picaridin, KBR 3023) und EBAAP (IR 3535) (Tab. 2). Die Wirksamkeit eines synthetischen Repellents hängt stark von der Konzentration ab [8]. Beispielsweise schützt DEET bei einer Konzentration von 5% circa 2 Stunden, bei 10% etwa 3 Stunden, bei 15% etwa 5 Stunden und bei 30% maximal 6 Stunden lang gegen Stechmücken [23]. Die maximale Wirksamkeit wird bei etwa 50% erreicht [1]. Höhere Konzentrationen sind deshalb nicht sinnvoll.
DEET
Ursprünglich vom amerikanischen Landwirtschaftsministerium für die Expositionsprophylaxe bei US-Truppen entwickelt, wird DEET seit 1956 auch kommerziell vertrieben. Es wird weltweit vermarktet und ist das am häufigsten eingesetzte Repellent. DEET ist das einzige synthetische Repellent, dessen Schutzwirkung in einer Protektionsstudie nachgewiesen wurde. Soto et al. [38] zeigten bereits 1995, dass im Regenwald von Kolumbien stationierte Soldaten signifikant seltener an Malaria und kutaner Leishmaniose erkrankten, wenn sie ihre Kleidung regelmäßig mit DEET imprägnierten.
Die auf dem Markt erhältlichen Produkte haben einen DEET-Gehalt zwischen 5 und 90%. Da die Gefahr toxischer Nebenwirkungen mit zunehmender Konzentration steigt, ist in einigen Ländern wie der Schweiz und Kanada die Konzentration von DEET in einem Repellent auf 30% begrenzt [18, 23]. Außer der Repellentwirkung zeigt die Substanz auch eine gute Insektizidwirkung und dient als Imprägnierungsmittel für Moskitonetze [26, 29]. DEET-Präparate enthalten häufig Ethanol als Lösungsmittel. Da Ethanol die perkutane Resorption von DEET steigert, sollte man Präparate ohne Ethanol bevorzugen [1].
Bemerkenswert ist, dass einzelne Stechmückenspezies, beispielsweise Anopheles albimanus (der wichtigste Malariavektor in den USA), refraktär gegen DEET geworden sind [20].
** LT = Labortest (Armtest); FV = Feldversuch (Wirksamkeit unter realen Verhältnissen); PS = Protektionsstudie (Nachweis, dass Expositionsprophylaxe
die Krankheit verhindert)
*** Je nach Studie Wirksamkeitsnachweis bei Culex, Aëdes, Anopheles, Mansonioides oder anderen Stechmückenarten
Icaridin (Picaridin, KBR 3023)
Icaridin hat ein ähnliches Wirkprofil wie DEET, penetriert aber in geringerem Maße durch die Haut. Labortests und Feldversuche bei verschiedenen Stechmücken zeigten eine ähnliche, teilweise sogar eine bessere Wirksamkeit als DEET [3, 16, 27].
EBAAP (IR 3535)
EBAAP wird in Europa seit rund 20 Jahren eingesetzt. Gleichwohl ist die Wirksamkeit nur schlecht dokumentiert. Bei Aëdes - und Culex -Mücken war die Schutzdauer deutlich kürzer als die von DEET [8]. Der Wirkungsmechanismus ist unbekannt. Wegen der kurzen Wirkungsdauer ist EBAAP zur Expositionsprophylaxe bei Malaria und bei anderen gefährlichen Tropenkrankheiten nicht geeignet [1].
Pyrethroide
Aus toxikologischen Erwägungen und um keine resistenten Insektenpopulationen zu selektionieren, sollten Repellenzien, die Pyrethroide wie Permethrin oder Allethrin alleine oder in Kombination mit synthetischen oder pflanzlichen Substanzen enthalten, grundsätzlich nicht eingesetzt werden. Werden Pyrethroide inhaliert, besonders in der pränatalen, perinatalen oder postnatalen Entwicklungsphase, so kann dies Erkrankungen des Zentralnervensystems zur Folge haben [36].
Sonderfall Kinder
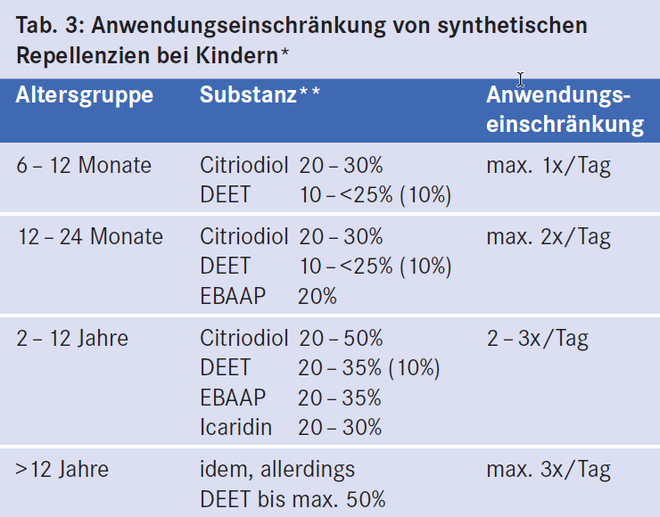
Bei Kindern sind in Abhängigkeit vom Alter Einschränkungen bei der Anwendung von synthetischen Repellenzien zu beachten (Tab. 3). Diese Anwendungseinschränkungen haben in der Praxis erhebliche Auswirkungen. Da bei einer DEET-Konzentration von 10% eine Schutzwirkung gegen Stechmücken nur für zwei bis drei Stunden gewährleistet ist und unter zwei Jahre alte Kinder maximal zweimal täglich DEET anwenden dürfen, sind diese Kinder, wenn sie sich in einem Endemiegebiet aufhalten, nur zeitweise gegen lebensbedrohliche Krankheiten wie Malaria, West-Nil-Fieber oder Dengue-Fieber geschützt.
Toxikologische Aspekte
Um die perkutane Resorption von synthetischen Repellenzien so gering wie möglich zu halten, werden grundsätzlich nur die Hautareale behandelt, die nicht von Kleidung bedeckt sind. Schleimhäute, Lippen, Augenbereich – bei Kindern auch die Hände (Gefahr des Ableckens!) – sowie krankhaft veränderte Haut müssen ausgespart bleiben. Aus toxikologischen Gründen sollten Produkte, die zwei oder mehr unterschiedliche synthetische Repellenzien enthalten, nicht angewandt werden.
DEET
Das amerikanische Center for Disease Control (CDC) schätzt, dass in den USA und Kanada 23 bis 29% aller Kinder regelmäßig DEET enthaltende Repellenzien einsetzen [23]. Bei unsachgemäßer topischer Anwendung (zu hohe Konzentration, zu häufige Wiederholung pro Zeiteinheit, Anwendung über lange Zeit) kann es zu schweren Störungen des Zentralnervensystems kommen (Krämpfe, Tremor). Amerikanische Autoren publizierten 22 Fälle DEET-assoziierter Enzephalopathie, davon drei mit letalem Ausgang [32]. Hoop et al. [19] berichteten in der Schweiz über einen nicht therapierbaren Krampfanfall bei einem Kind mit DEET im Blut, das anschließend verstarb.
Auch kardiovaskuläre und allergische Nebenwirkungen (Pruritus, Kontaktdermatitis, generalisiertes Ödem, Anaphylaxie) sind bekannt [23]. Gelangt die Substanz versehentlich in die Augen, entwickelt sich eine Konjunktivitis. Wird das Repellent geschluckt – beispielsweise wenn Kleinkinder behandelte Haut ablecken – kommt es zu Blutdruckabfall, Krampfanfällen und Koma [23]. Bei einer Person entwickelte sich eine akute Psychose nach der Anwendung einer 70%igen DEET-Lösung auf die Haut [23]. Eine Übersicht zu den in den USA offiziell registrierten Komplikationen nach der Anwendung von DEET findet sich bei Roberts und Reigart [32].
Auf die Haut appliziertes DEET wird rasch resorbiert. Sechs Stunden nach der Applikation sind 10 bis 50% der eingesetzten Dosis in das Blut übergetreten [23, 32]. DEET passiert die Plazenta und ist im Nabelschnurblut nachweisbar [23]. Deshalb raten französische Experten Schwangeren und Stillenden davon ab, die Substanz anzuwenden [37]. Bei Kindern ist ein bekanntes Anfallsleiden eine Kontraindikation. Wegen der Gefahr der Akkumulation soll die Substanz nicht länger als einen Monat bei täglicher Applikation angewendet werden [37].
Bei gleichzeitiger Applikation einer Sonnencreme steigt die Resorption von DEET deutlich, während der Schutz gegen UV-Strahlen abnimmt [1]. Von einer fixen Kombination aus DEET und einem Sonnenschutzmittel ist dementsprechend abzuraten. Die simultane Applikation topischer Retinoide kann ebenfalls die DEET-Toxizität erhöhen [1]. DEET greift Kunststoffe und lackierte Flächen an.
Icaridin
Bei Kindern unter zwei Jahren soll Icaridin nicht angewendet werden (Tab. 3). Französische Pädiater berichteten über unerwünschte Nebenwirkungen bei rund 40% der Kinder, bei denen Icaridin angewendet worden war [37]. Anzeichen für karzinogene, mutagene, entwicklungs- oder reproduktionstoxische Eigenschaften von Icaridin gibt es nicht [1].
EBAAP
Im Tierversuch ist die dermale und orale Toxizität von EBAAP nur ein Fünftel bis halb so hoch wie die von DEET [1]. Die Datenlage über die Häufigkeit von unerwünschten Wirkungen von EBAAP ist unzureichend.
Repellenzien auf pflanzlicher Basis
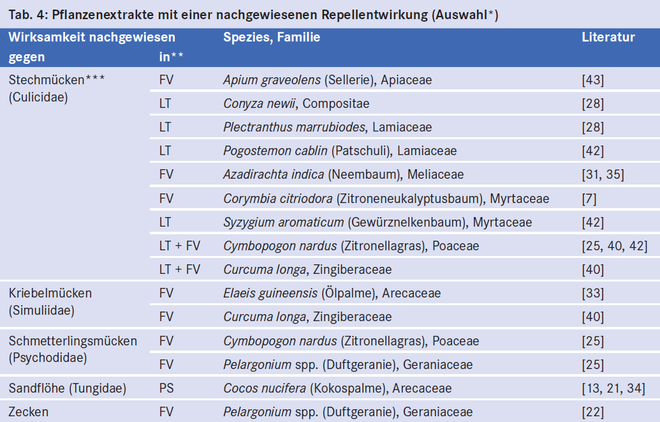
Zahlreiche Pflanzen aus taxonomisch sehr unterschiedlichen Familien haben eine abwehrende Wirkung auf Insekten (Tab. 4). Die meisten Untersuchungen wurden bei Stechmücken (Culicidae) gemacht. In Vergleichsstudien waren die Pflanzenextrakte zum Teil schlechter, zum Teil ähnlich gut, zum Teil sogar besser wirksam als synthetische Repellenzien [4, 7, 12, 28, 31, 40, 43]. Einige Autoren fanden eine ähnlich lange Schutzwirkung wie bei DEET, in den meisten Studien war die Schutzwirkung jedoch deutlich kürzer [12, 31, 40 – 42]. Die Aussage, dass Repellenzien auf pflanzlicher Basis grundsätzlich schlechter gegen Stechmücken schützen als synthetische, ist also nicht korrekt. Sie muss für einzelne Produkte und Vektoren differenziert werden.
Die Zeitschrift test untersuchte in einem Labortest die Wirksamkeit von elf Repellenzien auf pflanzlicher Basis gegen Zecken [2]: Neun Produkte wurden mit mangelhaft, eines mit ausreichend und eines mit befriedigend beurteilt. Zum Vergleich: Von acht getesteten synthetischen Repellenzien erhielten fünf eine befriedigende Wirksamkeit, eines eine ausreichende und zwei eine mangelhafte bescheinigt. Kein synthetisches und kein pflanzliches Produkt wirkte "gut". In einem Feldversuch in Marokko erzielten Khallaayoune et al. [22] mit einem Extrakt aus Pelargonium spp. (enthält Geraniol) allerdings eine sehr gute Schutzwirkung gegen lokal vorkommende Zeckenspezies.
Außergewöhnlich gut belegt ist die Wirksamkeit eines Repellents auf der Basis von Kokosnussöl (Zanzarin®). In mehreren Protektionsstudien in Gebieten mit einem extrem hohen Infektionsdruck durch Sandflöhe schützte eine zweimal tägliche Anwendung des Repellents sicher gegen die Parasiten und verhinderte eine Sandflohkrankheit (Tungiasis) [13, 21, 34]. In Feldversuchen zeigte sich Kokosnussöl auch wirksam gegen unterschiedliche Arten von Stechmücken [31, 35]
Citriodiol (p-Menthan-3,8-diol)
Citriodiol ist ein Monoterpen aus dem Extrakt von Blättern des Zitroneneukalyptusbaums (Corymbia citriodora). Die Substanz wird meist synthetisch hergestellt. In zahlreichen Labor- und Feldversuchen war Citriodiol (20 – 70%) ähnlich oder besser wirksam als DEET (7 – 50%) [6]. In einer Protektionsstudie im bolivianischen Regenwald wurde eine 80%ige Schutzrate gegen Malaria erzielt, wenn Einheimische sich in der Abenddämmerung eine 30%ige Citriodiol-Lösung applizierten und nachts ein mit Deltamethrin (synthetisches Pyrethroid) imprägniertes Moskitonetz nutzten [17].
Akustische Insektenabwehr und sonstige Verfahren
In einer Metaanalyse haben kubanische Autoren die Wirksamkeit von Geräten ausgewertet, die akustische Signale aussenden. Für 16 verschiedene Stechmückenspezies konnte kein signifikanter Schutz der Träger der Geräte nachgewiesen werden [9]. Holzer kommt zu einer ähnlichen Schlussfolgerung [18]. Auch die Wirksamkeit von Lichtfallen sowie der bei Konsumenten beliebten Einnahme von Vitamin B1 ist nicht belegt [1].
Praktisches Vorgehen
Grundsätzlich muss zwischen einer Expositionsprophylaxe in Deutschland, Nordeuropa, im Mittelmeerraum und in den Tropen unterschieden und vor jeder Empfehlung eine Gefahren-Nutzen-Abwägung vorgenommen werden. Dabei gilt das Prinzip, dass immer dann auf eine hohe Wirksamkeit des Repellents und eine lange Wirkdauer geachtet werden muss, wenn die Expositionsprophylaxe den Anwender vor gefährlichen Krankheiten wie Malaria, Dengue-Fieber oder Borreliose schützen soll. Geht es dagegen lediglich darum, unangenehme Insektenstiche abzuwehren, muss der Aspekt der Unbedenklichkeit des Repellents im Vordergrund stehen (Tab. 5).
Da die Schutzdauer eines Produkts von zahlreichen Variablen abhängt, sind starre Dosierungsempfehlungen nicht hilfreich. Der Anwender muss selbst beobachten, wann die Schutzwirkung des von ihm gewählten Produkts nachlässt, und es dementsprechend erneut auftragen.
Wünsche an die Hersteller
Zum Schluss noch einige Wünsche an die Hersteller von Repellenzien:
- Die Hersteller sind angeraten, die Wirksamkeit ihrer Produkte gegenüber allen wichtigen Vektorengruppen zu belegen und ihre Verträglichkeit zu beweisen.
- Auf der Packung sollten sie die Konzentration des Wirkstoffs / der Wirkstoffe angeben.
- Unterschiedliche Wirkstoffe sollten sie nicht mit sehr ähnlichen Produktnamen vermarkten, und sie sollten die Produktnamen nicht so häufig ändern, denn beides führt zur Verwirrung.
Literatur [1] Altenkämper M, Schlitzer M. Erfolgreich gegen den Insektenangriff. Pharm Ztg 2008;153(11):846 – 853. [2] anonym. Unzuverlässig. test 2008;5:82 – 86. [3] Badolo A, et al. Evaluation of the sensivity of Aedes aegypti and Anopheles gambiae complex mosquitoes to two insect repellents: DEET and KBR 3023. Trop Med Int Health 2004;9(3):330 – 334. [4] Barnard DR, Xue R. Laboratory evaluation of mosquito repellents against Aedes albopictus, Culex nigripalpus and Ochlerotatus triseriatus (diptera: culicidae). J Med Entomol 2004;41(4):726 – 730. [5] Brahmachari G. Neem – an omnipotent plant: a retrospection. ChemBioChem 2004;5:408 – 421. [6] Carroll JF, et al. Comparative activity of DEET and AI3-37220 repellents against the ticks Ixodes scapularis and Amblyomma americanum (acari: ixodidae) in laboratory bioassays. J Med Entomol 2004;41(2):249 – 254. [7] Carroll SP, Loye J. PMD, a registered botanical mosquito repellent with DEET-like efficacy. J Am Mosq Control Assoc 2006;22(3): – 507. [8] Cilek JE, Petersen JL, Hallmon CF. Comparative efficacy of IR3535 and DEET as repellents against adult Aedes aegypti and Culex quinquefasciatus. J Am Mosq Control Assoc 2004;20(3):299 – 304. [9] Coro F, Suárez S. Repelentes electrónicos contra mosquitos: propaganda y realidad. Rev Cubana Med Trop 1998;50(2):89 – 92. [10] De Jong R, Knols BGJ. Olfactory responses of host-seeking Anopheles gambiae s. s. Giles (Diptera: Culicidae). Acta Tropica 1995;59:333 – 335. [11] Donner S. Keine Rose ohne Dornen. Frankfurter Allgemeine Sonntagszeitung 2009 Jun 28:60 – 61. [12] El-Sheikh T. Field evaluation of repellency effect of some plant extracts against mosquitoes in Egypt. J Egypt Soc Parasitol 2009;39(1):59 – 72. [13] Feldmeier H, Kehr JD, Heukelbach J. A plant-based repellent protects against Tunga penetrans infestation and sand flea disease. Acta Tropica 2006;99:126 – 136. [14] Fradin MS. Mosquitoes and Mosquito Repellents: A Clinician‘s Guide. Ann Intern Med 1998;128:931– 440. [15] Frances SP, et al. Laboratory and Field Evaluation of DEET, CIC-4 and AI3-37220 against Anopheles dirus (diptera: culicidae) in Thailand. J Med Entomol 1996;33(4):511– 514. [16] Frances SP, et al. Field evaluation of commercial repellent formulations against mosquitoes (diptera: culicidae) in Northern Territory, Australia. J Am Mosq Control Assoc 2005;21(4):480 – 482. [17] Hill N, et al. Plant based insect repellent and insecticide treated bed nets to protect against malaria in areas of early evening biting vectors: double blind randomised placebo controlled clinical trial in the Bolivian Amazon. Br Med J 2007;335:1023 –1025. [18] Holzer RB. Schutz gegen Stechmücken. Therapeutische Umschau 2001;58(6):341– 346. [19] Hoop R, Stocker S, Walser K. Repellents. Paediatrica 2005;16(3):45 – 46. [20] Katz TM, et al. Insect repellents: Historical perspectives and new developments. J Am Acad Dermatol 2008;58(5):865 – 871. [21] Kehr JD, Heukelbach J, Mehlhorn H, Feldmeier H. Morbidity assessment in sand flea disease (tungiasis). Parasitol Res 2007;100:413 – 421. [22] Khallaayoune K, et al. Efficacy of 1% geraniol (Fulltec) as a tick repellent. Parasite 2009;16:223 – 226. [23] Koren G, Matsui D, Bailey B. DEET-based insect repellents: safety implications for children and pregnant and lactating women. Can Med Assoc J 2003;169(3):209 – 212. [24] Moutailler S, et al. Recently introduced Aedes albopictus in Corsica is competent to chikungunya virus and in a lesser extent to dengue virus. Trop Med Int Health 2009;14:1105 –1109. [25] Müller GC, et al. Indoor protection against mosquito and sand fly bites: A comparison between Citronella, Linalool and Geraniol candles. J Am Mosq Control Assoc 2008;24(1):150 –153. [26] N‘Guessan R, et al. Evaluation of synthetic repellents on mosquito nets in experimental huts against insecticide-resistant Anopheles gambiae and Culex quinquefasciatus mosquitoes. Trans R Soc Trop Med Hyg 2006;100: 1091 – 1097. [27] Naucke TJ, et al. Field evaluation of the efficacy of proprietary repellent formulations with IR3535 and Picaridin. Parasitol Res 2007;101:169 –177. [28] Omolo MO, et al. Repellency of essential oils of some plants from the Kenyan coast against Anopheles gambiae. Acta Tropica 2005;95:210 – 218. [29] Pennetier C, et al. Synergy between repellents and organophosphates on bed nets: efficacy and behavioural response of natural free-flying An. gambiae mosquitoes. PLoS ONE 2009;4(11). [30] Piyaphanee W, et al. Knowledge, attitudes and practices among foreign backpackers toward malaria risk in Southeast Asia. J Travel Med 2009;16(2):101 – 106. [31] Ravindran J, Eapen A, Kar I. Evaluation of repellent action of Neem oil against the filarial vector, Culex quinquefasciatus (diptera: culicidae). Indian J Malariol 2002;39:13 –17. [32] Roberts JR, Reigart JR. Does anything beat DEET? Pediatr Ann 2004;33(7):444. [33] Rutledge LC, Gupta RK. Variation in the protection periods of repellents on individual human subjects: An analytical review. J Am Mosq Control Assoc 1999;15(3):348 – 355. [34] Schwalfenberg S, Witt LH, Kehr JD, Feldmeier H. Prevention of tungiasis using a biological repellent: a small case series. Ann Trop Med Parasitol 2004;98:89 – 94. [35] Sharma SK, Dua VK, Sharma VP. Field studies on the mosquito repellent action of Neem oil. South East Asian J Trop Med Public Health 1995;26(1):180 –182. [36] Sinha C, et al. Mosquito repellent (pyrethroid-based) induced dysfunction of blood-brain barrier permeability in developing brain. Int J Dev Neurosci 2004;22:31– 37. [37] Sorge F, et al. Protection antimoustique chez l‘enfant: recommandations du Groupe de Pédiatrie Tropicale. Archives de Pédiatrie 2009;16:771– 773. [38] Soto J, et al. Efficacy of permethrin-impregnated uniforms in the prevention of malaria and leishmaniasis in Colombian soldiers. Clin Infect Dis 1995;21:599 – 602. [39] Staub D, et al. Effectiveness of a repellent containing DEET and EBAAP for preventing tick bites. Wilderness Environ Med 2002;13:12 – 20. [40] Tawatsin A, et al. Field evaluation of DEET, Repel Care, and three plant-based essential oil repellents against mosquitoes, black flies (diptera: simulidae), and land leeches (arhynchobdellida: haemadipsidae) in Thailand. J Am Mosq Control Assoc 2006;22(2):306 – 313. [41] Tawatsin A, et al. Repellency of volatile plants against three mosquito vectors. J Vector Ecol 2001;26(1):76 – 82. [42] Trongtokit Y, et al. Comparative repellency of 38 essential oils against mosquito bites. Phytother Res 2005;19: 303 – 309. [43] Tuetun B, et al. Field evaluation of G10, a celery (Apium graveolens)-based topical repellent, against mosquitoes (diptera: culicidae) in Chiang Mai province, northern Thailand. Parasitol Res 2009;104:515 – 521.
Autor
Prof. Dr. med. Hermann Feldmeier
Institut für Mikrobiologie und Hygiene
Campus Benjamin Franklin
Charité Universitätsmedizin Berlin
Dorotheenstr. 96, 10117 Berlin
hermann.feldmeier@charite.de























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.