
- DAZ.online
- DAZ / AZ
- DAZ 5/2013
- Verbraucher melden UAW
Pharmakovigilanz
Verbraucher melden UAW
Erfahrungen des BfArM
Die Bundesoberbehörden BfArM und PEI betreten mit dem neuen Internetportal zur Meldung unerwünschter Arzneimittelwirkungen durch Verbraucher Neuland. Prof. Dr. Birgitta Kütting, Leiterin der Pharmakovigilanzabteilung des BfArM, verwies auf die bisherigen Erfahrungen mit den eingegangenen Verbrauchermeldungen. Schon früher habe man Verbraucherberichte nicht abgelehnt. Seit 2005 seien ca. 40 bis 60 Meldungen pro Jahr eingegangen. Zwar könne man auf der Grundlage der wenigen Meldungen noch keine abschließende Bewertung vorlegen, aber anhand der bisherigen Verbraucherberichte ließen sich Trends erkennen. Während bei den Heilberuflern die Meldungen hauptsächlich Arzneimittel für das Nervensystem, antineoplastische und immunstimulierende Mittel, Arzneimittel für das kardiovaskuläre System und Arzneimittel für Blut und blutbildende Organe betrafen, meldeten Verbraucher über das neue Portal hauptsächlich UAW zu Arzneimitteln des kardiovaskulären Systems, des Nervensystems, zu Sexualhormonen und zu Mitteln des Urogenitalsystems und zu Antiinfektiva.
Die Qualität der Berichte war in der Regel nicht schlechter als die der Heilberufler. Zwar ließe sich einiges verbessern, aber dies müsse man auch über die eingehenden Berichte von Heilberuflern sagen, so Kütting. Bei den eingegangenen Berichten lasse sich jetzt schon anhand der in den Berichten gewählten Ausdrucksform erkennen, dass in erster Linie Angehörige höherer Bildungsschichten den Willen haben zu berichten.
Die Meldenden wollten in erster Linie erreichen, dass Ärzte ihre Berichte über unerwünschte Arzneimittelwirkungen ernster als bisher nehmen, so Kütting. Zum anderen wollten sie einen Beitrag zur Arzneimittelsicherheit leisten und andere Verbraucher vor Risiken schützen. Zudem wurde der Wunsch geäußert, bestimmte unerwünschte Arzneimittelwirkungen in den Beipackzetteln deutlicher als bisher zu kennzeichnen, damit sie schon bei Therapiebeginn besser beachtet werden können. Denn dann ließe sich das Arzneimittel gegebenenfalls rechtzeitig als Verursacher einer negativen Symptomatik identifizieren und das Arzneimittel in Absprache mit dem behandelnden Arzt gegebenfalls rechtzeitig absetzen. Insgesamt zeigte sich Kütting überzeugt, dass die UAW-Meldungen von Verbrauchern in Zukunft verstärkt direkt an die Bundesoberbehörden gerichtet werden.
Erfahrungen des Paul-Ehrlich-Instituts (PEI)
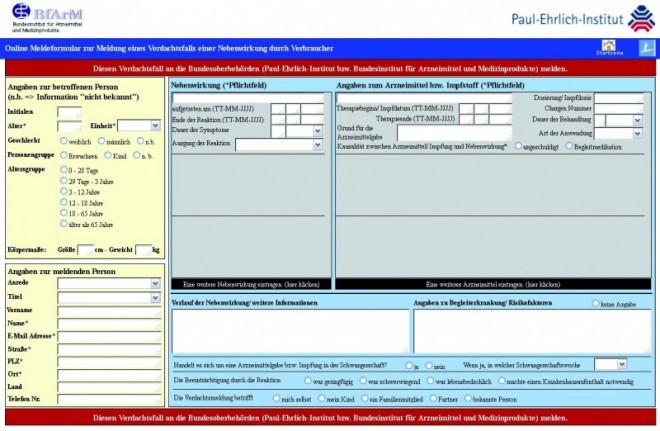
Das Interesse an dem Portal war von Beginn an groß. Innerhalb von zehn Tagen besuchten 5077 Personen die Startseite, 171 Verdachtsfälle wurden gemeldet, von denen 77 Meldungen formal ausreichend ausgefüllt waren, berichtete von der Abteilung Arzneimittelsicherheit des PEI Dr. Doris Oberle. Die Bundesoberbehörden versprechen sich durch das Internetportal eine schnelle Analyse der Berichte. Zudem wird erwartet, dass unbekannte UAW teilweise früher als bisher erkannt werden, Berichte über unerwünschte Ereignisse zur Früherkennung von Risikosignalen beitragen und Maßnahmen zur Risikominimierung eventuell schneller eingeleitet werden könnten. Die Pilotphase des Internetportals solle laut Oberle dazu dienen, die Akzeptanz und Benutzerfreundlichkeit des Portals zu testen und Änderungsvorschläge entgegenzunehmen.
Das Online-Meldeformular zur Meldung eines Verdachtsfalls einer Nebenwirkung durch Verbraucher und ausführliche Hinweise finden sich unter https://verbraucher-uaw.pei.de/fmi/iwp/cgi?-db=Verbraucher-UAW&-loadframes Über das gemeinsame Internetangebot der beiden Behörden haben Patienten und Verbraucher jetzt Zugang zu einem vereinfachten Meldeformular.
Erfahrungen aus den Niederlanden
Das aus einer niederländischen Apothekerinitiative hervorgegangene niederländische Pharmakovigilanzzentrum Lareb (Landelijke registratie evaluatie bijwerkingen) ist heute noch eine unabhängige, aber eng mit der niederländischen Überwachungsbehörde kooperierende Organisation. Auch hier konnten die positiven Erkenntnisse über Consumer Reporting bestätigt werden, so Florence van Hunsel vom Lareb. Anfangs war man in den Niederlanden skeptisch, ob Verbraucherberichte eine ausreichende Qualität haben würden. Nach neun Jahren Erfahrungen stellt sich diese Frage nicht mehr. Jetzt kommen die häufigsten Berichte direkt von den Verbrauchern, gefolgt von den Apothekern und den Ärzten. Berichte aus der Industrie spielen in den Niederlanden nur eine geringe Rolle. Van Hunsel nannte als Vorteile des Consumer Reporting
- vermehrte Meldung von UAW
- Generierung neuer Signale oder Verstärkung von Signalen
- bessere Beobachtung von OTC-Arzneimitteln
- stärkere Berücksichtigung der Beeinflussung von Lebensqualität.
Der besondere Wert von Verbraucherberichten beruhe darauf, so van Hunsel, dass sie auf die Lebensqualität der Arzneimittelnutzer fokussieren. Nun folge man auch im Bereich Pharmakovigilanz dem Gedanken von mehr Patientenorientierung statt alleiniger Arzneimittelorientierung.
Statement der AkdÄDie Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) begrüßt die Möglichkeit, dass Patienten unerwünschte Arzneimittelwirkungen direkt an die zuständigen Arzneimittelbehörden melden können. Dadurch können zusätzliche Erkenntnisse über die Sicherheit von Arzneimitteln gewonnen werden. Jedoch sollte auch in Zukunft der Arzt oder Apotheker erster Ansprechpartner für Patienten sein, wenn es um unerwünschte Arzneimittelwirkungen geht. Denn nicht immer können Laien selbstständig entscheiden, ob es sich bei einem beobachteten Symptom um die Reaktion auf ein Medikament oder das Symptom einer Erkrankung handelt, die eine weitergehende Diagnostik und Behandlung erforderlich macht. Hilfreich ist, wenn bei der UAW-Meldung der behandelnde Arzt angegeben wird, sodass zusätzliche Informationen angefordert werden können. Die AkdÄ hat Meldungen von Patienten ausgewertet, die zwischen 2007 und 2012 eingegangen sind. Der Anteil an den Gesamtmeldungen lag bei 1,5%. Von den Berichten wurden 37% als schwerwiegend eingestuft. Auch von Angehörigen betroffener Patienten wurden Nebenwirkungen berichtet, insbesondere zu Todesfällen. Ein großer Teil der Berichte wurde durch Informationen aus dem Internet angeregt, z. B. durch Internet-Plattformen zu bestimmten Erkrankungen oder Patienten wurden durch Links auf Informationen der AkdÄ weitergeleitet. Viele der bisher eingegangenen Meldungen von Patienten enthalten umfangreiche Informationen zu den einzelnen Fällen und ermöglichen eine qualifizierte Bewertung. Im Schnitt wurden von Patienten pro Meldung mehr einzelne Reaktionen berichtet als bei Meldungen von Ärzten (5,9 zu 2,3 pro Meldung). Die Datenerfassung und Bewertung ist in einigen Fällen aufwendiger als bei Berichten von Ärzten oder Apothekern, z. B. da die geschilderten Symptome zunächst medizinisch interpretiert werden müssen, bevor die notwendige Codierung zur Erfassung erfolgen kann. Zusammenfassend zeigt die Auswertung, dass Meldungen von Patienten oder Verbrauchern wichtige Hinweise zu Sicherheitsproblemen enthalten können und somit eine wichtige Ergänzung zu den Meldungen von Ärzten und Apothekern sind. Die über die Website der Bundesoberbehörden eingegangenen Berichte sollten hinsichtlich der Datenqualität ausgewertet werden. Eventuell muss die Eingabe noch weiter an die Bedürfnisse von Verbrauchern angepasst werden. Vor diesem Hintergrund sollten die eingehenden Meldungen und das Verfahren nach einem Jahr evaluiert werden. Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) |
Es zeigten sich Unterschiede in dem, was Heilberufler an UAW wahrnehmen und was Verbraucher an sich beobachten. Während Heilberufler in erster Linie Wirkungen der Arzneimittel an messbaren Parametern beim Patienten festmachen, berichten Laien über ihre körperlichen und vor allem psychischen Belastungen und geben wichtige Hinweise auf die Lebensqualität. Dies habe nach van Hunsel bereits zu neuen, unbekannten Signalen geführt oder andere Signale verstärkt. Die Motivation für die Berichte ist in erster Linie der Wunsch, etwas Gutes zu tun. Man wolle verhindern, dass andere Menschen vergleichbare UAW erleben müssten.
Van Hunsel appellierte an die Einrichtungen aller Länder, Ergebnisse der gesammelten und ausgewerteten Verbraucherberichte über Arzneimittel zu publizieren. Denn nur so könne man das Instrument immer weiter entwickeln. Zudem sei es wichtig, dass Werbung für die Meldemöglichkeit gemacht werde, um eine ausreichende Anzahl von Meldungen auswerten zu können. Insgesamt würde sich ein solches Engagement im Sinne der Arzneimittelsicherheit lohnen, so die Lareb-Mitarbeiterin.
UAW-Meldungen auf einer privaten Internet-Plattform
Die private Internetplattform sanego.de sammelt seit 2006 Berichte der Nutzer ihrer Plattform. Seit 2010 ist dem Portal eine medizinische Redaktion zugeordnet, um Antworten auf Fragen zu geben und die Berichte zu sortieren. Damit ergibt sich die Möglichkeit einer Auswertung der Berichte, so Wolfgang Kinkel, Geschäftsführer von sanego.de. Inzwischen konnten 44.000 Berichte gesammelt werden, 68.000 Fragen wurden gestellt. 100.000 Menschen hätten sich auf der Plattform angemeldet. Zu den häufigsten Themen gehörten die Behandlung der Depression oder von Angststörungen sowie Fragen zur Empfängnisverhütung. Am häufigsten wurden die Arzneimittel Citalopram, Mirtazapin, Pregabalin, Amoxicillin und Fluoxetin angesprochen. Als häufigste UAW wurden Übelkeit, Durchfall, Unruhe, Schwitzen und Abgeschlagenheit genannt.
Der Aufbau der Meldemöglichkeit von UAW auf sanego.de wurde zunächst skeptisch betrachtet. Die Berichte seien aber in der Regel ernsthaft verfasst und meist sehr glaubwürdig. Inzwischen konnten zwei Masterarbeiten mit den Daten der Plattform erstellt werden, womit sie auch zu wissenschaftlichen Zwecken genutzt wurden.
Consumer Reporting dient der Hypothesengeneration und Signaldetektion
Ein Problem bei der wissenschaftlichen Auswertung von Online-Meldungen der Verbraucher ist der hohe Zeitaufwand, so Prof. Dr. Marion Schaefer vom Institut für Klinische Pharmakologie, Charité Berlin. Außerdem würden neue methodische Fragen bei der systematischen Auswertung aufgeworfen wie z. B. die Frage nach dem kausalen Zusammenhang zwischen gemeldeter unerwünschter Wirkung und auslösendem Arzneimittel. Insbesondere stellten neuartige, bisher nicht in der Fachinformation enthaltene UAW eine besondere Herausforderung dar. Schaefer stellte jedoch heraus, dass Patientenberichte über unerwünschte Arzneimittelwirkungen als direkte, erste Meinung von Anwendern ernst zu nehmen seien und eine Ergänzung der Meldungen durch die Angehörigen der Gesundheitsberufe darstelle. Das Consumer Reporting könne zur Hypothesengenerierung und Signaldetektion genutzt werden. Allerdings, so die Befürchtung, könne ein Missbrauch der Meldeseiten nicht ausgeschlossen werden.
Statement der AMKDie Arzneimittelkommission der Deutschen Apotheker (AMK) unterstützt das Ziel der europäischen und nationalen Behörden, die Bedeutung von Patientenmeldungen zu stärken. Nebenwirkungsmeldungen von Patienten ("patient reporting") können die Datenbasis der Bundesoberbehörden und die frühzeitige Detektion von Arzneimittelrisiken verbessern. Ungeachtet des neuen Angebotes für Patienten, bleibt für Apotheker in ihrer Funktion als Heilberufler auch laut Berufsordnungen die Pflicht, Arzneimittelrisiken zu melden, unverändert bestehen. Die AMK nimmt weiterhin alle Verdachtsfälle unerwünschter Wirkungen (UAW) von Arzneimitteln und Medizinprodukten und Hinweise auf Qualitätsmängel aus Apotheken entgegen und leitet diese an die zuständigen Behörden weiter. Patienten sollten über die Möglichkeiten der bestehenden Meldewege informiert und darauf hingewiesen werden, dass möglichst vollständige Angaben einer Meldung dem Zweck einer höheren Arzneimittelsicherheit dienen. Prof. Dr. Martin Schulz, Vorsitzender der Arzneimittelkommission der Deutschen Apotheker (AMK) |
Erfahrungen der Arzneimittelkommission der Ärzteschaft
Dr. Thomas Stammschulte, Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), stellte Beispiele von Patientenmeldungen und die damit verbundenen Vor- und Nachteile vor. Von Patienten werden andere UAW genannt als von Heilberuflern. Patienten berichten mehr als die Heilberufler unter anderem über psychische Belastungen. Am häufigsten wurden Meldungen zum Wirkstoff Levonorgestrel an die AkdÄ registriert. Es wurden aber auch unerwünschte Arzneimittelwirkungen zu Antibiotika und zu Psychopharmaka gemeldet. UAW-Berichte von Patienten machten allerdings bei der AkdÄ mit nur 1,5% (Zeitraum Mai 2007 bis Oktober 2012) einen geringen Anteil der Meldungen aus. Obschon die Erfassung und Bewertung von Patientenmeldungen aufwendiger sein könnten als bei Berichten von Heilberuflern, könnten Verbraucher wichtige Hinweise zu Sicherheitsproblemen melden.
Abschließende Bewertung steht noch aus
Mit Consumer Reporting ist in Deutschland ein neues Kapitel im Bereich Pharmakovigilanz aufgeschlagen worden. Die Zukunft wird zeigen, wie die Meldemöglichkeit von der Bevölkerung angenommen wird und welchen Wert die Berichte für die Arzneimittelsicherheit haben werden.
Anschrift der Verfasser
Dr. Andrea Wiegard
Dr. Udo Puteanus
Landeszentrum Gesundheit NRW
Von-Stauffenberg-Str. 36
48151 Münster

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.