
- DAZ.online
- DAZ / AZ
- DAZ 44/2015
- Krank durch „...
Toxikologie
Krank durch „Weichmacher“?
Wie gefährlich sind die weit verbreiteten Phthalate?

In den vergangenen Jahren haben diverse Behörden in Europa und in anderen Ländern Risikoabschätzungen durchgeführt und veröffentlicht. Im Fokus stand dabei – je nach Zuständigkeit der Institution – die Exposition über Lebensmittel, Gebrauchsgegenstände aber auch Medizinprodukte und Arzneimittel. Um zu einer fundierten Einschätzung möglicher Risiken zu gelangen, müssen alle Expositionsquellen berücksichtigt werden. Arzneimittel haben erfreulicherweise in diesem Zusammenhang heute keine wesentliche Bedeutung mehr.
Einteilung und Verwendung der Phthalate
Phthalate, auch als „Weichmacher“ bezeichnet, sind industriell hergestellte Chemikalien, die dem Polyvinylchlorid (PVC) beigemischt werden, um dem Kunststoff mehr Elastizität und Flexibilität zu verleihen. Sie binden nicht kovalent an das PVC-Polymer und gehen leicht in umgebende Gewebe oder Flüssigkeiten über [2]. Die Zusatzstoffe sind in einer Vielzahl von weiteren Produkten zu finden, z. B. in Textilien, Lebensmittelverpackungen, Kosmetika und Spielzeug. Anwendung finden sie auch bei Medizinprodukten und als Hilfsstoffe in Arzneispezialitäten. Die möglichen Expositionsquellen für den Menschen sind also vielfältig. Neben dem Verzehr von Lebensmitteln gehören auch der Gebrauch von Körperpflegeprodukten und die Einnahme von Medikamenten sowie die Exposition gegenüber Staub dazu [13].
Die Stoffklasse der Phthalate umfasst zahlreiche Substanzen, die sich in der Struktur sowie in ihren physiko-chemischen und toxikologischen Eigenschaften mehr oder weniger deutlich voneinander unterscheiden. Sie können nach der Molekülmasse der veresterten Alkohole eingeteilt werden. Zu den hochmolekularen Phthalaten zählen u. a. Diisodecylphthalat, Diisononylphthalat und Di-(2-propylheptyl)-phthalat [3].
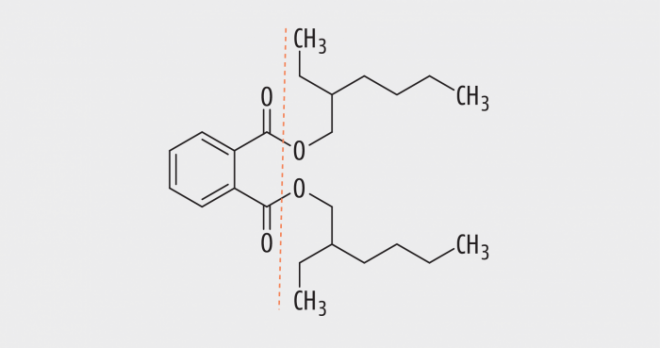
Die Gruppe der niedermolekularen Phthalate umfasst beispielsweise Di-(2-ethylhexyl)-phthalat (DEHP; Abb. 1), Dibutylphthalat (DBP), Benzylbutylphthalat (BBP) und Diisobutylphthalat (DIBP), die alle als „fortpflanzungsgefährdend“ eingestuft wurden. Von der Europäischen Chemikalienagentur ECHA wurden sie als „besonders Besorgnis erregende Stoffe“ definiert und in den Anhang XIV der REACH-Verordnung (EG) Nr. 1907/2006 eingetragen [5]. Sie unterliegen einem generellen Herstellungs- und Verwendungsverbot, welches seit dem 21. Februar 2015 in Kraft ist. Seitdem dürfen diese Stoffe erst nach Zulassung hergestellt und verwendet werden. Eine Ausnahme von der Zulassungspflicht besteht für DEHP, DBP und BBP bei Verwendung in der Verpackung von Arzneimitteln sowie bei Verwendung in Arzneimitteln [3].
Toxische Wirkungen der Phthalate
Zahlreiche Studien zu möglichen toxischen Effekten wurden weltweit durchgeführt, und die Publikationen überfluten die Datenbanken. Unter den Stichworten „DEHP“ und „toxicity“ werden in der PubMed-Datenbank mehr als 1100 Publikationen angezeigt; sucht man nach allen Phthalaten, sind es etwa doppelt so viele. Die verfügbaren Informationen stammen überwiegend aus tierexperimentellen Studien zur Toxizität oder beziehen sich auf die Exposition des Menschen – eindeutige Daten zur toxischen Wirkung der Phthalate auf den Menschen sind bis heute nicht vorhanden.
Dennoch schlagen Behörden wie ECHA und die für Lebensmittel bzw. Arzneimittel zuständigen Behörden EFSA und EMA – ebenso wie die entsprechenden Institutionen in anderen Ländern – Alarm und veröffentlichen Empfehlungen für die Restriktion oder kontrollierte Verwendung von Phthalaten in verschiedenen Bereichen. In den Köpfen vieler Verbraucher rangieren diese Stoffe damit gleich neben anderen bekannten „Giften“, obwohl ihre akute Toxizität denkbar gering ist. Dies ist ja einer der Gründe für ihren breiten Einsatz. Es sind nur sehr wenige Stoffe bekannt, die erst im Bereich von 10 Gramm pro Kilogramm Körpergewicht (!) tödlich für ein Säugetier wirken, wie dies z. B. bei DEHP der Fall ist [21]. Im Gegensatz zu anderen Chemikalien sind keine akuten Todesfälle des Menschen durch Phthalate im Zusammenhang mit einem Suizid oder aufgrund einer akzidentellen Aufnahme bekannt.
Die Gründe für diese Diskrepanz zwischen öffentlicher Wahrnehmung und konkreten wissenschaftlichen Befunden sollen in diesem Beitrag kurz angesprochen werden. Große Bedeutung für die Diskussion haben dabei die Erkenntnisse, dass im Tierexperiment reproduktionstoxische Wirkungen ausgelöst werden können und insbesondere männliche Ratten während der pränatalen Entwicklung besonders empfindlich auf Phthalate reagieren. Andere Effekte, wie z. B. die kanzerogene Wirkung, treten erst nach lebenslanger Zufuhr sehr hoher Dosen auf. Der Mechanismus, durch den einige Phthalate hepatozelluläre Karzinome verursachen können, ist nach allgemeiner Ansicht nicht relevant für den Menschen [8].
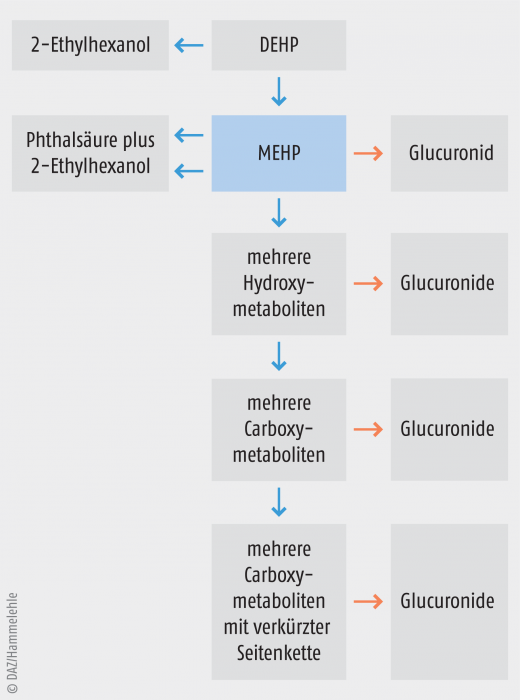
Abb. 2: Metabolismus von Diethylhexylphthalat (DEHP). DEHP wird im Darm zum biologisch aktiven Monoethylhexylphthalat (MEHP) und dieses anschließend teilweise zu Phthalsäure hydrolysiert, wobei jeweils 2-Ethylhexanol abgespalten wird (s. Abb. 1). MEHP wird mehrheitlich zu etwa 20 oxidativen Metaboliten verstoffwechselt. Bei Primaten werden sowohl MEHP als auch die oxidativen Metaboliten glucuronidiert und mit dem Urin ausgeschieden.
Reproduktionstoxische Wirkung bei Nagern
Vor dem Hintergrund der extrem niedrigen akuten Toxizität fanden die Effekte auf das Reproduktionssystem von Nagetieren, welche schon bei relativ niedrigen Dosen auftreten können, bereits vor Jahrzehnten ein erhebliches Interesse. Diverse Studien zu Effekten auf Reproduktion und Entwicklung zeigten, dass das männliche Reproduktionssystem deutlich empfindlicher auf Phthalate reagiert als das weibliche.
Bei weiblichen Ratten zeigten sich nach Exposition mit hohen Dosen DEHP (405 mg/kg KG/Tag) in utero und während der Laktationsphase keine Veränderungen im Östrus-Zyklus, im Gewicht der Reproduktionsorgane oder im Estradiol- und Progesteron-Serumspiegel. Festzustellen waren gewisse Veränderungen der Tertiärfollikel, deren Bedeutung unklar ist [19].
Im Gegensatz dazu zeigten sich bei männlichen Ratten nach prä- und postnataler Exposition mit relativ niedrigen Dosen DEHP (5 und 15 mg/kg KG/Tag) Abnormitäten der Reproduktionsorgane und beeinträchtigte testikuläre Funktionen [19]. Eine besonders empfindliche Phase der Entwicklung ist die Fetalperiode, bei Ratten etwa ab Tag 16 der Trächtigkeit [4]. Nach einer Exposition während dieser Phase wurden Veränderungen des Hodengewichts, eine verminderte Anzahl an Sertoli-Zellen, eine Leydig-Zell-Dysfunktion und die daraus resultierende veränderte Samenqualität und verringerte Testosteron-Serumspiegel festgestellt [15].
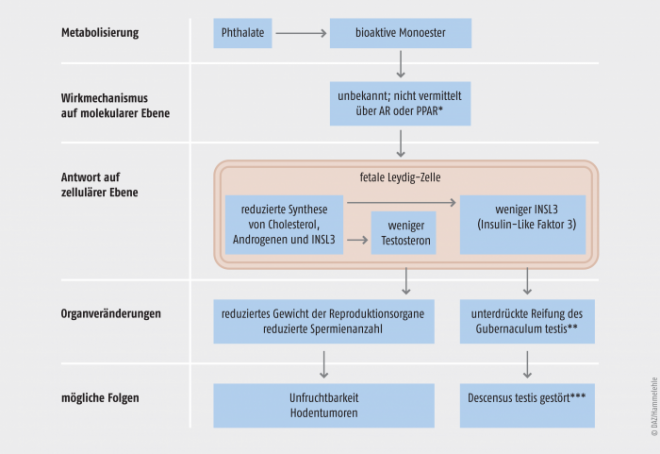
Zahlreiche Hypothesen wurden im Laufe der Zeit aufgestellt, um diese Wirkung zu erklären. Heute wird angenommen, dass vor allem die Unterdrückung der Testosteronsynthese während der Fetalentwicklung ein entscheidender Effekt ist. Die aktiven Phthalatmetaboliten beeinflussen z. B. den Cholesteroltransport und die Steroidsynthese in den Leydig-Zellen der Hoden von Rattenfeten. In der Folge kommt es zu einer Differenzierungsstörung der Androgen-abhängigen Gewebe. Entsprechende Veränderungen der Steroidsynthese wurden allerdings bei Mäusen nicht beobachtet, obwohl auch bei diesen Tieren reproduktionstoxische Effekte auftreten. Andere Mechanismen scheinen also ebenfalls von Bedeutung zu sein [18]. Die Abbildung 3 gibt einen Überblick über die Wirkungen der Phthalate bzw. ihrer aktiven Stoffwechselprodukte auf biochemischer, zellulärer und Organebene.
*** Ein gestörter Descensus testis (Hodenabstieg) hat meist einen Kryptorchismus (Hodenhochstand) zur Folge; dieser kann zu Hodenkrebs führen.
Metabolismus und Speziesunterschiede
Angesichts des Mangels an aussagekräftigen epidemiologischen Daten stützt sich eine Risikobewertung dieser Stoffe primär auf die Ergebnisse von Tierexperimenten. Ob und wie stark das Reproduktionssystem auf eine Phthalatexposition reagiert, hängt von der untersuchten Spezies ab. Die beobachteten Unterschiede sind zumindest teilweise durch Unterschiede im pharmakokinetischen Verhalten zu erklären. So gibt es z. B. erhebliche Unterschiede in der Bioverfügbarkeit von Phthalaten. DEHP wird nach oraler Aufnahme im Darm durch Lipasen zu dem aktiven Mono-(2-ethylhexyl)-phthalat (MEHP) hydrolysiert (Abb. 2). Dieser Vorgang ist bei Ratten sehr effektiv, aber bei Primaten deutlich weniger effektiv [19].
In-vitro-Studien haben gezeigt, dass die Wirkung von MEHP auf die Sertoli-Zellen im Hoden deutlich ausgeprägter ist als die von DEHP. Die reproduktionstoxischen Effekte werden also nicht durch den Stoff selbst, sondern vor allem durch dessen Metaboliten hervorgerufen. Die zahlreichen weiteren sekundären Metaboliten, die durch oxidative Reaktionen entstehen, sind nach wie vor nicht im Detail untersucht [23].
Nennenswert ist die Beobachtung, dass Phthalate bei einer Affenspezies (Callithrix jacchus, Marmoset, Weißbüschelaffe) weniger toxisch sind als bei Ratten. Marmosetten haben (im Gegensatz zu Ratten) einen Metabolismus, der dem menschlichen ähnlich ist. Beide Primaten-Spezies scheiden Glucuronide der Phthalatmetaboliten aus (Abb. 2), während die Ratte das nicht tut. Daher scheinen Marmosetten das besser geeignete Modell zu sein, um die Humantoxizität von Phthalaten zu untersuchen [15]. Allerdings sind Studien mit diesen Tieren ethisch besonders problematisch. Sie sind zudem methodisch sehr aufwendig und erfordern einen hohen finanziellen Einsatz. Aus diesen und anderen Gründen wurden bis heute keine Teratogenitätsstudien an Marmosetten durchgeführt. In der Tabelle 1 sind Daten zur akuten und chronischen Toxizität von DEHP bei Ratten und Marmosetten zusammengestellt. Die Dosierung, welche in einer Mehrgenerationen-Studie nicht mehr zu erkennbaren toxischen Wirkungen führte (no observed adverse effect level, NOAEL), beträgt 5 mg/kg Körpergewicht.
Dosis (pro Tag) |
Dauer der Verabreichung |
Effekt |
Spezies |
Jahr der Publikation |
|---|---|---|---|---|
Exposition von erwachsenen Tieren | ||||
|
10.000 bis 20.000 mg/kg KG
|
einmalig |
tödlich bei akuter oraler Gabe |
Ratte |
1945 [21] |
1000 mg/kg KG |
> 14 Tage |
leichte Atrophie der Hoden |
Ratte |
1986 [1] |
2500 mg/kg KG |
13 Wochen |
kein Effekt auf Leber oder Hoden |
Affe |
1998 [16] |
|
375 mg/kg KG 38 mg/kg KG 3,7 mg/kg KG
|
13 Wochen 13 Wochen 13 Wochen
|
hepatozelluläre Hypertrophie (beide Geschlechter); Atrophie der Hoden histologische Veränderungen in Sertoli-Zellen keine Effekte (NOAEL)
|
Ratte Ratte Ratte
|
1997 [20] 1997 [20] 1997 [20]
|
Exposition während der prä- oder postnatalen Entwicklung | ||||
405 mg/kg KG |
Gestationstag 6 – 21 |
kein Effekt auf Muttertiere; weibliche Nachkommen: erhöhte Anzahl an atretischen Tertiärfollikeln |
Ratte |
2007 [11] |
340 mg/kg KG |
2 Generationen |
Effekte auf die Entwicklung |
Ratte |
1999, Schilling et al., zitiert nach [6] |
|
14 mg/kg KG 5 mg/kg KG
|
mehrere Generationen mehrere Generationen
|
Veränderungen der Hoden keine Effekte (NOAEL)
|
Ratte Ratte
|
2003 [22] 2003 [22]
|
Leider gibt es bisher vergleichsweise wenige Daten aus Untersuchungen am Menschen. Die Ergebnisse sind keineswegs einheitlich, sondern oft widersprüchlich. Da die tierexperimentellen Daten darauf hinweisen, dass Phthalate hauptsächlich adverse Wirkung auf männliche Feten haben, fokussieren auch die meisten epidemiologischen Studien auf den Zusammenhang zwischen mütterlicher Phthalatexposition und reproduktionstoxischen Endpunkten bei männlichen Nachkommen [18].
Phthalate können bei Nagern durch ihre antiandrogene Wirkung den Anogenitalabstand beeinflussen. In den USA wurden daher in einer Studie Anogenitalabstände von Jungen und die Konzentration von Phthalatmetaboliten im Urin ihrer Mütter bestimmt. Dabei ergab sich, dass sich der Anogenitalabstand der Jungen mit steigender Konzentration an Phthalatmetaboliten im Urin der Mutter verminderte. Eine ähnliche Studie aus Taiwan zeigte dagegen keine solche Korrelation [15]. Somit besteht ein Bedarf für weitere Untersuchungen, um die Widersprüche zu klären.
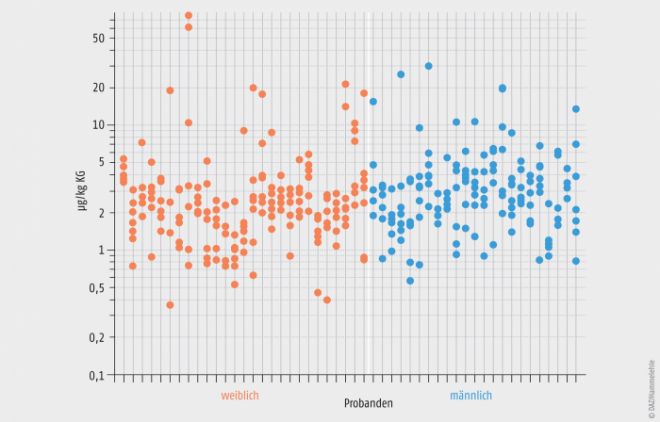
Während die Daten zur möglichen toxischen Wirkung von Phthalat beim Menschen widersprüchlich und unzureichend sind, gibt es gute Untersuchungen zur Aufnahme von Phthalat über Lebensmittel. Im Jahr 2007 wurden Lebensmittelduplikate von 27 Frauen und 23 Männern im Alter zwischen 14 und 60 Jahren über sieben Tage gesammelt und auf den Phthalatgehalt untersucht. Der ermittelte Höchstwert (Mittelwert aus sieben Tagen) liegt bei ca. 5 µg/kg Körpergewicht. Wie Abbildung 4 zeigt, ist anhand der Daten kein Unterschied in der Exposition von Frauen und Männern zu erkennen. Die Höhe der Exposition an den einzelnen Tagen variiert bei den meisten Probanden erheblich [9].
Abb. 4: Mittlere tägliche Aufnahme von Diethylhexylphthalat (DEHP) bei 27 weiblichen und 23 männlichen Probanden. Die DEHP-Gehalte der von den Probanden an sieben aufeinanderfolgenden Tagen verzehrten Lebensmittel wurden in Lebensmittelduplikaten gemessen und auf das Körpergewicht umgerechnet (µg/kg KG; jeweils sieben Punkte in einer senkrechten Linie; Skala logarithmisch). Bemerkenswert ist die hohe Variabilität der Exposition. Überwiegend liegt sie zwischen 1 und 10 µg/kg KG. Es wurden jedoch auch Mengen von weniger als 1 µg/kg KG und in zwei Fällen von mehr als 50 µg/kg KG gemessen [9].
Bewertung von DEHP durch die EFSA
Aufgrund der negativen Effekte von DEHP auf die Reproduktionsorgane männlicher Ratten veröffentlichte die Europäische Behörde für Lebensmittelsicherheit (EFSA, European Food Safety Authority) bereits im Jahr 2005 eine Bewertung. Da DEHP in Verpackungsmaterialien für Lebensmittel vorkommt, kann es leicht in die Nahrung übergehen, welche dann eine Expositionsquelle für den Menschen darstellt. Bezugnehmend auf eine Mehrgenerationen-Studie aus dem Jahr 2003 [22] (Tab. 1), die die Anforderungen der OECD-Guideline 416 erfüllt, legte die EFSA einen NOAEL von 5 mg/kg KG/Tag fest (Tab. 2). Darauf basierend und unter Berücksichtigung eines Unsicherheitsfaktors von 100 ergibt sich eine tolerierbare tägliche Aufnahme (TDI, tolerable daily intake) von 0,05 mg/kg KG. Durch die tägliche Aufnahme von DEHP über Lebensmittel liegt die Exposition bereits im Bereich des TDI. Daher empfiehlt die EFSA zusätzlich eine Expositionsabschätzung für alle möglichen Expositionsquellen [8].
Substanz |
Be-hörde |
NOAEL /LOAEL |
Unsicherheitsfaktor |
TDI bzw. PDE |
|---|---|---|---|---|
DEHP |
EFSA |
LOAEL: 5 mg/kg KG |
100 |
0,05 mg/kg KG |
DBP |
EMA |
LOAEL: 2 mg/kg KG |
200 5 für Speziesunterschiede 10 für individuelle Variabilität 4 für fehlendes NOAEL
|
0,01 mg/kg KG |
DEP |
EMA |
NOAEL: 200 mg/kg KG |
50 5 für Speziesunterschiede 10 für individuelle Variabilität
|
4 mg/kg KG |
EMA gibt Empfehlung zu Phthalaten in Arzneimitteln
Phthalate werden auch in Arzneimitteln verwendet. Hauptsächlich findet man die weichmachenden Substanzen in Magensaft-resistenten Materialien, als Bindematrix für Tabletten, in Kapseln oder Granulaten. Wegen ihrer Eigenschaft als Weichmacher können sie auch in Gelatine-Kapseln enthalten sein und werden außerdem eingesetzt, um die Viskosität von flüssigen Präparaten zu kontrollieren. Die europäische Arzneimittelagentur EMA hat fünf Phthalate bewertet:
- Dibutylphthalat (DBP), Diethylphthalat (DEP), Polyvinylacetatphthalat (PVAP), Celluloseacetatphthalat (CAP) und Hydroxypropylmethylcellulosephthalat (HPMCP) [7].
Die vorliegenden Daten zu CAP, HPMCP und PVAP lassen nicht vermuten, dass ihre Anwesenheit in Arzneimitteln ein potenzielles Risiko für den Menschen darstellt. Anders ist das hingegen bei DBP und DEP; daher sollen die zugrunde liegenden tierexperimentellen Studien im Folgenden etwas genauer beschrieben werden. Übrigens wurden Metaboliten von DBP im Fruchtwasser und in der Muttermilch in sehr geringen Konzentrationen nachgewiesen [7].
Howdeshell und Mitarbeiter verglichen die toxischen Wirkungen von sechs verschiedenen Phthalaten nach Bolusgabe per Schlundsonde. Sie konnten zeigen, dass die Gabe von DBP an trächtige Ratten an den Gestationstagen acht bis 18 eine Abnahme der fetalen Testosteronsynthese bei Dosen von 300 mg/kg KG/Tag induziert. Dipentylphthalat bewirkte eine entsprechende Veränderung bereits bei einer Dosis von 100 mg/kg; DEP beeinflusste die fetale Testosteronsynthese bis zu einer Dosis von 900 mg/kg KG/Tag dagegen nicht (!) [12].
Dieselbe Arbeitsgruppe hat auch Versuche mit der Kombination verschiedener Phthalate durchgeführt und einen Dosis-additiven Effekt auf die fetale Testosteronsynthese nachgewiesen. Die Abnahme der Testosteronsynthese erwies sich als ein guter Indikator für die morphologischen Veränderungen bei männlichen Nachkommen von Ratten, die während der Organogenese und Fetalperiode bis zum dritten Tag nach dem Werfen eine Kombination von DEHP mit vier weiteren Phthalaten erhalten hatten [12, 13].
In anderen Experimenten wurden Ratten vom Gestationstag 15 bis zum Ende der Laktationsphase mit DBP behandelt [17]. Es wurde ein LOAEL (lowest observed adverse effect level) von 2 mg/kg KG/Tag ermittelt. Von diesem LOAEL leitete die EMA für DBP eine erlaubte tägliche Exposition (PDE, permitted daily exposure) von 0,01 mg/kg KG/Tag ab, indem sie ihn durch 200 geteilt hat, das Produkt von drei Unsicherheitsfaktoren:
- Faktor 5 für die Unterschiede zwischen den Spezies,
- Faktor 10 für die individuelle Variabilität innerhalb der Spezies Mensch und
- Faktor 4 dafür, dass in der Studie keine Dosis ermittelt wurde, bei der keine Wirkung beobachtet werden konnte (NOAEL) [7].
In einer GLP-konformen Zwei-Generationen-Studie von 2005 zur reproduktiven Toxizität von DEP für Ratten wurde ein NOAEL von 3000 ppm (Gehalt im Futter) geschätzt [10]. Das entspricht ungefähr einem NOAEL von 200 mg/kg KG/Tag. Basierend auf diesem NOAEL ermittelte die EMA einen PDE von 4 mg/kg KG/Tag für den Menschen, indem sie einen Faktor 5 für Unterschiede zwischen den Spezies und einen Faktor 10 für die individuelle Variabilität einsetzte [7].
Die Empfehlung der EMA zu PDE-Werten für DBP und DEP ist seit dem 1. Juni 2015 gültig. Für bereits existierende und zugelassene Arzneimittel wird eine Übergangsfrist von drei Jahren empfohlen, um die Formulierung zu verändern [7].
Wird die Befolgung der EMA-Empfehlung ein Problem für europäische Arzneimittelhersteller?
In einem Sitzungsprotokoll des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) wurde bereits im Mai 2014 darauf hingewiesen, dass in Deutschland keine Phthalat-haltigen Arzneimittel mehr vermarktet werden. Auch in anderen europäischen Ländern scheint dies kein größeres Problem darzustellen.
In einer aktuellen Studie wurden in Großbritannien Phthalat-haltige Arzneimittel identifiziert und die Phthalataufnahme bei einer Behandlung mit den höchsten empfohlenen Tagesdosen berechnet. Ausgehend von den EMA-Richtlinien wurden insgesamt 54 Zubereitungen identifiziert, die eins oder mehrere der relevanten Phthalate enthielten. Nur bei sechs Präparaten lag der Gehalt oberhalb der behördlich empfohlenen Höchstmenge. Spitzenreiter war ein niedrig dosiertes Prednisolon-Präparat mit 2,5 mg Wirkstoff und 12 mg PVAP. Theoretisch resultiert daraus unter Annahme der empfohlenen Tageshöchstdosis von 60 mg (= 24 Tabl.) eine Zufuhr des Phthalats in Höhe von 288 mg bzw. etwa 4 mg/kg Körpergewicht bei einer 70 kg schweren Person. Nach der EMA-Empfehlung sollte die tägliche Zufuhr jedoch 2 mg/kg KG nicht überschreiten. Diese Empfehlung kann eingehalten werden, wenn stattdessen zwölf Tabletten mit 5 mg Prednisolon eingenommen werden. Die Autoren kommen zu dem Schluss, dass durch die Befolgung der EMA-Empfehlungen keine wesentlichen Probleme entstehen sollten [14].
Fazit
Es gibt nur wenige und zudem widersprüchliche epidemiologische Daten zur möglichen Wirkung von Phthalaten auf die Reproduktionsfunktionen beim Menschen. Die Risikobewertung basiert daher auf tierexperimentellen Ergebnissen. Phthalate können das Reproduktionssystem von männlichen Ratten in relativ niedrigen Dosierungen stören, dies gilt insbesondere während der pränatalen Entwicklung.
Einige Behörden, wie EFSA und EMA, haben daher versucht, ein Risiko für den Menschen abzuschätzen und durch Empfehlungen für Grenzwerte der täglichen Phthalat-Einnahme zu minimieren. Diese beiden Behörden bewerten primär die Lebensmittel und Arzneimittel, welche einen Großteil der Expositionsquellen darstellen. Um ein mögliches Risiko für den Menschen so gering wie möglich zu halten, sollten auch für andere Expositionsquellen Grenzwerte festgelegt werden, denn die Phthalate wirken additiv.
Angesichts der geringen toxischen Potenz der Phthalate im adulten Organismus sind Risiken für den Verbraucher unter den aktuellen Expositionsbedingungen nicht erkennbar. Die jetzt gültigen Grenzwerte reichen offensichtlich aus, um Risiken auf das ungeborene Kind auszuschließen, wenn eine Exposition während der Schwangerschaft erfolgt. Erfreulicherweise spielt die Aufnahme über Arzneimittel heute praktisch keine Rolle mehr. Weitere Untersuchungen zum Mechanismus der reproduktionstoxischen Wirkungen und insbesondere zur Klärung der toxikologisch relevanten Unterschiede zwischen Nagetieren und Primaten sind wünschenswert. |
Literatur
[1] Agarwal DK, et al. Effects of di(2-ethylhexyl) phthalate on the gonadal pathophysiology, sperm morphology, and reproductive performance of male rats. Environ Health Perspect 1986;65:343-50
[2] Albert O, Jégou B. A critical assessment of the endocrine susceptibility of the human testis to phthalates from fetal life to adulthood. Hum Reprod Update 2014;20(2):231-49
[3] Bayerisches Landesamt für Umwelt. Stoffinformation zu besonders besorgniserregenden Stoffen – Phthalate. Aktualisierte Version, Mai 2013
[4] Carruthers CM, Foster PM. Critical window of male reproductive tract development in rats following gestational exposure to di-n-butyl phthalate. Birth Defects Res B Dev Reprod Toxicol 2005;74(3):277-85
[5] ECHA. Candidate List of substances of very high concern for Authorisation; http://echa.europa.eu/candidate-list-table
[6] EFSA. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) on a request from the Commission related to Bis(2-ethylhexyl)phthalate (DEHP) for use in food contact materials. EFSA J 2005;243:1-20
[7] EMA. Guideline on the use of phthalates as excipients in human medicinal products. EMA/CHMP/SWP362974/2012 corr 2. Nov. 2014
[8] FDA. Safety Assessment of Di-(2-ethylhexyl)-phthalate (DEHP) Released from PVC Medical Devices, Center for Devices and Radiological Health. 2001
[9] Fromme H, et al. Intake of phthalates and di(2-ethylhexyl)adipate: results of the Integrated Exposure Assessment Survey based on duplicate diet samples and biomonitoring data. Environ Int 2007;33:1012-1020
[10] Fujii S, et al. A two-generation reproductive toxicity study of diethylphthalate (DEP) in rats. J Toxicol Sci 2005;30 (Spec No):97-116
[11] Grande SW, et al. A dose-response study following in utero and lactational exposure to di-(2-ethylhexyl) phthalate (DEHP): reproductive effects on adult female offspring rats. Toxicology 2007;229(1-2):114-22
[12] Howdeshell KL, et al. A mixture of five phthalate esters inhibits fetal testicular testosterone production in the sprague-dawley rat in a cumulative, dose-additive manner. Toxicol Sci 2008;105:153-65
[13] Howdeshell KL, et al. Dose addition models based on biologically-relevant reductions in fetal testosterone accurately predict postnatal reproductive tract alterations by a phthalate mixture in rats. Toxicol Sci 2015 Sep 8 [Epub ahead of print]
[14] Jamieson L, McCully W. Review: UK medicines likely to be affected by the proposed European Medicines Agency’s guidelines on phthalates. BMC Pharmacol Toxicol 2015;16:17
[15] Kay VR, Bloom MS, Foster WG. Reproductive and developmental effects of phthalate diesters in males. Crit Rev Toxicol 2014;44(6):467-98
[16] Kurata Y, et al. Subchronic toxicity of Di(2-ethylhexyl)phthalate in common marmosets: lack of hepatic peroxisome proliferation, testicular atrophy, or pancreatic acinar cell hyperplasia. Toxicol Sci 1998;42(1):49-56
[17] Lee KY, et al. Diverse developmental toxicity of di-n-butyl phthalate in both sexes of rat offspring after maternal exposure during the period from late gestation through lactation. Toxicology 2004;203(1-3):221-38
[18] Lioy PJ, et al. Assessment of phthalates/phthalate alternatives in children‘s toys and childcare articles: Review of the report including conclusions and recommendation of the Chronic Hazard Advisory Panel of the Consumer Product Safety Commission. J Expo Sci Environ Epidemiol 2015;25(4):343-353
[19] Martino-Andrade AJ, Chahoud I. Reproductive toxicity of phthalate esters. Mol Nutr Food Res 2010;54(1):148-57
[20] Poon R, et al. Subchronic oral toxicity of di-n-octyl phthalate and di(2-ethylhexyl) phthalate in the rat. Food Chem Toxicol 1997;35(2):225-39
[21] Shaffer CB, et al. Acute and subacute toxicity of di(2-ethylhexyl)phthalate with note upon its metabolism. J Ind Hyg Toxicol 1945:27:130-135
[22] Wolfe GW, Layton KA. Multigeneration reproduction toxicity study in rats (unaudited draft): Diethylhexylphthalate: Multigenerational reproductive assessment by continuous breeding when administered to Sprague-Dawley rats in the diet. TherImmune Research Corporation (Gaithersburg, MD), TRC Study No 7244-200, 2003
[23] Zurek M. Wirkungen der Phthalate DEHP [Di-(2-ethylhexyl)-phthalat] und MEHP [Mono-(2-ethylhexyl)-phthalat] und des Schwermetalls Cadmium auf die Zellen der Sertoli-Zelllinie SerW3. Diss. med., Berlin 2011
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.