
- DAZ.online
- DAZ / AZ
- DAZ 21/2021
- Hauttumoren im Visier
Pharmakotherapie
Hauttumoren im Visier
Teil 1: Klassische medikamentöse Behandlung
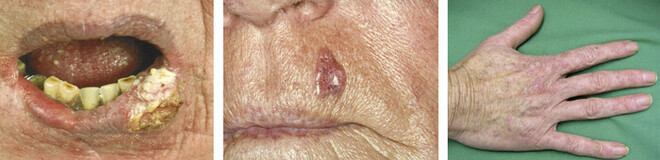
Die häufigsten Tumoren des Menschen sind einerseits Basalzellkarzinome (BCC) und andererseits Plattenepithelkarzinome (PEK) mit ihren Vorstufen, den aktinischen Keratosen (AK) (Abb. 1). Maligne Melanome neigen sehr viel häufiger zur Metastasierung und die Erkrankung nimmt dann einen schwereren Verlauf. In der konservativen Therapie der aktinischen Keratose stehen eher klassische, schon lange bekannte Pharmaka im Vordergrund. Aktinische Keratosen werden als Carcinoma in situ aufgefasst, da sie noch auf die Epidermis beschränkt sind und nicht metastasieren.
Abb. 1: Zu den häufigsten Tumorarten zählen das Plattenepithelkarzinom (links) und das Basalzellkarzinom (Mitte). Treten viele aktinische Keratosen als Vorstufe des Plattenepithelkarzinoms auf, spricht man von Feldkarzinisierung (rechts).
Eine besondere Rolle in der Therapie dieser Vorstufen des Plattenepithelkarzinoms spielt ihr Auftreten in Form einer Feldkarzinisierung [11, 69]. Sie ist Folge des flächenhaft als wichtigstes Karzinogen einwirkenden UV-Lichtes als tumorauslösende Noxe. Inzwischen ist das Auftreten dieser aktinischen Keratosen und des Plattenepithelkarzinoms bei Menschen, die aufgrund ihres Berufes besonders UV-Licht-exponiert sind, als Berufsdermatose anerkannt [12].
Chemotherapeutika zur Therapie aktinischer Keratosen
Aus der Gruppe klassischer Chemotherapeutika wird nur noch das als Antimetabolit wirkende 5-Fluoruracil (5-FU) bei aktinischen Keratosen und dem Plattenepithelkarzinom – hier auch das Prodrug Capecitabine – angewendet, während das früher beim malignen Melanom verwendete Dacarbazin, das zu den alkylierenden Substanzen zählt, aber auch die Hochdosis-Interferon-Behandlung praktisch vollständig durch BRAF-Antagonisten bzw. BRAF- in Kombination mit MEK-Inhibitoren und Immuncheckpoint-Medikamenten ersetzt wurde [46, 57]. Während bei der Entfernung einzelner Läsionen der aktinischen Keratose zumeist dermatochirurgische Eingriffe im Vordergrund stehen, gibt es mehrere Externapräparate für die Behandlung bei Feldkarzinisierungen [11, 25, 53]. Auch zur Behandlung oberflächlicher, nicht fortgeschrittener Basalzellkarzinome werden gelegentlich solche Präparate bzw. die photodynamische Therapie mit Aminolaevulinsäure-Präparaten empfohlen, sie sollten aber bei dieser Indikation sehr zurückhaltend angewendet werden, da die Sicherung einer erfolgreichen Entfernung des Basalzellkarzinoms nur mittels histologischer Kontrolle möglich ist und die erhebliche Gefahr besteht, dass einzelne tiefer lokalisierte Tumorzellen weiter zu einem dann fortgeschrittenen zumeist sklerodermiformen Basalzellkarzinom proliferieren können, die nicht selten umfassende plastisch-chirurgische Eingriffe erfordern [8, 9].
Antimetabolite
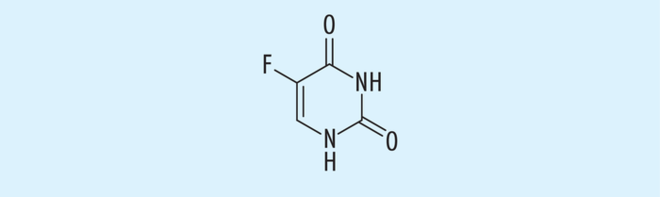
5-Fluoruracil
Das 1957 vom amerikanischen Chemiker und Onkologen Charles Heidelberger erstmals synthetisierte Fluoruracil ist ein Strukturanalogon des Pyrimidins mit einer Methylgruppe in Position 5, die durch Fluor ersetzt ist (Abb. 2) [24]. Diese Substitution verändert die Reaktivität der Substanz, nicht jedoch ihre uracilähnliche Funktion im Stoffwechselweg. Die Kohlenstofffluorverbindung ist stabiler und entzieht sich daher dem enzymatischen Abbau. Durch seine Ähnlichkeit mit natürlich vorkommenden Pyrimidinen interagiert es mit Enzymen des Pyrimidinstoffwechsels. Nach Metabolisierung zu 5-Fluoro-2-desoxyuridin-5-Phosphat (F-dUMP) hemmt es kompetitiv die Thymidylat-Synthetase und dadurch die DNS-Synthese. Zusätzlich wird Fluoruracil in die RNS eingebaut, was zu deren Dysfunktionen führt [46, 65].
5-Fluoruracil wird als 5%-ige und 0,5%ige Salbe angewendet: bei aktinischen Keratosen in Verbindung mit 10% Salicylsäuresalbe und beim Plattenepithelkarzinom oral als 5-Fluoruracil oder als Prodrug Capecitabine. Eine Zulassung besteht aber nur für die topische Anwendung von 5-Fluoruracil bei aktinischer Keratose. Auch nach topischer Anwendung wird 5-Fluoruracil resorbiert. Bei topischer Anwendung von 14C-Fluoruracil (100 mg/ml) wurde eine systemische Resorption von 6% gefunden [13].
Zur systemischen Anwendung bei fortgeschrittenem kutanen Plattenepithelkarzinom ist 5-Fluoruracil nicht zugelassen. Es gibt aber mehrere klinische Studien mit 5-Fluoruracil bzw. seinem Prodrug Capecitabine alleine oder in Kombination mit Cisplatin und Bleomycin, weiterhin gibt es Studien zur systemischen Therapie beim fortgeschrittenen Plattenepithelkarzinom der Haut mit Interferon α, 13-cis-Retinsäure, Cetuximab, Panitumumab, Gefitinib, Erlotinib und Lapatinib [38, 54]. Zugelassen wurde bislang der PD-1-Inhibitor Cemiplimab [20, 62].
5-FU wird inaktiviert durch die Dihydropyrimidin-Dehydrogenase (DPD). Es handelt sich um ein polymorph exprimiertes Enzym, weshalb inzwischen vor einer systemischen Therapie mit 5-FU bzw. Capecitabine eine Bestimmung der DPD-Aktivität gefordert wird [26, 58, 59,
71]. Auch nach topischer Gabe sind Myelosuppressionen beobachtet worden, wobei hier eine beträchtliche Dunkelziffer bestehen könnte, da die Myelosuppression erst nach mehreren Wochen der Behandlung auftritt und der dann wahrscheinlich behandelnde Internist kaum an eine ca. sechs Wochen zurückliegende Salbenbehandlung als Ursache denkt [31]. Auch Arzneimittel können die Dihydropyrimidin-Dehydrogenase hemmen, vor allem das in der Zostertherapie verwendete Brivudin, was zu tödlich verlaufenden Wechselwirkungen führen kann [48].
In einem Vergleich von 5-Fluoruracil (5%) mit Imiquimod (5%), Ingenolmebutat und einer photodynamischen Therapie mit Methylaminolaevulinat zeigte sich zwölf Monate nach Therapieende 5-Fluoruracil bei aktinischer Keratose überlegen [29]. Klinische Studien, insbesondere Vergleichsstudien bei aktinischen Keratosen sind aber stets nicht leicht zu interpretieren, da viele häufig nicht ausreichend kontrollierte Faktoren für das Ergebnis wesentlich sind. Dazu gehört etwa die Abhängigkeit von der aktuellen UV-Exposition, da selbst UV-Schutz eine Rückbildung von bestehenden aktinischen Keratosen bewirken kann [56].
Diversa
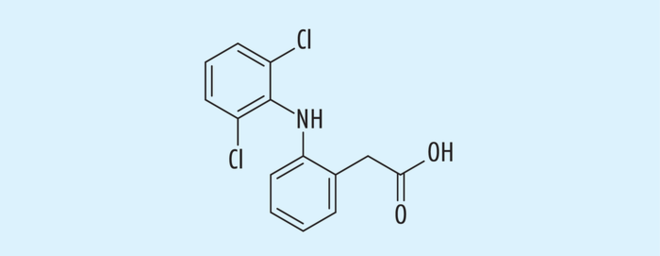
Diclofenac
Diclofenac (Abb. 3) hemmt die Cyclooxygenase (COX) 1 und 2. Nachdem z. B. in murinen Modellen gezeigt werden konnte, dass die COX-2-Hemmung ein mögliches antikarzinogenes Prinzip durch Hemmung des Tumorzellwachstums, Hemmung der Neoangiogenese und Apoptoseförderung ist, wurde es auch als 3%ige Salbe zusammen mit Hyaluronsäure zur Behandlung und Prävention von aktinischen Keratosen verwendet [47]. Die zugefügte Hyaluronsäure beeinflusst zum einen die perkutane Resorption von Diclofenac und verstärkt dessen Kumulation im Hautgewebe, sie könnte aber auch direkt Einfluss auf die antikarzinogenen Eigenschaften dieses Diclofenacpräparates haben [49]. Die Serumkonzentration nach topischer Applikation dieses Diclofenac-Präparates liegt bei ca. 1% der nach oraler Gabe beobachteten Werte [30]. Nach einer im Halbseitenversuch von Hauschild et al. durchgeführten Studie, erwies sich Diclofenac ähnlich wirksam wie 5-Fluoruracil [22].
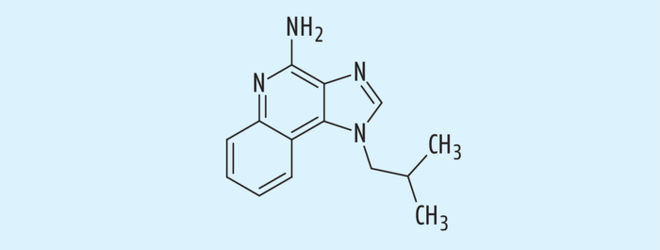
Imiquimod
Imiquimod ist ein Imidazochinolin-Amin, das aufgrund seiner immunmodulierenden Wirkung zur Behandlung von aktinischen Keratosen topisch angewendet wird [27, 50, 51] (Abb. 4). In einer kürzlich durchgeführten Vergleichsstudie mit einer 5%igen Imiquimod-Creme (Aldara®) zu 3%igem Diclofenac-Gel (Solaraze®) zeigte sich Imiquimod überlegen [21]. Auch bei oberflächigen Basalzellkarzinomen wurde Imiquimod empfohlen, hier ist aber besonders auf eine vollständige Entfernung des Basalzellkarzinoms zu achten [28, 33].
Tirbanibulin
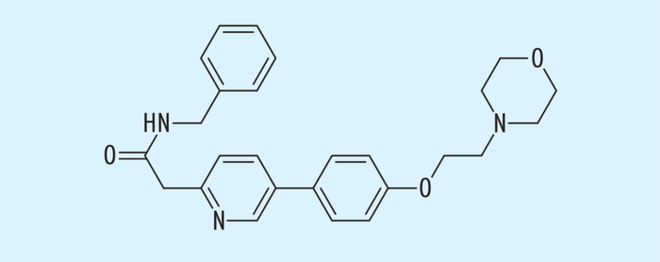
Tirbanibulin ist ein Src-Kinase-Inhibitor, der auch eine Colchicin-artige Wirkung durch Hemmung der Tubulin-Polymerisation besitzt [42] (Abb. 5). In einer kürzlich publizierten Phase-III-Studie wurde es in einer 1%igen Salbenzubereitung einmal täglich über fünf Tage bei aktinischen Keratosen mit Erfolg verwendet [7].
In Tab. 1 sind die wichtigsten topischen Präparate zur Behandlung der aktinischen Keratose zusammengefasst.
Wirkstoff | EMA-Zulassung | zugelassene Lokalisation | Fläche | Dauer der Anwendung |
|---|---|---|---|---|
5% 5-Fluoruracil | vor 1970 (BfArM) | gesamtes Integument | 500 cm2 | zwei bis vier Wochen, zweimal täglich |
0,5% 5-Fluoruracil + 10% Salicylsäure | 2011 | gesamtes Integument | bis 25 cm2 | sechs bis zwölf Wochen, einmal täglich |
3% Diclofenac mit 2,5% Hyaluronsäure | 2001 | gesamtes Integument | maximal 8 g/Tag | 60 bis 90 Tage, zweimal täglich |
5% Imiquimod | 2006 | Kopf | 5 × 5 cm | dreimal/Woche, zweimal vier Wochen |
3,75% Imiquimod | 2013 | Kopf | 200 cm2 | einmal täglich, zweimal zwei Wochen |
Tirbanibulin | keine | Kopf | 25 cm2 | einmal täglich, für fünf Tage |
5-Aminolävulinsäure
1977 wurde von David Bickers erstmalig gezeigt, dass in der Haut das gesamte Enzymspektrum vorhanden ist, um aus 5-Aminolävulinsäure (5-ALA) Porphyrine zu synthetisieren [6] (Abb. 6). Diese Beobachtung ist Grundlage für die Anwendung der 5-Aminolävulinsäure und verschiedener Derivate dieser Substanz zur Durchführung einer photodynamischen Therapie. In der Haut werden aus 5-ALA Porphyrine – unter anderem Protoporphyrin – synthetisiert. Erwünschte und unerwünschte Effekte der Behandlung sind daher nicht primär mit der applizierten Substanz, sondern erst in der Wechselwirkung dieser Porphyrine – insbesondere Protoporphyrin – mit absorbierten Licht und dabei generierten aktivierten Sauerstoffspecies verbunden [60].
Prävention
Da UV-Licht ubiquitär ist und als komplettes Karzinogen sowohl genotoxisch ist wie auch durch nicht-genotoxische Effekte die Promotion von Tumorzellen bewirken kann, ist es die primäre Ursache für die meisten Tumoren der Haut [64]. Es wird angenommen, dass 70% aller Melanome und 90% aller nicht-melanozytären Tumore – also vor allem Plattenepithelkarzinome und Basalzellkarzinome – durch UV-Licht verursacht sind. Daher steht im Zentrum der Prävention von Hauttumoren das Meiden von übermäßiger Sonnenlichtexposition einschließlich dem Tragen geeigneter Kleidung, einer Sonnenbrille (europäische Norm EN 1836) bzw. die Anwendung von Sonnenschutzsalben [64]. Aber auch Sonnenschutzmittel sind nicht unproblematisch. Sie können eine ausreichende Vitamin-D-Synthese der Haut behindern, und es wird daher zumindest bei einem Sonnenschutz mit SPF50+ eine ergänzende Vitamin-D-Substitution empfohlen [64]. Aber auch mögliche Hautresorptionen von Bestandteilen der Sonnenschutzmittel müssen insbesondere bei großflächiger Anwendung beachtet werden [43, 44].
Nicotinamid
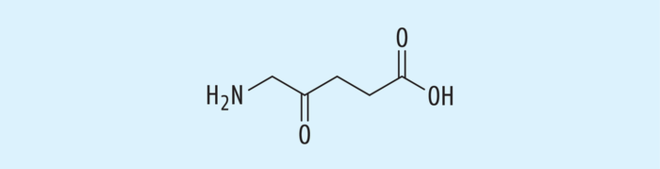
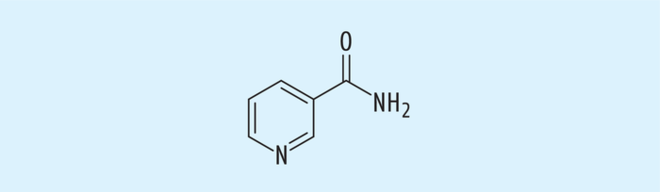
Nicotinamid wird in besonderen Fällen zur Prävention von Nicht-Melanom-Hauttumoren (NMSC) empfohlen (Abb. 7). Grundlage ist eine Studie, bei der 386 Patienten, die in den letzten fünf Jahren vor der Studie an mindestens zwei Nicht-Melanom-Hauttumoren erkrankt waren, mit zweimal 500 mg Nicotinamid/Tag behandelt wurden. Hier reduzierte sich in der Verumgruppe in zwölf Monaten das Auftreten neuer aktinischer Keratosen und Plattenepithelkarzinome um 23%, Keine signifikanten Unterschiede bestanden bezüglich der Zahl neuer Basalzellkarzinome [10].
Retinoide
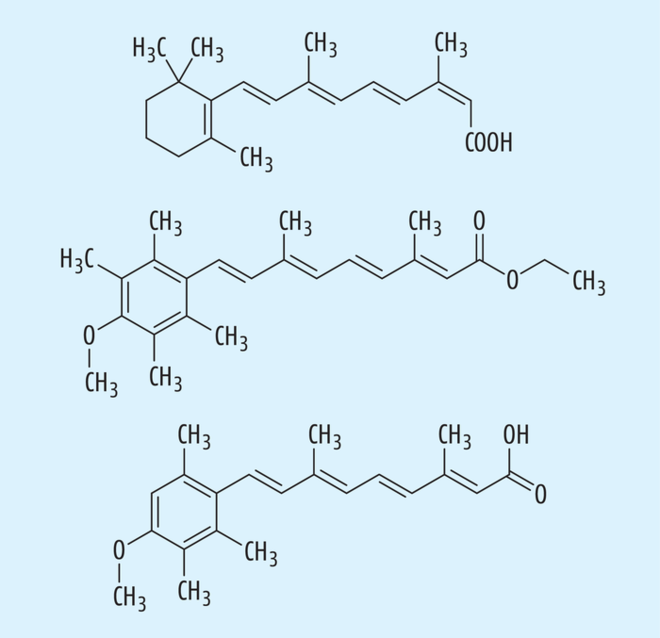
Isotretinoin, Etretinat und Acitretin wurde in mehreren Studien bei Risikopatienten mit Xeroderma pigmentosum – einer Genodermatose, die durch einen DNA-Repair-Defekt mit sich schon im Kindesalter manifestierenden Hauttumoren einhergeht – oder immunsupprimierten Patienten nach Organtransplantationen zur Prävention von Hauttumoren verwendet [1, 11] (Abb. 8). Es ließ sich insbesondere bei Patienten mit Xeroderma pigmentosum eine präventive Wirkung objektivieren bei einer allerdings zum Teil sehr hohen Isotretinoin-Dosis [34]. In einer Studie wurde bei nicht immunsupprimierten Patienten mit mehreren Plattenepithelkarzinomen und Basalzellkarzinomen in der Anamnese eine topische Anwendung versucht, die aber keine Effekte zeigte [1]. |
Literatur
[1] Amann PM, Merk HF, Baron JM. Retinoide in der Dermatopharmakologie. Hautarzt 2014;65(2):98-105
[2] Angelaki A, Lampropoulou DI, Aravantinos G. Immune-related dermatologic toxicities: to make a long story short. Cutan Ocul Toxicol 2020;39(1):10-12
[3] Athar M, Li C, Kim AL, Spiegelman VS, Bickers DR. Sonic hedgehog signaling in Basal cell nevus syndrome. Cancer Res 201415;74(18):4967-4975
[4] Barrios DM, Do MH, Phillips GS, Postow MA, Akaike T, Nghiem P, Lacouture ME. Immune checkpoint inhibitors to treat cutaneous malignancies. J Am Acad Dermatol 2020;83(5):1239-1253
[5] Bastian BC. The molecular pathology of melanoma: an integrated taxonomy of melanocytic neoplasia. Annu Rev Pathol 2014;9:239-271
[6] Bickers DR, Keogh L, Rifkind AB, Harber LC, Kappas A. Studies in porphyria. VI. Biosynthesis of porphyrins in mammalian skin and in the skin of porphyric patients. J Invest Dermatol 1977;68(1):5-9
[7] Blauvelt A, Kempers S, Lain E, Schlesinger T, Tyring S, Forman S, Ablon G, Martin G, Wang H, Cutler DL, Fang J, Kwan MR; Phase 3 Trials of Tirbanibulin Ointment for Actinic Keratosis. Phase 3 Tirbanibulin for Actinic Keratosis Group. N Engl J Med 2021;384(6):512-520
[8] Cameron MC, Lee E, Hibler BP, Barker CA, Mori S, Cordova M, Nehal KS, Rossi AM. Basal cell carcinoma: Epidemiology; pathophysiology; clinical and histological subtypes; and disease associations. J Am Acad Dermatol 2019;80(2):303-317
[9] Cameron MC, Lee E, Hibler BP, Giordano CN, Barker CA, Mori S, Cordova M, Nehal KS, Rossi AM. Basal cell carcinoma: Contemporary approaches to diagnosis, treatment, and prevention. J Am Acad Dermatol 2019;80(2):321-339
[10] Chen AC, Martin AJ, Choy B, Fernández-Peñas P, Dalziell RA, McKenzie CA, Scolyer RA, Dhillon HM, Vardy JL, Kricker A, St George G, Chinniah N, Halliday GM, Damian DL. A Phase 3 Randomized Trial of Nicotinamide for Skin-Cancer Chemoprevention. N Engl J Med 2015 22;373(17):1618-1626
[11] Cornejo CM, Jambusaria-Pahlajani A, Willenbrink TJ, Schmults CD, Arron ST, Ruiz ES. J Field cancerization: Treatment. Am Acad Dermatol 2020 Sep;83(3):719-730
[12. Diepgen TL. Neue Entwicklungen in der Berufsdermatologie. J Dtsch Dermatol Ges 2016 Sep;14(9):875-90
[13] Dillaha CJ, Jansen GT, Honeycutt WM, Bradford AC. Selective cytotoxic effect of topical 5-Fluorouracil. Arch Dermatol 1963;88:247-256
[14] Drusio C, Becker JC, Schadendorf D, Ugurel S. Merkelzellkarzinom. Hautarzt 2019;70(3):215-227
[15] Dulgar O, Kutuk T, Eroglu Z. Mechanisms of Resistance to BRAF-Targeted Melanoma Therapies. Am J Clin Dermatol 2021;22(1):1-10
[16] Dummer R, Hauschild A, Santinami M, Atkinson V, Mandalà M, Kirkwood JM, Chiarion Sileni V, Larkin J, Nyakas M, Dutriaux C, Haydon A, Robert C, Mortier L, Schachter J, Lesimple T, Plummer R, Dasgupta K, Gasal E, Tan M, Long GV, Schadendorf D. Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med 2020;383(12):1139-1148
[17] Eberlein B, Biedermann T, Hein R, Posch C. Photosensitivität unter Vemurafenib. J Dtsch Dermatol Ges 2020;18(10):1079-1084
[18] Geisler AN, Phillips GS, Barrios DM, Wu J, Leung DYM, Moy AP, Kern JA, Lacouture ME. Immune checkpoint inhibitor-related dermatologic adverse events. J Am Acad Dermatol 2020;83(5):1255-1268
[19] Geisslinger G, Menzel S. Wenn Arzneimittel wechselwirken. Wissenschaftliche Verlagsgesellschaft Stuttgart 2017
[20] Gellrich FF, Hüning S, Beissert S, Eigentler T, Stockfleth E, Gutzmer R, Meier F. Medical treatment of advanced cutaneous squamous-cell carcinoma. J Eur Acad Dermatol Venereol 2019;33(Suppl8):38-43
[21] Gollnick H, Dirschka T, Ostendorf R, Kerl H, Kunstfeld R. Long-term clinical outcomes of imiquimod 5% cream vs. diclofenac 3% gel for actinic keratosis on the face or scalp: a pooled analysis of two randomized controlled trials. J Eur Acad Dermatol Venereol 2020;34(1):82-89
[22] Hauschild A, Kähler KC, Egberts F. Modern treatment modalities in actinic keratoses of the skin. Dtsch Med Wochenschr 2006;131(9):447-452
[23] Hawerkamp HC, Kislat A, Gerber PA, Pollet M, Rolfes KM, Soshilov AA, Denison MS, Momin AA, Arold ST, Datsi A, Braun SA, Oláh P, Lacouture ME, Krutmann J, Haarmann-Stemmann T, Homey B, Meller S. Vemurafenib acts as an aryl hydrocarbon receptor antagonist: Implications for inflammatory cutaneous adverse events. Allergy 2019;74(12):2437-2448
[24] Heidelberger C. Fluorinated pyrimidines. Prog Nucleic Acid Res Mol Biol 1965;4:1-50
[25] Heppt MV, Steeb T, Szeimies RM, Berking C: Aktinische Keratosen. Hautarzt 2020;71:588-596
[26] Ikediobi O. Pharmacogenomics of Fluoropyrimidines-A Personalized Approach for Treating and Preventing Keratinocyte Carcinomas. JAMA Dermatol 2021;157(3):357-358
[27] Jacobs S, Grussendorf-Conen EI, Rösener I, Rübben A. Molecular analysis of the effect of topical imiquimod treatment of HPV 2/27/57-induced common warts. Skin Pharmacol Physiol 2004;17(5):258-266
[28] Jansen MHE, Mosterd K, Arits AHMM, Roozeboom MH, Sommer A, Essers BAB, van Pelt HPA, Quaedvlieg PJF, Steijlen PM, Nelemans PJ, Kelleners-Smeets NWJ. Five-Year Results of a Randomized Controlled Trial Comparing Effectiveness of Photodynamic Therapy, Topical Imiquimod, and Topical 5-Fluorouracil in Patients with Superficial Basal Cell Carcinoma. J Invest Dermatol 2018;138(3):527-533
[29] Jansen MHE, Kessels JPHM, Nelemans PJ, Kouloubis N, Arits AHMM, van Pelt HPA, Quaedvlieg PJF, Essers BAB, Steijlen PM, Kelleners-Smeets NWJ, Mosterd K. Randomized Trial of Four Treatment Approaches for Actinic Keratosis. N Engl J Med 2019;380(10):935-946
[30] Jarvis B, Figgitt DP. Am J Clin Dermatol. Topical 3% diclofenac in 2.5% hyaluronic acid gel: a review of its use in patients with actinic keratoses 2003;4(3):203-213
[31] Johnson MR, Hageboutros A, Wang K, High L, Smith JB, Diasio RB. Life-threatening toxicity in a dihydropyrimidine dehydrogenase-deficient patient after treatment with topical 5-fluorouracil. Clin Cancer Res 1999;5(8):2006-11
[32] Kähler KC, Hassel JC, Heinzerling L, Loquai C, Thoms KM, Ugurel S, Zimmer L, Gutzmer R für das Komitee „Kutane Nebenwirkungen“ der Arbeitsgemeinschaft Dermatologische Onkologie (ADO). Nebenwirkungsmanagement bei Immun-Checkpoint-Blockade durch CTLA-4- und PD-1-Antikörper beim metastasierten Melanom – ein Update. J Dtsch Dermatol Ges 2020;18(6):582-609
[33] Kamath P, Darwin E, Arora H, Nouri K. A Review on Imiquimod Therapy and Discussion on Optimal Management of Basal Cell Carcinomas. Clin Drug Investig 2018 Oct;38(10):883-899
[34] Kraemer KH, DiGiovanni JJ, Moshell AN, Tarone RE, Peck GL. Prevention of Skin Cancer in Xeroderma Pigmentosum with the Use of Oral Isotretinoin New Engl J Med 1988;318:1633-1637
[35] Lang BM, Balermpas P, Bauer A, Blum A, Brölsch GF, Dirschka T, Follmann M, Frank J, Frerich B, Fritz K, Hauschild A, Heindl LM, Howaldt HP, Ihrler S, Kakkassery V, Klumpp B, Krause-Bergmann A, Löser C, Meissner M, Sachse MM, Schlaak M, Schön MP, Tischendorf L, Tronnier M, Vordermark D, Welzel J, Weichenthal M, Wiegand S, Kaufmann R, Grabbe S. Basalzellkarzinom der Haut – Teil 2: Therapie, Prävention und Nachsorge. S2k-Leitlinie. J Dtsch Dermatol Ges 2019;17(2):214-231
[36] Lang BM, Grabbe S. Diagnostik und Therapie des Basalzellkarzinoms. Hautarzt 2020;71:580-587
[37] Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Rutkowski P, Lao CD, Cowey CL, Schadendorf D, Wagstaff J, Dummer R, Ferrucci PF, Smylie M, Hogg D, Hill A, Márquez-Rodas I, Haanen J, Guidoboni M, Maio M, Schöffski P, Carlino MS, Lebbé C, McArthur G, Ascierto PA, Daniels GA, Long GV, Bastholt L, Rizzo JI, Balogh A, Moshyk A, Hodi FS, Wolchok JD. Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019;381(16):1535-1546
[38] Leiter U, Gutzmer R, Alter M, Ulrich C, Meiwes A, Heppt MV, Steeb T, Berking C, Lonsdorf AS, Sachse MM, Garbe C, Hillen U. Kutanes Plattenepithelkarzinom Hautarzt 2020;71(8):597-606
[39] Leiter U, Heppt MV, Steeb T, Amaral T, Bauer A, Becker JC, Breitbart E, Breuninger H, Diepgen T, Dirschka T, Eigentler T, Flaig M, Follmann M, Fritz K, Greinert R, Gutzmer R, Hillen U, Ihrler S, John SM, Kölbl O, Kraywinkel K, Löser C, Nashan D, Noor S, Nothacker M, Pfannenberg C, Salavastru C, Schmitz L, Stockfleth E, Szeimies RM, Ulrich C, Welzel J, Wermker K, Garbe C, Berking C. J Dtsch Dermatol Ges. S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut – Kurzfassung, Teil 2: Epidemiologie, chirurgische und systemische Therapie des Plattenepithelkarzinoms, Nachsorge, Prävention und Berufskrankheit. 2020;18(4):400-413
[40] Lodde G, Zimmer L, Livingstone E, Schadendorf D, Ugurel S. Malignes Melanom. Hautarzt 2020;71(1):63-77
[41] Luke JJ, Flaherty KT, Ribas A, Long GV. Targeted agents and immunotherapies: optimizing outcomes in melanoma. Nat Rev Clin Oncol 2017;14(8):463-482
[42] Markham A, Duggan S Tirbanibulin: First Approval . Drugs 2021;81(4):509-513
[43] Matta MK, Zusterzeel R, Pilli NR, Patel V, Volpe DA, Florian J, Oh L, Bashaw E, Zineh I, Sanabria C, Kemp S, Godfrey A, Adah S, Coelho S, Wang J, Furlong LA, Ganley C, Michele T, Strauss DG. Effect of Sunscreen Application Under Maximal Use Conditions on Plasma Concentration of Sunscreen Active Ingredients: A Randomized Clinical Trial. JAMA 2019;321(21):2082-2091
[44] Matta MK, Florian J, Zusterzeel R, Pilli NR, Patel V, Volpe DA, Yang Y, Oh L, Bashaw E, Zineh I, Sanabria C, Kemp S, Godfrey A, Adah S, Coelho S, Wang J, Furlong LA, Ganley C, Michele T, Strauss DG. Effect of Sunscreen Application on Plasma Concentration of Sunscreen Active Ingredients: A Randomized Clinical Trial. JAMA 2020;323(3):256-267
[45] Menzies AM, Amaria RN, Rozeman EA, Huang AC, Tetzlaff MT, van de Wiel BA, Lo S, Tarhini AA, Burton EM, Pennington TE, Saw RPM, Xu X, Karakousis GC, Ascierto PA, Spillane AJ, van Akkooi ACJ, Davies MA, Mitchell TC, Tawbi HA, Scolyer RA, Wargo JA, Blank CU, Long GV. Pathological response and survival with neoadjuvant therapy in melanoma: a pooled analysis from the International Neoadjuvant Melanoma Consortium (INMC). Nat Med 2021;27(2):301-309
[46] Merk HF, Bickers DR. Dermatopharmakologie und Dermatotherapie. Blackwell Wissenschaft, Berlin, 1992
[47] Merk HF. COX-Antagonisten. In: Szeimies RM, Hauschild A, Garbe C, Kaufmann R, Landthaler M. Tumoren der Haut. Thieme, Stuttgart, 2010:181-184
[48] Merk HF. Arzneimittel-Wechselwirkungen in der Dermatologie. Der Deutsche Dermatologe 2018;66:918-924
[49] Merk HF. Dermatopharmakologie. Übersetzung und Ergänzung des Kap. 62 LP Fox, HF Merk, DR Bickers Dermatopharmacology in LL Brunton, JS Lazo, KL Parker (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 11. Aufl., ABW Verlag, Berlin, 2006
[50] Micali G, Lacarrubba F, Nasca MR, Ferraro S, Schwartz RA. Topical pharmacotherapy for skin cancer: part II. Clinical applications. J Am Acad Dermatol 2014;70(6):979,e1-12
[51] Micali G, Lacarrubba F, Nasca MR, Schwartz RA. Topical pharmacotherapy for skin cancer: part I. Pharmacology. J Am Acad Dermatol 2014 Jun;70(6):965.e1-12
[52] Migden MR, Rischin D, Schmults CD, Guminski A, Hauschild A, Lewis KD, Chung CH, Hernandez-Aya L, Lim AM, Chang ALS, Rabinowits G, Thai AA, Dunn LA, Hughes BGM, Khushalani NI, Modi B, Schadendorf D, Gao B, Seebach F, Li S, Li J, Mathias M, Booth J, Mohan K, Stankevich E, Babiker HM, Brana I, Gil-Martin M, Homsi J, Johnson ML, Moreno V, Niu J, Owonikoko TK, Papadopoulos KP, Yancopoulos GD, Lowy I, Fury MG. PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med 2018 Jul 26;379(4):341-351
[53] Nashan D, Hüning S, Heppt MV, Brehmer A, Berking C. Aktinische Keratosen. Aktuelle Leitlinie und praxisbezogene Empfehlungen. Hautarzt 2020;71:463-473
[54] Nehal KS, Bichakjian CK Update on keratinocyte carcinomas. N Engl J Med 2018;379:363-374
[55] Pickering CR, Zhou JH, Lee JJ, Drummond JA, Peng SA, Saade RE, Tsai KY, Curry JL, Tetzlaff MT, Lai SY, Yu J, Muzny DM, Doddapaneni H, Shinbrot E, Covington KR, Zhang J, Seth S, Caulin C, Clayman GL, El-Naggar AK, Gibbs RA, Weber RS, Myers JN, Wheeler DA, Frederick MJ. Mutational landscape of aggressive cutaneous squamous cell carcinoma. Clin Cancer Res 2014;20(24):6582-6592
[56] Reynolds KA, Schlessinger DI, Vasic J, Iyengar S, Qaseem Y, Behshad R, DeHoratius DM, Denes P, Drucker AM, Dzubow LM, Etzkorn JR, Harwood C, Kim JYS, Lee EH, Lissner GS, Marghoob AA, Matin RN, Mattox A, Mittal BB, Thomas JR, Zhou XA, Zloty D, Schmitt J, Kirkham J, Poon E, Sobanko JF, Cartee TV, Maher IA, Alam M. Core Outcome Set for Actinic Keratosis Clinical Trials. JAMA Dermatol 2020;156(3):326-333
[57] Schadendorf D, van Akkooi ACJ, Berking C, Griewank KG, Gutzmer R, Hauschild A, Stang A, Roesch A, Ugurel S. Melanoma. Lancet 2018 Sep 15;392(10151):971-984
[58] Schauder DM, Kim J, Nijhawan RI. Evaluation of the Use of Capecitabine for the Treatment and Prevention of Actinic Keratoses, Squamous Cell Carcinoma, and Basal Cell Carcinoma: A Systematic Review. JAMA Dermatol 2020, Doi: 10.1001/jamadermatol.2020.2327, Online ahead of print
[59] Schauder DM, Nijhawan RI. Pharmacogenomics of Fluoropyrimidines-a Personalized Approach for Treating and Preventing Keratinocyte Carcinomas-Reply. JAMA Dermatol 2021;157(3):358
[60] Stritt A, Merk HF, Braathen LR, von Felbert V.Photodynamic therapy in the treatment of actinic keratosis. Photochem Photobiol 2008;84(2):388-98
[61] Su F, Viros A, Milagre C, Trunzer K, Bollag G, Spleiss O, Reis-Filho JS, Kong X, Koya RC, Flaherty KT, Chapman PB, Kim MJ, Hayward R, Martin M, Yang H, Wang Q, Hilton H, Hang JS, Noe J, Lambros M, Geyer F, Dhomen N, Niculescu-Duvaz I, Zambon A, Niculescu-Duvaz D, Preece N, Robert L, Otte NJ, Mok S, Kee D, Ma Y, Zhang C, Habets G, Burton EA, Wong B, Nguyen H, Kockx M, Andries L, Lestini B, Nolop KB, Lee RJ, Joe AK, Troy JL, Gonzalez R, Hutson TE, Puzanov I, Chmielowski B, Springer CJ, McArthur GA, Sosman JA, Lo RS, Ribas A, Marais R. RAS mutations in cutaneous squamous-cell carcinomas in patients treated with BRAF inhibitors. N Engl J Med 2012;366(3):207-215
[62] Tanese K, Nakamura Y, Hirai I, Funakoshi T. Updates on the systemic treatment of advanced non-melanoma skin cancer. Front Med 2019;6:160, Doi: 10.3389/fmed.2019.00160
[63] Terheyden P, Mohr A, Langan EA. Immuncheckpointinhibition beim Merkel-Zell-Karzinom. Hautarzt 2019;70(9):684-690
[64] Trager MH, Queen D, Samie FH, Carvajal RD, Bickers DR, Geskin LJ. Advances in Prevention and Surveillance of Cutaneous Malignancies. Am J Med 2020;133(4):417-423
[65] Wellstein A, Giaccone G, Atkins MB, Sausville EA. Cyotoxic drugs. in Brunton LL, Hilal-Dandan R, Knollman BC (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 13. Auflage 2018, New York:1161-1166
[66] Wellstein A, Giaccone G, Atkins MB, Sausville EA. Pathway-targeted therapies: Monoclonal antibodies, protein-kinase inhibitors, and various small molecules. in Brunton LL, Hilal-Dandan R, Knollman BC (Eds.) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 13. Auflage 2018, New York:1167-1202
[67] Wieder T, Eigentler T, Brenner E, Röcken M. Immune checkpoint blockade therapy. J Allergy Clin Immunol 2018 Nov;142(5):1403-1414
[68] Whiteman DC, Pavan WJ, Bastian BC. The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment Cell Melanoma Res 2011;24(5):879-897
[69] Willenbrink TJ, Ruiz ES, Cornejo CM, Schmults CD, Arron ST, Jambusaria-Pahlajani AJ. Field cancerization: Definition, epidemiology, risk factors, and outcomes. Am Acad Dermatol 2020;83(3):709-717
[70] Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, Lao CD, Wagstaff J, Schadendorf D, Ferrucci PF, Smylie M, Dummer R, Hill A, Hogg D, Haanen J, Carlino MS, Bechter O, Maio M, Marquez-Rodas I, Guidoboni M, McArthur G, Lebbé C, Ascierto PA, Long GV, Cebon J, Sosman J, Postow MA, Callahan MK, Walker D, Rollin L, Bhore R, Hodi FS, Larkin J. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2017;377(14):1345-1356
[71] Rote-Hand-Brief zu 5-Fluorouracil- (i.v.), Capecitabin- und Tegafur-haltigen Arzneimitteln: Tests vor Behandlungsbeginn zur Identifizierung von Patienten mit DPD-Mangel. 4. Juni 2020, www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RHB/2020/rhb-fluorouracil.html
























2 Kommentare
Fehlerhafte Arzneistoffnamen
von J. H. am 27.05.2021 um 8:14 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Fehlerhafte Arzneistoffnamen
von Carolina Kusnick am 27.05.2021 um 9:58 Uhr
Das Kommentieren ist aktuell nicht möglich.