
- DAZ.online
- DAZ / AZ
- DAZ 11/2022
- Kettenreaktion mit ...
Analytik
Kettenreaktion mit Potenzial
Basiswissen zu PCR und anderen Nukleinsäure-Amplifikationsmethoden
Ziel der PCR ist die Vervielfältigung von definierten Teilen einer spezifischen Erbsubstanz (DNA). Bei gängigen diagnostischen Methoden ist die zu amplifizierende DNA-Sequenz in der Regel bekannt und dient als Vorlage (Template). Es gibt jedoch auch PCR-Methoden für unbekannte Sequenzen. Für jede Verstärkungsreaktion (Amplifikation) werden zwei kurze, künstlich hergestellte Startsequenzen (Primer) benötigt, welche passend an die Enden der zu vervielfältigenden DNA paaren können (Abb. 1). Hinzu kommen Nukleotide als Bausteine der DNA, welche aus den Basen Adenin, Thymin, Guanin und Cytosin bestehen, sowie hitzestabile DNA-Polymerasen. Das im Yellowstone-Nationalpark (USA) entdeckte thermophile Bakterium Thermus aquaticus spielt bis heute eine wichtige Rolle in der Molekularbiologie und der PCR, da es die Quelle der ersten hitzestabilen DNA-Polymerase – der Taq-DNA-Polymerase – ist, die auch heute noch weit verbreitet ist.
Die Probe, zusammen mit den Primern, Nukleotiden und DNA-Polymerasen, befindet sich in einer Pufferlösung, welche durch einen sogenannten Thermocycler auf die verschiedenen benötigten Temperaturen erhitzt und über definierte Perioden dort gehalten wird. Jüngste Neuerungen in der PCR-Technologie ermöglichen jedoch auch isothermale Zyklen, welche auf einen Thermocycler verzichten können.
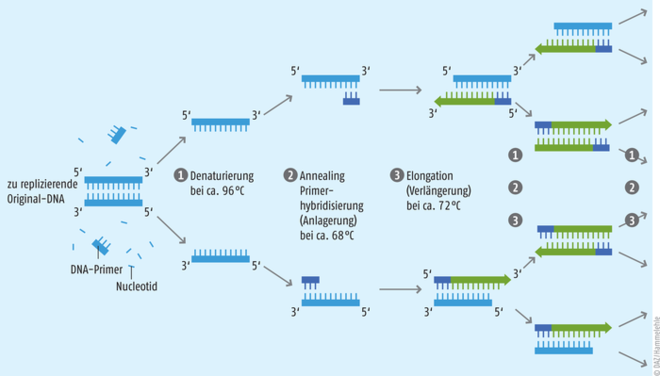
Abb. 1: Die PCR läuft in 30 bis 50 Zyklen ab. Ein Zyklus unterteilt sich in 1. Denaturierung, 2. Annealing und 3. Elongation. Erst wird auf 95 °C erhitzt, um die DNA in ihre Einzelstränge aufzutrennen (Denaturierung). Bei RNA-Viren, wie SARS-CoV-2, muss die RNA vorher noch mithilfe des Enzyms Reverse-Transkriptase in komplementäre DNA umgeschrieben werden. Dann wird auf 50 bis 60 °C abgekühlt. Die Temperatur muss geringfügig unter der Schmelztemperatur der verwendeten Primer liegen. Nun können sich die komplementären Primer an die Einzelstränge der Ziel-Sequenz anlagern. Schließlich wird die Temperatur wieder angehoben, in der Regel auf 72 °C. Da ist die Polymerase besonders aktiv. Sie baut eine Kopie der durch die Primer markierten charakteristischen DNA-Sequenz auf.
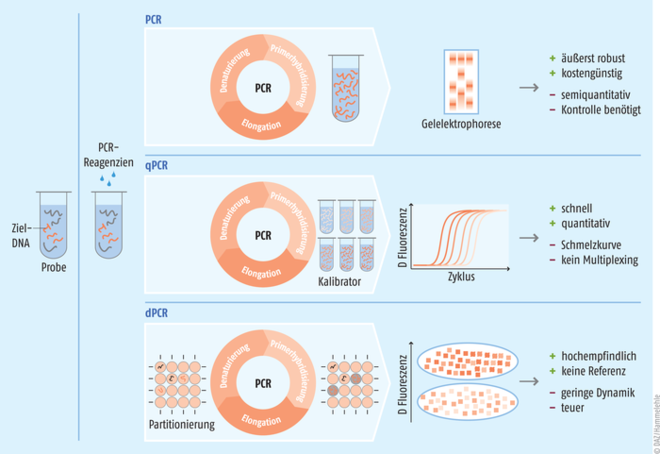
Im Laufe der Jahre und mit immer komplexer werdenden Anforderungen haben sich seit der Entdeckung der PCR verschiedene Reaktions- und Nachweisprinzipien etabliert. Die „konventionelle“ PCR (Endpoint-PCR) nutzt dabei den oben beschriebenen Ablauf und beispielhaft die Gelelektrophorese als Nachweis. Die davon abgewandelten Methoden sind als qualitative und quantitative Methoden kategorisierbar und nutzen zumeist eine Fluoreszenzmessung zum Nachweis.
Qualitative Methoden
Endpoint-PCR: Bei der konventionellen oder Endpunkt-PCR wird ein einzelnes DNA-Fragment mit spezifischen Primern in der Regel bis zur Sättigung amplifiziert und anschließend z. B. für die Genotypisierung, Klonung/Rekombinante DNA-Methode oder die Amplifikation von Vorlagen für die nachgeschaltete Sequenzierung verwendet. Das Ergebnis wird häufig durch Gelelektrophorese analysiert, bei der die amplifizierte DNA mit einem Interkalationsmittel oder einem DNA-bindenden Farbstoff angefärbt, nach Größe getrennt und mit einer Lichtquelle (und einer Kamera) sichtbar gemacht wird (Abb. 2 oben). Die PCR kann verwendet werden, um das Vorhandensein (oder Nichtvorhandensein) eines bestimmten DNA-Fragments zu bestätigen oder um spezifische DNA-Fragmente zu amplifizieren, so z. B. im Rahmen von Vaterschaftstests.
Die Endpunkt-PCR ist eine äußerst robuste, gut etablierte und häufig verwendete Labortechnik. Im Vergleich zu quantitativen PCR-Geräten (qPCR) ist der benötigte Thermocycler und die zusätzlich benötigte Laborausstattung günstig und von einer Vielzahl von Herstellern und Anbietern erhältlich. Dem entgegen steht, dass die Endpunkt-PCR bestenfalls semiquantitativ ist und bekannte DNA-Mengen als Kontrollen geladen werden müssen, um die Konzentration zu approximieren.
Reverse-Transkriptase-PCR (RT-PCR): Die Reverse Transkription ist eine alternative Methode zur Vervielfältigung von RNA-Targets für die nachfolgende Analyse. Zunächst wandelt das Enzym „Reverse Transkriptase“ die RNA-Vorlage mit Hilfe eines Primers in stabilere komplementäre DNA (cDNA) um. Die ausgewählten Primer können entweder zielspezifisch, mRNA-spezifisch oder zufällig (zufällige Hexamere) sein. Die durch die RT-Reaktion erzeugte cDNA wird dann durch PCR mit einem oder mehreren Primer-Paaren gegen die gewünschten Ziele amplifiziert.
Mit der RT-PCR ist es theoretisch möglich, fast jedes Gentranskript nachzuweisen, weshalb diese häufig bei Genexpressionsstudien Anwendung findet. Darüber hinaus wird sie auch bei Untersuchungen von Transkriptvarianten oder bei molekularbiologischen Anwendungen eingesetzt. Die Spezifität ist hoch, insbesondere wenn genspezifische Primer für die cDNA-Synthese verwendet werden.
Nachteilig ist jedoch, dass die Arbeit mit RNA ein hohes Maß an Ausbildung und Sorgfalt erfordert. RNA wird leicht durch in der Umwelt vorkommende Ribonuklease (RNase) abgebaut, ein bekanntermaßen schwer zu inaktivierendes Enzym. Um den Abbau zu verhindern, sollte Schutzausrüstung wie Laborkittel und Handschuhe getragen werden, die Proben sollten in der Regel so kalt wie möglich gelagert werden, und es sollten nur hochwertige RNase-freie Materialien, Reagenzien und Geräte verwendet werden. Die RT-PCR ist sehr empfindlich gegenüber DNA-Verunreinigungen, wobei die Endpunkt-Quantifizierung aufgrund des exponentiellen Wachstums ungenau ist.
Im Gegensatz zur Endpunkt-PCR erbringen Real-Time-PCR-Systeme die Nachweise digital während des Prozesses und nicht in einem nachfolgenden Schritt.
Quantitative Methoden
Quantitative PCR (qPCR): Die qPCR baut auf den Standard-PCR-Methoden auf. Ein komplexeres Instrument und die Einbeziehung eines doppelsträngigen DNA-bindenden Farbstoffs ermöglichen die Quantifizierung der DNA-Produktion in Echtzeit, da die Fluoreszenz bei Bindung an die Ziel-DNA dramatisch ansteigt. Diese Fluoreszenz kann dann zum Nachweis der DNA-Quantität gemessen werden, was einer absoluten Quantifizierung entspricht (Abb. 2 Mitte).
Die qPCR hat sich zu einem leistungsfähigen Instrument für die Virus- und Parasitendiagnostik entwickelt und kann für einen – im Vergleich zum Goldstandard – schnelleren Nachweis der Infektionslast von DNA-Viren und parasitären Protozoen eingesetzt werden. Die qPCR ermöglicht somit eine Quantifizierung von Ziel-DNA-Sequenzen mit hohem Durchsatz.
Insgesamt ist die qPCR deutlich teurer als die Endpunkt-PCR, sowohl was die Verbrauchsmaterialien als auch das Gerät selbst betrifft. Zudem detektieren farbstoffbasierte Methoden nicht nur das gewünschte Produkt, sondern auch unspezifische Produkte oder Primer-Dimere, was zu einer ungenauen Quantifizierung führen kann.
Quantitative PCR mit reverser Transkription (RT-qPCR): Die quantitative PCR mit reverser Transkriptase ist eine Abwandlung der bereits erläuterten qPCR und RT-PCR. Bei dieser Methode wird zunächst RNA in cDNA revers transkribiert – d.h. die Sequenzabfolge einer RNA wird in eine komplementäre DNA (cDNA) übersetzt – bevor die cDNA durch qPCR quantifiziert wird.
Seit 2020 ist die RT-qPCR die weltweit eingesetzte Methode zum Nachweis von SARS-CoV-2-RNA in klinischen Proben von Patienten mit COVID-19-Symptomen. Darüber hinaus kann RT-qPCR für die molekulare Diagnostik einer Vielzahl anderer Erkrankungen eingesetzt werden, zum Beispiel um den Erreger einer Virusinfektion aus Patientenproben nachzuweisen und zu quantifizieren.
Die Arbeit mit RNA erfordert, wie bei der RT-PCR beschrieben, eine komplexe Ausstattung. Die vergleichsweise langsamen Reaktionen laufen über ein bis zwei Stunden und erfordern teure Reagenzien und Geräte, da häufig eine RNA-Extraktion aus den Proben erforderlich ist. Zwar ist ein gewisses Multiplexing möglich, durch die begrenzte Verfügbarkeit von Reagenzien und Geräten kann es jedoch zu erheblichen Kapazitätsengpässen, wie während der COVID-19-Pandemie, kommen. Darüber hinaus kann die RT-qPCR in einigen Fällen zu empfindlich sein. Dies kann zum Beispiel bei der SARS-CoV-2-Diagnostik auch noch zu einem positiven Ergebnis führen, wenn ein Patient nicht mehr infektiös ist. Dies ist durch die hohe Sensitivität kleiner Fragmente viraler RNA der RT-qPCR begründet, welche noch einige Zeit im zuvor infizierten Patienten verbleiben kann, auch wenn keine infektiösen Virionen mehr produziert werden.
Nicht-PCR-basierte, alternative Nukleinsäure-Amplifikationsmethode
LAMP: Die schleifenvermittelte isotherme DNA-Amplifikation (Loop-mediated isothermal amplification, LAMP) ist eine relativ neue Ein-Rohr-Methode zur Amplifikation von DNA bei konstanter Temperatur unter Verwendung von zwei bis drei Primersätzen sowie einer Polymerase mit hoher Replikations- und Strangverdrängungsaktivität. Durch die isothermale Eigenschaft und dem damit verbundenen geringen Kostenpunkt sowie der hohen Replikationsrate wird LAMP vor allem in der Diagnostik eingesetzt, da es sich für einfache Point-of-Care-Screening-Tests eignet. Einige Point-of-Care-Tests für SARS-CoV-2 verwenden RT-LAMP, wofür mittlerweile CE-gekennzeichnete Tests verfügbar sind.
Das verwendete Enzym (in der Regel DNA-Polymerase von Bacillus stearothermophilus) ist resistenter gegen Inhibitoren die in komplexen Proben, wie Blut, vorhanden sind, sodass weniger Nukleinsäureextraktion und -reinigung erforderlich sind. Die Reaktion ist schnell und benötigt unter optimalen Bedingungen weniger als zehn Minuten. Das Amplifikationsprodukt lässt sich mit einer Vielzahl von Techniken leicht nachweisen und da in manchen Fällen ein Nebenprodukt aus der Lösung ausfällt bzw. diese trübt sogar visualisieren.
LAMP kann die PCR bei einer Reihe von molekularbiologischen Anwendungen, z. B. beim Klonen von Plasmiden, nicht ersetzen. Das Primerdesign ist anspruchsvoll und erfordert spezielle Software; insbesondere in der Diagnostik kann die Auswahl der Targets sehr komplex werden. Auch die unspezifische Amplifikation stellt eine große Einschränkung dar.
Geräte zur Durchführung einer PCR und Nachweiserbringung
Bei der Durchführung von PCR-Tests werden in den meisten Fällen Thermocycler genutzt. Das Funktionsprinzip der Thermocycler ist – wie der Name bereits vermuten lässt – die für den PCR-Zyklus benötigten Termperaturabfolgen einzustellen und genau zu halten. Dazu verfügen sie über einen oder mehrere Thermoblöcke (blocks) mit Löchern oder Vertiefungen (wells), in die die Probengefäße (single-use plastics) mit den PCR-Lösungen eingesetzt werden können. Der Cycler hebt und senkt dann die Temperatur des Blocks in diskreten, vorprogrammierten Schritten, welche durch den Anwender eingestellt werden bzw. als Standardroutine vorliegen. Thermocycler sind in den meisten Fällen mit einer beheizten Platte, die gegen die Deckel der Reaktionsgefäße drückt, ausgestattet. Dies verhindert die Kondensation von Wasser aus den Reaktionsgemischen an den Innenseiten der Deckel.
Ein reiner Thermocycler kann den PCR-Zyklus ablaufen lassen, besitzt jedoch keine Methode zur Auswertung. Hierfür ist ein separater Arbeitsschritt, beispielhaft durch eine Elektrophorese, notwendig. Alternativ kann der Nachweis auch durch eine Kombination mit geeigneter optischer Technologie im Thermocycler erbracht werden. Hierbei wird die Fluoreszenz des DNA-bindenden Farbstoffs gemessen. Da diese quantitative Messung über den gesamten Zyklus abläuft und darstellbar ist, werden die Thermocycler mit integrierter Messung auch als „Real-Time (quantitative) PCR-Thermocycler“ bezeichnet.
Bei einem hohen Durchsatz von Proben, z. B. bei der Wirkstoffanalyse, können PCR-Geräte durch eine zentrale Steuerung und Robotik automatisiert werden. Bei diesen sogennannten High-Throughput-Systemen werden die Probenröhrchen automatisiert durch Roboter aus einem Lager entnommen, für die Dokumentation gescannt und die DNA/RNA entsprechend extrahiert sowie gereinigt. Ebenso automatisiert werden die PCR-plastics befüllt und in die Thermocycler eingesetzt bzw. aus diesen entnommen und die Fluoreszenzmessung gestartet. Die Systeme sind zur Vermeidung von Kreuzkontaminationen meist geschlossen und mit entsprechenden Schleusen versehen. Geräte mit eingebauten Lagern für die benötigten Reagenzien und Verbrauchsmittel können so längere Zeit ohne menschliches Eingreifen operieren und kommen auf über 100 Tests pro Stunde. Durch den Kostenpunkt eines derartig komplexen und automatisierten Systems werden diese vorrangig in großen Laboratorien oder Kliniken mit entsprechendem Bedarf eingesetzt.
Die PCR wird konstant weiterentwickelt und von Innovationen begleitet, sodass zukünftig weitere Methoden und Gerätegruppen relevant werden könnten. Als Beispiel hierfür sei die digitale PCR (dPCR) genannt, welche die DNA-Moleküle in eine Vielzahl kleiner Gefäße vereinzelt und dort direkt nachweist und absolut quantifiziert, wodurch sie als SI-rückführbares primäres Referenzmessverfahren infrage kommen wird (Abb. 2 unten).
Point-of-Care-Testing
Ein Gegenstück der vollautomatisierten PCR Geräte mit hohem Durchsatz sind kleinere und einfach handhabbare Geräte für die patientennahe Diagnostik außerhalb großer Laboratorien für das Point-of-Care-Testing (POCT).
Hierbei werden keine Probengefäße mit einer Vielzahl von wells sondern Kassetten- oder Chipsysteme genutzt. In diese wird die Probe des Patienten zusammen mit einer Lyse-Lösung pipettiert und dort ggf. mit weiteren Reagenzien gemischt. Die vorbereiteten Kassetten/Chips werden dann in das POCT-Gerät gesteckt und der LAMP bzw. (RT-)PCR-Zyklus für den entsprechenden Nachweis gestartet. Die POCT-Methode stellt somit geringere Anforderungen an den Anwender in Bezug auf Arbeitsaufwand und benötigte Kenntnisse, es können jedoch auch nur Targets nachgewiesen werden, für welche geeignete Kassetten bzw. Chips für das jeweilige Gerät verfügbar sind.
Typischerweise haben POCT-Geräte eine limitierte Anzahl an Einschüben für Kassetten oder Chips. Durch die begrenzte Anzahl der Einschübe ist die benötigte Laufzeit pro Test besonders zu beachten, insbesondere da diese bei den marktverfügbaren Geräten erheblich zwischen 15 bis 90 Minuten pro Test variiert. Somit besitzen POCT-Geräte in den meisten Fällen wesentlich geringere Testkapazitäten als qPCR/dPCR Geräte.
Die Wahl des geeigneten Gerätes
Vor der Auswahl der PCR-Methode und des entsprechenden Thermocyclers bzw. Systems sollten das Einsatzgebiet sowie die Ziele eruiert werden. Dabei steht die Festlegung von nachzuweisenden Erregern/Targets sowie die Abschätzung des benötigten Probendurchsatzes im Vordergrund. Bei der Auswahl der Erreger und DNA-Targets ist festzulegen, ob nur spezifische DNA/RNA, wie beispielhaft Influenza- und SARS-CoV-2-Viren, nachgewiesen werden sollen oder die Targets flexibel ausgewählt und ggf. auch seltene bzw. unbekannte Targets relevant sind. Für den Probendurchsatz sind bei Thermocyclern die Anzahl der wells sowie die Erhitzungsgeschwindigkeit relevante Parameter. Für Flexibilität können austauschbare Blöcke mit unterschiedlicher Anzahl an wells sowie variable Temperaturbereiche innerhalb eines Blockes sorgen. Bei POCT-Geräten wird dies durch die Anzahl der Einschübe und die Verfügbarkeit geeigneter Chips oder Kassetten bedingt.
Weitere Auswahlkriterien sind der Formfaktor bzw. die Mobilität des Geräts und eine mögliche Integration in den Workflow über scannbare Strich- oder QR-Codes und entsprechende Datenanbindungen an zentrale Systeme. Der gewünschte Kostenrahmen ist letztendlich das grundlegendste Entscheidungsmerkmal.
Endpunkt PCR-Thermocycler | Standard quantitative PCR-Systeme | vollautomatisierte PCR-Systeme | Point-of-Care-Testing (POCT-PCR) | |
|---|---|---|---|---|
Methodik | PCR | qPCR, RT-qPCR | qPCR, RT-qPCR | LAMP, RT-PCR |
Proben-Durchsatz | ++ | +++ | ++++ | + |
Genauigkeit | ++ | +++ | ++++ | + |
Handhabung* | ++ | ++ | +++ | ++++ |
kompakte Bauweise | ++++ | ++ | + | ++++ |
Preis | +++ | ++ | + | ++ |
typische Einsatzorte | weit verbreitet | Labore, Kliniken | große Zentrallabore | Gesundheitseinrichtungen, Behörden |
* Schließt benötigte Kenntnisse zur Anwendung mit ein Bewertungsschema: + (schlecht) bis ++++ (sehr gut) | ||||
PCR – eine Technologie für alle Umstände?
Die PCR Technologie hat in den vergangenen Jahren maßgebliche Fortschritte sowie Innovationen erlebt und gleichzeitig bewiesen, dass sie in kürzester Zeit verlässliche Nachweise erbringen kann. Dadurch sind PCR-Tests zu einer wichtigen Säule beispielsweise in der Bekämpfung der Corona-Pandemie geworden. Durch die gesunkenen Kosten der Geräte sowie neue Methoden und einfachere Systeme wird dieser Stellenwert auch in künftigen Endemien und Pandemien erhalten bleiben und ggf. auch bei weniger akuten Erkrankungswellen im größeren Maßstab Anwendung finden.
Insbesondere das Point-of-Care-Testing (POCT) ist ein interessanter Ansatzpunkt für Gesundheitseinrichtungen wie Apotheken, welche auch ohne umfänglich ausgestattetes Labor und speziell ausgebildetes Personal solche Tests zukünftig anbieten möchten. Die kompakten Geräte sind in bestehende Arbeitsumgebungen gut integrierbar und leiten den Anwender in den meisten Fällen durch den Prozess. So können Nachweise für einzelne Pathogene, wie Viren und Bakterien, in mäßiger Kapazität unkompliziert erbracht werden.
Für Einrichtungen, die sich mehr Flexibilität bezüglich der Targets oder der Kapazität wünschen, sind auch Endpunkt-PCR-Thermocycler oder Real-Time quantitative PCR-Systeme eine valide Option. Hierbei ist jedoch zu beachten, dass durch notwendige manuelle Vorarbeiten wie Pipettieren, Reinigen und Extraktion wesentlich höhere Ansprüche an die Arbeitsumgebung und die Kenntnis des Personals gestellt werden. Bei unsachgemäßer Durchführung steigt das Risiko einer Kreuzkontamination und falscher Ergebnisse. Im Vergleich zur Endpunkt-PCR lassen sich Real-Time quantitative PCR-Systeme besser in den Workflow integrieren, da der Nachweis digital während des Prozesses erbracht wird und nicht in einem nachfolgenden Schritt erbracht werden muss.
Vollautomatisierte Systeme sind zumeist nur für Einrichtungen mit einer hohen Proben-Durchlaufmenge eine wirtschaftliche Lösung.
Mit der Auswahl einer geeigneten Methode bzw. eines Gerätes stellen PCR-Tests eine sowohl versorgungstechnisch wie auch wirtschaftlich spannende Möglichkeit für patientenferne und -nahe Einrichtungen dar. |


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.