
- DAZ.online
- DAZ / AZ
- DAZ 19/2022
- Der Piks gegen Tumoren
Medizin
Der Piks gegen Tumoren
Wie man mit mRNA-Vakzinen versucht, Krebs zu besiegen
Als William B. Coley 1891 einem Krebspatienten erstmals den Erysipel-Erreger Streptococcus pyogenes in den Tumor injizierte, ahnte er sicher nicht, dass er eines Tages als „Vater der Krebsimmuntherapie“ gelten würde. Seine Intention war es lediglich, schwer erkrankten Krebspatienten zu helfen. Inzwischen hat sich die onkologische Immuntherapie neben der Radiotherapie, Chemotherapie und Chirurgie in der Behandlung von Tumoren fest etabliert. Neben der Entwicklung von monoklonalen Antikörpern (z. B. Cetuximab, Rituximab, Trastuzumab), CAR-T-Zell-Therapien und Immuncheckpoint-Inhibitoren konzentrierte sich die Forschung vor allem auf therapeutische Krebsimpfstoffe. Anders als präventive Impfstoffe gegen viral bedingte Krebsarten (z. B. Gardasil® gegen Gebärmutterhalskrebs, Hepatitis-B-Vakzinen gegen Hepatitis-B-verursachten Leberkrebs) sollen sie nicht die Erkrankung verhindern, sondern Immunreaktionen gegen den bereits bestehenden Tumor auslösen.
Das Prinzip
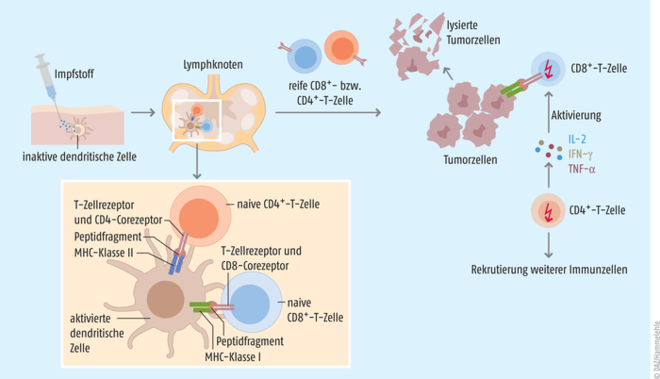
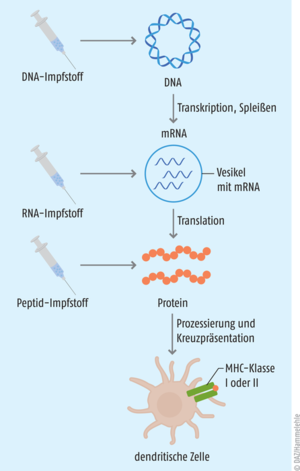
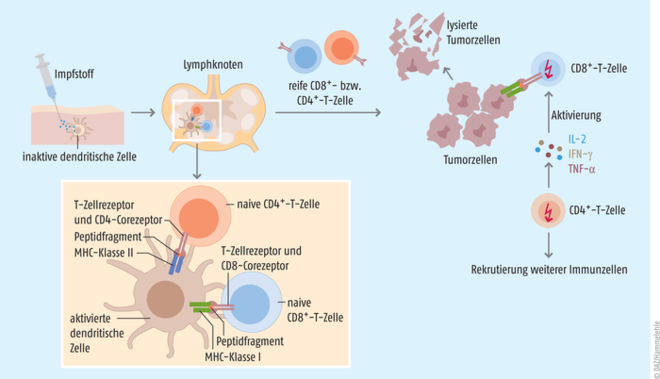
Grundgedanke ist, dass man dem Körper gezielt ein Tumor-Antigen zuführt. Das Immunsystem setzt sich mit dem Antigen auseinander und wird dahingehend trainiert, die gleichen Strukturen auf den Zelloberflächen des Tumors wiederzuerkennen und diesen zu bekämpfen (s. Abb. 1) [1, 2]. Der Erfolg einer therapeutischen Krebs-Vakzine hängt in großem Maße von der Immunogenität des tumoralen Antigens ab, das im besten Fall beide T-Zell-Populationen induziert. Gleichzeitig muss eine geeignete Impfstoffplattform und Applikationsroute gewählt werden, damit das Antigen auch am Zielort, den dendritischen Zellen in der Tumormikroumgebung oder in den Tumor-nahen lymphatischen Organen, ankommt. Da die Injektion kompletter Tumorzellen die Entnahme größerer Tumormengen erfordert und so ein Metastase-Risiko birgt, ist man in der Forschung dazu übergegangen, die tumoralen Antigene entweder in Form eines gentechnisch hergestellten Peptids oder als entsprechend codierende DNA oder RNA dem Körper zuzuführen (s. Abb. 2).
Abb. 1: Nachdem der Impfstoff in den Körper des Patienten injiziert wurde, erkennen Antigen-präsentierende Zellen das exogene Antigen und nehmen es in die Zelle auf. Dort wird es in kleinere Peptide geschnitten. In den Lymphknoten werden anschließend kürzere Peptide (8 bis 12 Aminosäuren) über MHC-Klasse-I-Proteine an naive CD8+-T-Zellen, längere Peptide (12 bis 25 Aminosäuren) über MHC-Klasse-II-Proteine an naive CD4+-T-Zellen präsentiert und bei entsprechender Erkennung über den jeweiligen T-Zell-Rezeptor aktiviert. Die reifen CD8+-T-Zellen (zytotoxische T-Zellen) erkennen beim Absuchen der Zelloberflächen den Tumor und initiieren dort über die Ausschüttung von Perforin, Granzymen und inflammatorischen Mediatoren die Zerstörung der Tumorzellen. Die aktivierten CD4+-T-Zellen (T-Helferzellen) hingegen setzen Zytokine wie Interferon γ (IFN-γ), den T-Zell-Wachstumsfaktor Interleukin 2 (IL-2) und TNF-α frei, um so das Wachstum und die Proliferation der CD8+-T-Zellen zu verstärken. Bei der Lyse der Tumorzellen werden weitere Antigene frei, die wiederum neue Antigen-präsentierende Zellen aktivieren und antitumorale Immunantworten initiieren [nach 1, 3].
Viele Vorteile …
Gegenüber anderen Impfstofftypen bieten Nukleinsäure-Vakzinen – also solche, bei denen die codierende RNA bzw. DNA verimpft wird – einige Vorteile: Sie können schnell, kostengünstig und in großen Mengen hergestellt werden, was sich insbesondere bei der Entwicklung der mRNA-basierten COVID-19-Impfstoffe als entscheidender Benefit erwies. Zudem ist es möglich, gleichzeitig mehrere Antigene in die dendritischen Zellen einzubringen und so die Gefahr für Toleranzentwicklung des Tumors zu senken. Gentechnologisch hergestellte Impfstoffe sind frei von protein- und virusbedingten Verunreinigungen und sind damit potenziell gut verträglich [4]. Standen früher noch die DNA-Impfstoffe im Fokus der Wissenschaft, da sie im Vergleich zu mRNA weniger instabil sind und nach der Applikation eine geringere intrinsische angeborene Immunantwort auslösen, so hat sich diesbezüglich das Blatt gewendet: Heute werden mRNA-Impfstoffe vor allem dafür geschätzt, dass sie lediglich in das Zytoplasma gelangen müssen, dann aber sowohl von sich teilenden als auch nicht teilenden Zellen translatiert werden. Zudem verläuft die Proteinexpression von mRNA-Impfstoffen nach der Applikation in der Regel in einem höheren Ausmaß und deutlich schneller als die der DNA-Impfstoffe. Ein weiterer entscheidender Vorteil, der viele Kritiker überzeugt hat, ist, dass mRNA im Gegensatz zu DNA nicht in die Wirtsgenomsequenz integriert werden kann. Nach der Translation verbleibende mRNA-Vorlagen werden durch normale physiologische Prozesse abgebaut, sodass auch das Toxizitätsrisiko durch Metaboliten relativ gering ausfällt. Aktuell befinden sich mehr als 20 mRNA-basierte Krebsimpfstoffe in der klinischen Prüfung [5].
… aber auch Nachteile
Die wichtigste Einschränkung der mRNA-Impfstoffe ist die niedrige Transfektionseffizienz (also die Menge Nukleinsäure, die tatsächlich in die dendritische Zelle hineingelangt), die zum einen durch die instabile Natur der mRNA, aber auch durch deren verstärkten Abbau durch extrazelluläre RNAsen bedingt ist. Beide Faktoren führen zu einer reduzierten Präsentation des Antigens über die MHC-Proteine an T-Zellen und damit zu einer verminderten Immunogenität der Impfstoffe [4]. Außerdem weist mRNA eine natürliche intrinsische Immunogenität auf (s. Kasten „Die Frage nach dem Adjuvans“). Das bedeutet, dass sie nach der Applikation von verschiedenen Mustererkennungsrezeptoren in den Antigen-präsentierenden Zellen erkannt wird. Um den Körper zu schützen, wird dann die Translation der mRNA blockiert. Die im Endosom (membranumschlossenes Vesikel, das bei der Endozytose in den dendritischen Zellen entsteht) lokalisierten Mustererkennungsrezeptoren (v. a. TLR 7 und 8) aktivieren zudem den Typ-1-Interferonsignalweg, der wiederum eine paradoxe Wirkung auf die Impfstoffe hat. Zum einen verstärken Typ-1-Interferone die Aktivierung und Reifung der dendritischen Zellen sowie die Antigen-Präsentation, die Immunogenität des Impfstoffs nimmt zu. Zum anderen wird über Interferone das angeborene Immunsystem induziert – die mRNA induziert also paradoxerweise ihren eigenen Abbau. Hinzuweisen ist an dieser Stelle, dass auch doppelsträngige RNA, die als Verunreinigung nach der Herstellung verbleibt, die Aktivität des angeborenen Immunsystems verstärkt. Daher kommt der Aufreinigung der mRNA-Impfstoffe eine besondere Bedeutung in der Herstellung zu. Wie genau der Zusammenhang zwischen Interferon-1-Signalweg und T-Zell-Aktivierung vonstattengeht, ist noch immer in der Diskussion. Klar ist jedoch, dass man durch ausreichend gereinigte mRNA, spezielle Modifikationen der mRNA sowie optimierte Transportvehikel eine erhöhte Immunogenität erreichen kann, auf die im Folgenden näher eingegangen werden soll.
Die Frage nach dem Adjuvans
Viele Wissenschaftler gehen davon aus, dass durch die natürliche intrinsische Immunogenität der mRNA auf ein Adjuvans verzichtet werden kann. Andere hingegen sehen die Zugabe eines Adjuvans als zwingend notwendig an. So auch die Firma Curevac, die einen speziellen RNA/Protamin-Komplex als Adjuvans entwickelt hat, der die Toll-like-Rezeptoren TLR7/8 aktivieren und damit die T-Zell-Antwort verstärken soll. Aktuell laufen etliche Studien, die diese Frage klären sollen.
mRNA-Modifikationen verbessern Immunogenität
Wie oben beschrieben, muss für die Präsentation über MHC-Proteine in den dendritischen Zellen die mRNA zunächst in das entsprechende Antigen-Protein translatiert werden.
Für die Therapie genutzt werden können:
- nicht replizierende, unmodifizierte mRNA
- nicht replizierende, modifizierte mRNA
- von Viren abgeleitete selbstamplifizierende RNA
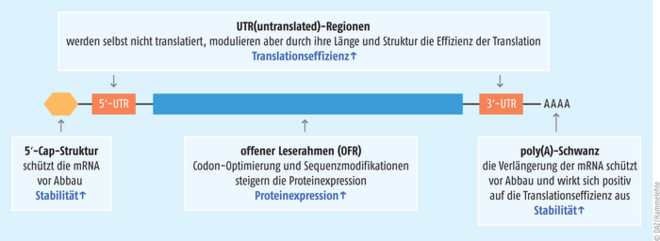
Verschiedene Modifikationen an der RNA können die Translationsrate verbessern. So verhindert eine am 5‘-Ende angebrachte 5‘-Cap-Struktur (ein N7-methyliertes Guanosin, s. Abb. 3), dass die mRNA von Mustererkennungsrezeptoren erkannt wird und infolgedessen der Interferon-1-Signalweg aktiviert wird. Am anderen Ende der mRNA wird oft ein sogenannter poly-(A)-Schwanz geknüpft, der zum einen den Abbau durch extrazelluläre RNAsen verlangsamt, aber auch – in Abhängigkeit seiner Länge – die Stabilität der mRNA sowie deren Translationseffizienz erhöht. Ähnliche Funktionen haben die untranslatierten Regionen (UTR) rechts und links vom offenen Leserahmen (OFR), der für die eigentliche Zielantigen-Sequenz codiert. Grundsätzlich muss aber auch eine zu hohe Translationsrate vermieden werden, da sonst ggf. falsch gefaltete Proteine entstehen. Zusätzlich werden bei der modifizierten mRNA anstatt des natürlichen Uridins und Cytidins alternative Nukleotide (z. B. Pseudouridin, Methylpseudouridin und Methylcytidin) eingesetzt. Auch sie erschweren die Erkennung der mRNA an den Mustererkennungsrezeptoren und erhöhen so die Stabilität und Translation der mRNA.
Abb. 3: Verschiedene Modifikationen der mRNA tragen zu deren verbesserten Stabilität und Translation bei (nach [Kim et al. 2021 Mol & Cell Tox])
Selbstamplifizierende RNA (saRNA), die aus positiv-einzelsträngiger RNA aus Viren gewonnen wird, punktet vor allem dadurch, dass mehr Antigen nach der Applikation translatiert wird. Dies wird erreicht, da bei der saRNA zwei offene Leserahmen enthalten sind: Einer, der für das gewünschte Antigen codiert, der zweite codiert die virale Replikationsmaschinerie. Nach der Translation entsteht so eine eigene „Produktionsmaschine“, die bis zu zwei Monate das gewünschte Antigen produziert. So kann mit einer relativ geringen Impfdosis eine zehnfach höhere Antigen-Expression im Vergleich zur normalen/modifizierten mRNA erreicht werden. Zwar hat das Prinzip der saRNA gerade im Bereich der infektiösen Erkrankungen vielversprechende klinische Ergebnisse geliefert, im Bereich der Krebsforschung laufen aktuell jedoch nur wenige, und vor allem noch präklinische Versuche. Begründet wird das insbesondere dadurch, dass der klinische und immunologische Benefit immer noch kontrovers diskutiert wird. Auch aktiviert saRNA besonders stark die Mustererkennungsrezeptoren. Die daraus folgende Zytokinausschüttung ist nur schwer zu regulieren, was eine wiederholte Therapie mit saRNA-Impfstoffen, wie sie bei der Krebstherapie notwendig ist, schwierig erscheinen lässt.
Auf das Vehikel kommt es an
Für eine effiziente Aufnahme der mRNA in die dendritische Zelle müssen vor allem die Größe, die Form und die Oberflächenladung des Trägersystems optimal ausgewählt werden (s. Kasten „Eigenschaften von Trägersystemen“).
Eigenschaften von Trägersystemen
Größe
Partikel mit einer Größe zwischen 20 und 45 nm sind optimal, um signifikant in den Lymphknoten transportiert und von den dendritischen Zellen aufgenommen zu werden. Kleinere Partikel unter 10 nm werden hingegen nicht effizient internalisiert.
Form
Im Vergleich zu kubischen, stäbchen- oder scheibchenförmigen Partikeln werden kugelförmige Partikel am besten internalisiert.
Oberflächenladung
Neutral geladene Partikel weisen im Vergleich zu geladenen Partikeln nur eine minimale zelluläre Interaktion auf. Dagegen werden positiv geladene Teilchen durch die elektrostatische Anziehung der negativ geladenen Gruppen auf der Zelloberfläche der dendritischen Zellen besonders effizient internalisiert. Aber auch negativ geladene Transportpartikel werden nicht abgestoßen, sondern in die Zelle aufgenommen. In Studien reicherten sich schwach negativ geladene Nanopartikel auf Chitosan- oder Mizellenbasis sogar tendenziell besser in Tumoren an als positiv geladene Moleküle. Prinzipiell ist jedoch zu beachten, dass sich Blutbestandteile an die Oberflächen der Nanopartikel anlagern und so deren Polarität ändern können. Dementsprechend können die In-vitro-Eigenschaften eines Transportpartikels deutlich von den In-vivo-Eigenschaften abweichen [6].
Um die von Natur aus instabile mRNA optimal zu schützen und an ihren eigentlichen Zielort zu bringen, stehen verschiedene Transportvehikel zur Verfügung:
- Liposomen
- polymerbasierte mRNA-Transportsysteme
- peptidbasierte Transportsysteme
- andere Formulierungen
Besonders Liposomen (mizellar aufgebaute kugelförmige Vesikel, die der Zellmembran ähneln) – auf die im Folgenden näher eingegangen werden soll – haben sich in klinischen Studien mit mRNA-Impfstoffen als nützlich erwiesen. Bei der systemischen Zirkulation lagern sie sich bevorzugt in Leber und Milz ab, also den beiden Organen, die wichtig für die RNA-Internalisierung in Antigen-präsentierenden Zellen und die T-Zell-Aktivierung sind [7, 8]. Auch die beiden mRNA-COVID-19-Impfstoffe von Biontech/Pfizer und Moderna nutzen dieses Transportvehikel. Ihr Aufbau besteht generell aus:
- ionisierbaren Lipidmolekülen: Sie weisen in der Regel mehrere ionisierbare Amine (hydrophiler Teil) und Kohlenwasserstoff-Ketten (hydrophober Teil) auf (s. Abb. 4).
- Hilfsphospholipiden: Sie stabilisieren die Vesikel.
- Cholesterol: Es stabilisiert die Vesikel.
- Lipid-verankertem Polyethylenglykol (PEG): Es verringert die Erkennung durch das unspezifische Immunsystem und verlängert so die Plasmazirkulationszeit. Jedoch besteht bei wiederholter Gabe von pegylierten Nanopartikeln die Gefahr, dass Anti-PEG-Antikörper gebildet werden, die nach der Applikation zu allergischen Reaktionen führen (s. DAZ 2021, Nr. 5, S. 46, Tony Daubitz, „Überreagiert? Polyethylenglykole und ihr allergenes Potenzial in Impfstoffen“). Vielversprechende PEG-Alternativen sind das Selbstmarker-Protein CD47 sowie Aminosäuren, die PEG imitieren [6]. Durch die Lipidverankerung verhindert PEG außerdem die Partikelaggregation und sorgt somit für eine bessere Lagerstabilität der Liposomen.
Hauptbestandteil der Liposomen sind die ionisierbaren Lipidmoleküle. Im physiologischen pH-Wert liegen sie neutral geladen vor und weisen so eine gute Stabilität und geringe systemische Toxizität auf. Wenn im sauren pH-Wert hingegen die Aminogruppen protoniert sind, verbessert dies die Verkapselung der negativ geladenen mRNA im Inneren der Vesikel durch elektrostatische Wechselwirkung. Außerdem reagieren die protonierten Aminogruppen im sauren Endosom besser mit der negativ geladenen Membran, wodurch die Destabilisierung und Fusion der Lipidnanopartikel mit der endosomalen Membran und die Freisetzung der mRNA ins Zytosol erleichtert wird.
Alle Liposomenbestandteile sollten grundsätzlich metabolisierbar sein und schnell abgebaut werden. Dies ist insbesondere deshalb wichtig, da therapeutische Krebsimpfstoffe wiederholt injiziert werden müssen und die potenzielle systemische Toxizität so niedrig wie möglich gehalten werden sollte. Aktuell wird vor allem am Aufbau der ionisierbaren Lipide und an der Säuredissoziationskonstante (pKa) der Aminogruppen gefeilt, um sowohl die Metabolisierung als auch die fusogenen Eigenschaften der Lipide zu optimieren.
Modulationen der ionisierbaren Lipide
Der pKa-Wert der ionisierbaren Aminogruppe korreliert stark mit den In-vivo-Effekten und damit der Immunogenität der mRNA. Idealerweise sollte sich dieser bei der intramuskulären Injektion zwischen 6,6 und 6,9 bewegen.
Neben dem pKa-Wert spielt auch die molekulare Form der Liposomen eine wichtige Rolle (s. Kasten „Eigenschaften von Trägersystemen“). So vermutet man, dass die Lipide in protonierter Form eine kegelförmige Gestalt annehmen, die die Verschmelzung mit der endosomalen Membran und Freigabe der mRNA ins Zytosol erleichtert. Generell kann die Form der Liposomen durch die Anzahl der Doppelbindungen in den Alkylgruppen (Alkene) reguliert werden, da diese die Ausrichtung der Alkylketten und damit die Bildung von bestimmten molekularen Formen beeinflusst. Da sich zu viele Doppelbindungen negativ auf die Stabilität der Vesikel auswirken, ersetzt man häufig Alken- durch Estergruppen. Diese ermöglichen auch eine bessere Metabolisierung der Liposomen, indem sie enzymatisch von im Gewebe oder in intrazellulären Kompartimenten lokalisierten Esterasen oder Lipasen in Carbonsäure und Alkohol hydrolysiert werden, die wiederum hydrophiler als das Ausgangsprodukt sind und leichter ausgeschieden werden können. Insgesamt können durch die Anzahl und Lage der Estergruppen gezielt die Freisetzung und Kinetik der Liposomen gesteuert werden.
Neben den verschiedenen Transport-Vehikeln spielt vermutlich auch der Applikationsweg eine wichtige Rolle bei der Antigenpräsentation, einen Überblick dazu bietet Tabelle 1.
Applikationsweg | Vorteile | Herausforderungen |
|---|---|---|
intradermal |
|
|
subkutan |
|
|
intramuskulär |
|
|
intranodal |
|
|
intravenös |
|
|
Ein Blick in die Zukunft: Personalisierte Krebsimpfstoffe
Lange Zeit nutzte man in therapeutischen Impfstoffen sogenannte „shared antigens“, also tumorassoziierte Antigene, die im Vergleich zu normalen Körperzellen übermäßig häufig in Tumorzellarten exprimiert werden. In klinischen Studien lieferten diese Impfstoffe jedoch eher enttäuschende Ergebnisse, was der geringen Spezifität des Antigens und den damit einhergehenden zentralen und peripheren Toleranzmechanismen des Immunsystems geschuldet war. Keinem Immuntoleranzmechanismus unterlegen sind die in jüngster Forschungszeit genutzten tumorspezifischen Antigene, die durch somatische Mutationen spezifisch nur in Krebszellen gebildet werden [1, 4, 7, 10]. Sie werden von den T-Zellen als fremd erkannt und stellen daher das ideale Target für Krebsimpfstoffe dar. Da bei jedem Krebspatienten individuell andere Mutationen auftreten, bieten sich tumorspezifische Antigene, die auch Neoantigene genannt werden, optimal für die Therapie mit personalisierten Impfstoffen an. Dieses Gebiet wird gerade intensiv beforscht, unter anderem auch von den Biontech-Entwicklern des ersten mRNA-Impfstoffs gegen COVID-19, Prof. Dr. Uğur Şahin und Prof. Dr. Özlem Türeci. In mehreren klinischen Studien mit soliden Tumoren zeigten sich die personalisierten Neoantigen-Impfstoffe bereits als sicher und praktikabel. So konnten vielversprechende Ergebnisse insbesondere bei Patienten mit Tumoren mit hoher Mutationslast (z. B. Melanom), aber auch bei kalten Tumoren mit geringer Mutationslast (z. B. Glioblastom) gesehen werden.
mRNA-Impfstoff als Wirkverstärker
Ebenso intensiv beforscht wird aktuell die Kombination einer CAR-T-Zell-Therapie zusammen mit mRNA-Impfstoffen bei Tumorpatienten mit soliden Tumoren. Bei der CAR-T-Zell-Therapie, die aktuell nur bei hämatologischen Tumorerkrankungen genutzt wird, werden T-Zellen des Patienten gentechnisch so verändert, dass sie nach der Reinfusion gezielt ein bestimmtes Antigen des Tumors erkennen und diesen zerstören. Die Kombination mit mRNA-Impfstoffen, die dasselbe Antigen codieren, soll die Persistenz und Funktionalität der CAR-T-Zellen im Körper verbessern und damit die Immunabwehr verstärken. Durch die wiederholte Gabe der mRNA-Vakzine erhofft man sich, die Dauer der Immuntherapie so weit verlängern zu können, bis keine Krebszellen mehr vorhanden sind. Vor wenigen Tagen hat das Unternehmen Biontech erste Ergebnisse der Phase-I/II-Studie einer solchen Kombinationstherapie bekannt gegeben [11]. Die 16 Probanden mit unterschiedlichen soliden Tumoren hatten entweder eine Monotherapie mit gegen das Antigen Claudin-6 gerichteten CAR-T-Zellen oder eine Kombination mit einer Claudin-6-codierenden mRNA-Vakzine erhalten. Die Behandlung wurde gut vertragen: Die unter einer CAR-T-Zell-Therapie bekannte Komplikation des Zytokinfreisetzungssyndroms fiel nur mild aus. Sechs Wochen nach der Infusion der CAR-T-Zellen hatten sechs von untersuchten 14 Patienten teilweise auf die Therapie angesprochen, bei fünf Patienten verkleinerte sich die Tumorläsion. Prof. Dr. Özlem Türeci meint: „Die Tatsache, dass wir in dieser stark vorbehandelten Patientenpopulation bereits bei der niedrigsten CAR-T-Zellen-Dosis erste Anti-Tumor-Effekte sehen, ist wirklich sehr bemerkenswert und weist auf das Potenzial unseres CAR-Designs und unseres CARVac-Ansatzes hin. [...] Unsere vorläufigen Daten deuten darauf hin, dass die Erfolge von CAR-T bei hämatologischen Krebserkrankungen auch auf solide Tumore übertragen werden könnten.” |
Literatur
[1] Saxena M, van der Burg SH, Melief CJM et al. Therapeutic cancer vaccines. Nat Rev Cancer 2021;21:360–378, https://doi.org/10.1038/s41568-021-00346-0
[2] Blass E, Ott PA. Advances in the development of personalized neoantigen-based therapeutic cancer vaccine. Nature Reviews/Clinical Oncology 2021;18:215-229, https://doi.org/10.1038/s41571-020-00460-2
[3] Ma M et al. Development of tumour peptide vaccines: From universalization to personalization. Scand J Immunol 2020;91(6):e12875, doi: 10.1111/sji.12875
[4] Morse MA, Gwin Ill WR, Mitchell DA. Vaccine Therapies for Cancer: Then and Now. Targeted Oncology 2021;16:121-152, https://doi.org/10.1007/s11523-020-00788-w
[5] Miao L, Zhang Y, Huang L. mRNA vaccine for cancer immunotherapy. Molecular Cancer 2021;20:41, https://doi.org/10.1186/s12943-021-01335-5
[6] Neek M, Li TK, Wang S-Z. Protein-Based Nanoparticles in Cancer Vaccine Development. Nanomedicine 2019;15(1):164-174, doi:10.1016/j.nano.2018.09.004
[7] Liang J, Zhao X. Nanomaterial-based delivery vehicles for therapeutic cancer vaccine development. Cancer Biol Med 2021, doi: 10.20892/j.issn.2095-3941.2021.0004
[8] Sayour EJ et al. Cancer Vaccine Immunotherapy with RNA-Loaded Liposomes. Int J Mol Sci 2018;19:2890, doi:10.3390/ijms19102890
[9] Zeng C, Zhang C. Formulation and Delivery Technologies for mRNA Vaccines. Curr Top Microbiol Immunol 2020, doi: 10.1007/82_2020_21
[10] Sahin U, Türeci Ö. Personalized vaccines for cancer immunotherapy. Science 2018;359:1355-1360
[10] Sahin U, Türeci Ö. Personalized vaccines for cancer immunotherapy. Science 2018;359:1355-1360
[11] Biontech präsentiert erste positive Daten der Phase-I/II-Studie mit erstem CAR-T-Programm BNT211 auf der AACR, Pressemitteilung von Biontech, 11. April 2022
Abb. 1: Nachdem der Impfstoff in den Körper des Patienten injiziert wurde, erkennen Antigen-präsentierende Zellen das exogene Antigen und nehmen es in die Zelle auf. Dort wird es in kleinere Peptide geschnitten. In den Lymphknoten werden anschließend kürzere Peptide (8 bis 12 Aminosäuren) über MHC-Klasse-I-Proteine an naive CD8+-T-Zellen, längere Peptide (12 bis 25 Aminosäuren) über MHC-Klasse-II-Proteine an naive CD4+-T-Zellen präsentiert und bei entsprechender Erkennung über den jeweiligen T-Zell-Rezeptor aktiviert. Die reifen CD8+-T-Zellen (zytotoxische T-Zellen) erkennen beim Absuchen der Zelloberflächen den Tumor und initiieren dort über die Ausschüttung von Perforin, Granzymen und inflammatorischen Mediatoren die Zerstörung der Tumorzellen. Die aktivierten CD4+-T-Zellen (T-Helferzellen) hingegen setzen Zytokine wie Interferon γ (IFN-γ), den T-Zell-Wachstumsfaktor Interleukin 2 (IL-2) und TNF-α frei, um so das Wachstum und die Proliferation der CD8+-T-Zellen zu verstärken. Bei der Lyse der Tumorzellen werden weitere Antigene frei, die wiederum neue Antigen-präsentierende Zellen aktivieren und antitumorale Immunantworten initiieren [nach 1, 3].























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.