
- DAZ.online
- DAZ / AZ
- DAZ 34/2022
- Tote Viren gegen Corona
Impfstoffe
Tote Viren gegen Corona
Hintergrundwissen zu VLA2001 von Valneva
Ab Herbst dieses Jahres planen der Bund und die Länder eine neue Impfkampagne gegen eine mögliche weitere Corona-Welle, die unter anderem niedrigschwellige Impfangebote sowie Impfzentren vor Ort beinhaltet [1]. Im Rahmen der Kampagne möchte die Bundesregierung auch erstmals den Impfstoff VLA2001 (COVID-19 Vaccine Valneva) des französischen Impfstoffherstellers Valneva anbieten [2]. Das Vakzin erhielt am 24. Juni 2022 von der Europäischen Kommission die Marktzulassung zur Verwendung als Erstimpfung bei Menschen im Alter von 18 bis 50 Jahren, nachdem die Europäische Arzneimittel-Agentur (EMA) zuvor die Sicherheit und Wirksamkeit positiv bewertet hatte [3 – 5]. Zweit- oder Drittimpfungen mit VLA2001 werden derzeit (noch) nicht empfohlen. Die Zulassung gilt für alle 28 Mitgliedstaaten der Europäischen Union sowie für Island, Liechtenstein und Norwegen [3]. Damit ist VLA2001 der erste COVID-19-Impfstoff, der innerhalb der EU eine Standard-Marktzulassung erhält, während die übrigen Vakzine nur eine bedingte Zulassung besitzen, die jährlich erneuert werden muss. Im April 2022 hatte die britische Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) VLA2001 bereits eine bedingte Marktzulassung erteilt; in Bahrain und den Vereinigten Arabischen Emiraten besteht eine Notfallgenehmigung für die Verwendung des Vakzins [3].
Bivalente Impfstoffe in der Entwicklung
Um den Impfschutz auf mehrere Virus-Varianten zu verbreitern, werden zwei Strategien verfolgt: Die Impfstoffe enthalten oder kodieren für Spikeproteine von zwei (oder mehr) verschiedenen Varianten oder als Antigene enthalten sie oder kodieren für noch andere Virusproteine als das Spikeprotein.
- Biotech/Pfizer (D/USA): Kombination (bivalent) BNT162b2 und BNT162b2 OMI, mRNA-Impfstoff mit zwei verschiedenen mRNAs für Spikeprotein (Wuhan-Stamm und Omikron BA.1), für Auffrisch-Impfungen, im Zulassungsverfahren der EU nach Rolling Review
- Novavax (USA): SII Bivalent, proteinbasierter Impfstoff mit Antigenen vom ursprünglichen SARS-CoV-2 und der Beta-Variante (gentechnisch, in Nanopartikeln) mit Adjuvans Matrix-M1, wird an bislang Ungeimpften erprobt, befindet sich in Phase III
- Moderna (USA): mRNA-1273.214, bivalenter mRNA-Impfstoff mit zwei verschiedenen mRNAs für Spikeprotein (Wuhan-Stamm und Omikron BA.1), zur Auffrisch-Impfung, befindet sich im Rolling Review in der EU, während eine Phase-III-Studie weiterläuft; in der auch der monovalente Omikron- BA.1-angepasste Impfstoff mRNA-1273.529 erprobt
- Moderna (USA): mRNA-1273.211 (gegen Wuhan- und Beta-Variante), bivalenter mRNA-Impfstoff, für Auffrisch-Impfung mit einer Injektion für zuvor zweifach mit dem ersten Moderna-Impfstoff Geimpfte; enthält neben der mRNA-1273 auch die an die Beta-Variante angepasste mRNA-1273.351, positive Ergebnisse zur Wirksamkeit aus Phase-II/III-Studie
- Biontech/Pfizer (D/USA): BNT162b5, bivalenter mRNA-Impfstoff mit zwei verschiedenen mRNAs für Spikeprotein (Wuhan-Stamm und Omikron BA.2), für Auffrisch-Impfungen, befindet sich in Phase-II-Studien
(modifiziert nach Informationen des vfa – Die forschenden Pharma-Unternehmen, Stand 19. August 2022, www.vfa.de/de/arzneimittel-forschung/coronavirus/impfstoffe-gegen-sars-cov-2-varianten [21])
Was für ein Impfstoff ist VLA2001?
Bisher wurden in der EU fünf Vakzine gegen COVID-19 zugelassen, die drei verschiedene Arten von Impfstoffen repräsentieren (Tab. 1):
- Comirnaty (Biontech/Pfizer) und Spikevax (Moderna Biotech) enthalten als mRNA-Impfstoffe die Erbinformation des Spikeproteins in Form von mRNA, die in eine Lipid-Nanopartikelhülle eingebettet ist. Nach der Injektion dringt diese in die Zelle ein und die mRNA dient dort als Bauplan für die Produktion des Antigens. Im Anschluss wir dies den Immunzellen präsentiert, was wiederum die gewünschte spezifische Immunantwort auslöst.
- Die Vektorimpfstoffe Vaxzevria (AstraZeneca) und Jcovden (Janssen-Cilag/Johnson und Johnson) enthalten ebenfalls den Bauplan für das Spikeprotein. Allerdings wird dieser in Form von DNA eingeschleust, die in veränderten Adenoviren (Vektoren) „verpackt“ ist. In der Zelle wird die DNA durch zelleigene Enzyme in mRNA umgewandelt, anhand derer dann das Spikeprotein hergestellt wird, das als Antigen wirkt und somit die entsprechende Immunantwort induziert.
- Nuvaxovid (Novavax) ist ein Proteinimpfstoff, der im Labor hergestellte Spikeproteine enthält, die das Immunsystem zur Antikörperbildung anregen. Es wird also nicht die Erbinformation (mRNA oder DNA) für das Spikeprotein, sondern das Antigen selbst injiziert. Außerdem ist ein sogenanntes Adjuvans – ein Wirkverstärker – hinzugefügt, damit das Immunsystem ausreichend aktiviert wird.
Name des Impfstoffs | Art des Impfstoffs | Hersteller | Zulassung |
|---|---|---|---|
Comirnaty | mRNA-Impfstoff | Biontech/Pfizer |
|
Spikevax | mRNA-Impfstoff | Moderna Biotech |
|
Vaxzevria/COVID-19 Vaccine AstraZeneca | Vektorimpfstoff | AstraZeneca |
|
Jcovden | Vektorimpfstoff | Janssen-Cilag/Johnson und Johnson |
|
Nuvaxovid | Proteinimpfstoff | Novavax |
|
VLA2001/COVID-19 Vaccine Valneva | inaktivierter Ganzvirus-Impfstoff | Valneva |
|
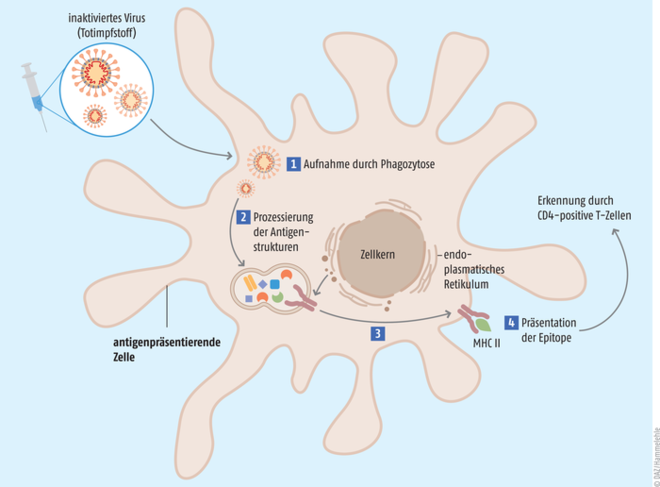
Demgegenüber handelt es sich bei VLA2001 um einen inaktivierten Ganzvirus-Impfstoff [6]. Solche Vakzine, die auf abgetöteten bzw. vermehrungsunfähigen Krankheitserregern (oder deren Bestandteilen) basieren, werden auch als Totimpfstoffe bezeichnet. Im weiteren Sinne ist Nuvaxovid, das aus Proteinbestandteilen von SARS-CoV-2 besteht, also ebenfalls ein Totimpfstoff. Neben den inaktivierten Viruspartikeln enthält VLA2001 den herkömmlichen Wirkverstärker Aluminiumhydroxid (Alum) sowie das neuartige Adjuvans CpG-1018 − kurze einsträngige DNA-Abschnitte aus 22 Bausteinen mit einem hohen Anteil an den sich abwechselnden Nukleinbasen Cytosin und Guanin (CpG-Oligonukleotide) [7]. Aluminiumhydroxid und das Adjuvans CpG-1018 in Kombination sorgen für eine deutlich verstärkte Immunantwort auf den Impfstoff, sodass das Immunsystem nach der Impfung effektiv Antikörper gegen SARS-CoV-2 bilden kann. VLA2001 wird im Abstand von mindestens vier Wochen zweimal in der Regel in den Oberarmmuskel injiziert [4]. Wie der COVID-19-Impfstoff nach seiner Injektion im menschlichen Körper wirkt, ist in Abbildung 1 vereinfacht dargestellt.
Abb. 1: Wirkprinzip des Ganzvirus-Impfstoffs VLA2001. Nach der Injektion gelangt inaktiviertes SARS-CoV-2 in den Blutkreislauf und wird z. B. über Phagozytose von antigenpräsentierenden Zellen (Monozyten, Makrophagen, B-Zellen, dendritische Zellen) aufgenommen (1). Anschließend erfolgt die Antigen-Prozessierung, d. h., die Virus-Proteine werden in Peptide zerlegt (2). Schließlich werden die Peptidfragmente über den Haupthistokompatibilitätskomplex der Klasse II (MHC II, Major Histocompatibility Complex) den CD4-positiven T-Zellen (T-Helferzellen) präsentiert (3). Diese können die präsentierten Antigene erkennen und werden dadurch aktiviert (4). Nach der Aktivierung geben die T-Helferzellen Zytokine ab, die entweder an der zellvermittelten Immunantwort beteiligt sind oder die humorale Immunantwort von B-Lymphozyten stimulieren (nach [19]).
Was unterscheidet VLA2001 von den übrigen Impfstoffen gegen Corona?
Im Vergleich zu den bisher in Deutschland eingesetzten Vakzinen gegen Corona weist VLA2001 einige Besonderheiten auf [7 – 10]:
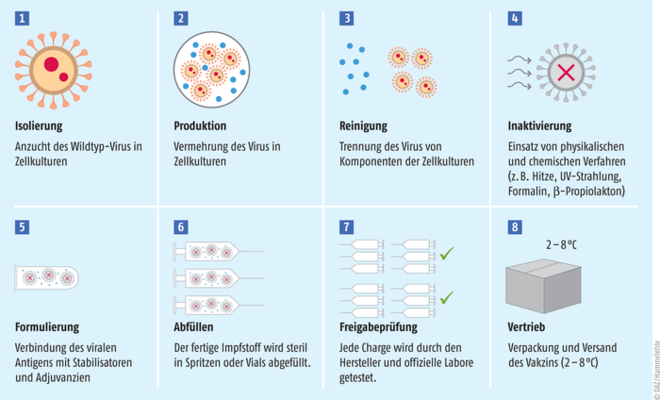
- Inaktivierte Ganzvirus-Impfstoffe wie VLA2001 basieren auf einer bewährten Technologie, die bereits seit Langem z. B. bei Vakzinen gegen FSME oder Tollwut eingesetzt wird. Die Herstellung erfolgt in mehreren Schritten durch Anzucht und Vermehrung der Viren in Zellkulturen sowie anschließende chemische Inaktivierung (Abb. 2). Dabei bleibt das Eiweiß des Virus intakt, das Coronavirus selbst kann sich allerdings nicht vermehren oder Zellen infizieren.
- Da inaktivierte Viren die Fähigkeit verloren haben, eine Zelle aktiv zu infizieren und sich dort zu vermehren, können sie nur durch antigenpräsentierende Zellen aufgenommen werden, die dann die Virusbestandteile über MHC-II-Moleküle den CD4-positiven Helfer-T-Zellen präsentieren und diese so aktivieren. Die zytotoxischen CD8-positiven T-Zellen, die Viren direkt bekämpfen können, werden hingegen − anders als bei mRNA- oder auch Vektor-Impfstoffen − durch VLA2001 nicht induziert. Der Ganzvirus-Impfstoff erzeugt also nur eine unvollständige Immunantwort, was eine schwächere Impfwirkung zur Folge haben kann. Daher werden hier auch Adjuvanzien benötigt, um die Immunantwort zu verstärken.
- VLA2001 enthält das gesamte Virus, das heißt, das Immunsystem kann eine Immunantwort gegen verschiedene Strukturen z. B. der Virushülle entwickeln. Demgegenüber basieren die verfügbaren mRNA- und Vektor-Impfstoffe, aber auch der rekombinante Proteinimpfstoff von Novavax nur auf der immunogenen Wirkung des Spikeproteins. Der Ganzvirus-Impfstoff könnte deshalb ein breiteres Wirkspektrum gegen unterschiedliche Virusvarianten aufweisen. Andererseits besteht potenziell das Risiko, dass eine Immunreaktion gegen so viele verschiedene Proteine auch zu Autoimmunreaktionen führt, die gerade in Verbindung mit den Adjuvanzien schwierig zu kontrollieren sind [10].
- VLA2001 kann – im Gegensatz zu den mRNA-Impfstoffen – bei Kühlschranktemperaturen (2 bis 8°C) über längere Strecken transportiert und mehrere Jahre lang gelagert werden.
Demnach weist VLA2001 gegenüber den bisher in Deutschland zugelassenen COVID-19-Impfstoffen sowohl Vor- als auch Nachteile auf. Aufgrund seiner seit vielen Jahren bewährten Herstellungstechnik kann der Impfstoff jedoch auch für die Menschen eine Alternative sein, die gegenüber den neueren Produktionsverfahren bei mRNA-Impfstoffen, Vektorvakzinen oder Proteinimpfstoffen skeptisch eingestellt sind.
Wie wirksam und sicher ist VLA2001?
Die Wirksamkeit und Sicherheit des Impfstoffs VLA2001 wurde in der multizentrischen randomisierten Beobachtungsstudie COV-COMPARE im Vergleich zum Vektorimpfstoff Vaxzevria von AstraZeneca untersucht [3, 6, 11, 12]. Da die Daten vor Auftreten der Omikron-Variante im Jahr 2021 erhoben wurden, konnte die Effektivität der beiden Vakzine gegen diese Variante hier nicht bestimmt werden. In die Phase-III-Studie wurden rund 4000 Frauen und Männer im Alter zwischen 18 und 71 Jahren eingeschlossen, wobei die meisten Studienteilnehmerinnen und -teilnehmer unter 50 Jahre alt waren und mehr Männer als Frauen involviert waren. Ausgeschlossen von der Studie wurden Personen mit sehr schweren Erkrankungen, einer starken Immunschwäche oder anderen speziellen Risiken sowie Menschen, die bereits eine nachgewiesene Corona-Infektion hatten. Auch schwangere Frauen nahmen nicht teil. Im Rahmen der Studie wurden Probandinnen und Probanden im Alter von 30 Jahren und älter nach Randomisierung entweder zweimal im Abstand von 28 Tagen mit VLA2001 geimpft (n = 2000) oder stattdessen zweimal im selben zeitlichen Abstand mit Vaxzevria (n = 1000). Zusätzlich erhielten rund 1000 weitere Studienteilnehmerinnen und -teilnehmer im Alter von 29 Jahren und jünger zwei Impfungen mit VLA2001.
Die Auswertung der Daten zur Wirksamkeit erfolgte zwei Wochen nach der zweiten Impfdosis – mögliche Nebenwirkungen wurden bis fünf Monate nach der ersten Impfdosis erfasst – mit folgenden Ergebnissen [5, 6, 12]:
- Infolge der Impfung mit VLA2001 Valneva bildeten sich signifikant mehr neutralisierende Antikörper als nach der Impfung mit Vaxzevria. So betrug der geometrische mittlere Titer (GMT) an neutralisierenden Antikörpern unter VLA2001 803,5 (95%-Konfidenzintervall [KI]: 748,48 bis 862,59) im Vergleich zu 576,6 (95%-KI: 543,6 bis 611,7) unter Vaxzevria. Dies entsprach einem GMT-Verhältnis VLA2001/Vaxzevria von 1,39 (p < 0,0001). Insgesamt fiel die Immunantwort unter VLA2001 also stärker aus als unter Vaxzevria.
- Die Analyse bei einer Untergruppe der Teilnehmerinnen und Teilnehmer zeigte, dass VLA2001 in hohem Maße antigenspezifische T-Zell-Reaktionen induzierte, die gegen das S-Protein (74,3%), N- (45,9%) bzw. M-Protein (20,3%) von SARS-CoV-2 gerichtet waren.
- Die Serokonversionsraten, das heißt die prozentualen Anteile von Personen, die zwei Wochen nach der zweiten Impfung einen ≥ vierfachen Anstieg der Titerwerte für SARS-CoV-2-spezifische neutralisierende Antikörper aufwiesen und somit eine ausreichende Immunität ausbildeten, waren in beiden Studiengruppen mit über 95% vergleichbar hoch. In beiden Gruppen kam es auch zu ähnlich vielen COVID-19-Erkrankungen, wobei weder unter VLA2001 noch unter Vaxzevria schwere Krankheitsfälle auftraten.
- Was die Verträglichkeit betrifft, war VLA2001 im Vergleich zu Vaxzevria überlegen. So kam es nach Injektion des Ganzvirus-Impfstoffs bei 73,2% zu Reaktionen an der Einstichstelle, z. B. Schmerzen, Rötungen oder Schwellungen, im Vergleich zu 91,1% bei einer Impfung mit Vaxzevria (p < 0,0001). Systemische Beschwerden wie Fieber, Müdigkeit, Kopfschmerzen oder Muskelschmerzen traten unter VLA2001 bei 70,2% und unter Vaxzevria bei 91,1% der Probandinnen und Probanden auf (p < 0,0001). Hinweise auf Impfkomplikationen durch den Ganzvirus-Impfstoff gab es nicht.
Unklar ist bisher allerdings noch, wie gut der Impfstoff bei Menschen über 50 Jahren schützt, wie lange die Impfwirkung anhält und ob es Nebenwirkungen gibt, die sich bislang nicht gezeigt haben [6]. Außerdem ist auch noch nicht vollständig geklärt, wie gut VLA2001 gegen die derzeit dominierenden Omikron-Varianten wirkt. Allerdings zeigen vorläufige Laborstudien, dass drei Dosen VLA2001 die Omikron-Variante (B.1.1.529-Linie) teilweise neutralisieren können [13]. Dabei wiesen 100% der getesteten Serumproben neutralisierende Antikörper gegen das ursprüngliche Virus sowie die Delta-Variante auf und 87% gegen die Omikron-Variante. Im Vergleich zum ursprünglichen Virus war die Neutralisationsstärke bei der Delta-Variante jedoch um das 2,7-Fache und bei der Omikron-Variante sogar um das 16,7-Fache reduziert.
Was die homologe Booster-Wirkung von VLA2001 betrifft, konnte in einer Phase-I/II-Studie gezeigt werden, dass die Antikörper-Titer um das 42- bis 106-Fache anstiegen, wenn die Teilnehmerinnen und Teilnehmer sieben bis acht Monate nach ihrer zweiten Impfung eine dritte Applikation des Vakzins erhielten [14]. Ob VLA2001 als Booster-Impfung nach vorheriger mRNA-Impfung oder nach überstandener Erkrankung eingesetzt werden kann, wird derzeit in der heterologen Booster-Studie VLA2001-307 untersucht [15]. Die Studie wird voraussichtlich rund 150 Teilnehmerinnen und Teilnehmer umfassen, die mindestens sechs Monate nach der Erstimpfung mit einem zugelassenen mRNA-COVID-19-Impfstoff oder nach einer natürlichen COVID-19-Infektion eine VLA2001-Auffrischungsimpfung erhalten. Die ersten Ergebnisse werden im dritten Quartal 2022 erwartet.
Auf einen Blick
- Seit 24. Juni 2022 ist EU-weit sowie in Island, Liechtenstein und Norwegen mit VLA2001 von Valneva der erste inaktivierte Ganzvirus-Impfstoff gegen das Corona-Virus zugelassen.
- VLA2001 enthält – neben den inaktivierten Viruspartikeln – die beiden Adjuvanzien Aluminiumhydroxid und CpG-1018, welche die Immunantwort auf das Vakzin verstärken.
- Ganzvirus-Impfstoffe wie VLA2001 haben gegenüber den aktuell in Deutschland hauptsächlich eingesetzten mRNA-Impfstoffen den Nachteil, dass sie nur eine unvollständige Immunantwort induzieren. Allerdings besitzen sie möglicherweise ein breiteres Wirkspektrum gegen verschiedene Virusvarianten und können zudem bei 2 bis 8 °C transportiert und langfristig gelagert werden.
- Der Impfstoff kann aufgrund seiner seit Jahren bewährten Herstellungstechnik eine Alternative für Menschen sein, die die anderen, mit neuen Verfahren hergestellten Vakzine ablehnen.
- VLA2001 hat in der Phase-III-Studie COV-COMPARE gezeigt, dass es bei Erwachsenen unter 50 Jahren die Bildung von mehr neutralisierenden Antikörpern induziert als Vaxzevria und eine SARS-CoV-2-Infektion ebenso effektiv verhindert wie der Vektorimpfstoff. Die Verträglichkeit war im Vergleich zu Vaxzevria besser.
- Noch nicht geklärt ist bisher, wie gut der Impfstoff bei Menschen über 50 Jahren schützt, wie lange die Impfwirkung anhält, ob es langfristige Nebenwirkungen gibt und wie gut VLA2001 gegen die Omikron-Varianten wirkt. Inwieweit VLA2001 als Booster nach vorheriger Impfung mit mRNA-Vakzinen eingesetzt werden kann, wird derzeit in der VLA2001-307-Studie untersucht.
- Die späte Einführung von VLA2001 in der EU lässt sich unter anderem dadurch erklären, dass sich die Marktzulassung seitens der EMA bzw. Europäischen Kommission verzögerte. Zudem war aufgrund der verspäteten Zulassung eine Zeit lang nicht klar, ob die EU den Kaufvertrag nicht vollständig kündigt. Letztlich wird nur ein Bruchteil der ursprünglich vereinbarten Impfstoffmenge von der EU abgenommen. Erste Lieferungen des Impfstoffs werden in Deutschland für August bzw. September erwartet.
Warum verzögert sich die Einführung von VLA2001?
Der Impfstoffhersteller Valneva musste einige Zeit warten, bis die EMA letztlich die Empfehlung für die Marktzulassung von VLA2001 abgab, die dann am 24. Juni 2022 von der Europäischen Kommission erteilt wurde. Hintergrund der Verzögerung war unter anderem, dass die Europäische Arzneimittel-Agentur wiederholt zusätzliche Daten von Valneva angefordert hatte und diese evaluieren musste [16, 17]. Zudem standen zu diesem Zeitpunkt bereits fünf Corona-Impfstoffe zur Verfügung, sodass die Überprüfung der Wirksamkeit und Sicherheit von VLA2001 seitens der EMA weniger dringlich behandelt wurde als noch zu Beginn der Impfstoffzulassungen [16].
Aufgrund der verzögerten Zulassung stand der Vorab-Kaufvertrag, welchen die Europäische Kommission mit dem Pharmaunternehmen über 60 Millionen Dosen Impfstoff, davon 24 Millionen Dosen in diesem Jahr, abgeschlossen hatte, kurzzeitig vor der Kündigung, da eine Vertragsklausel Brüssel den Ausstieg aus der Vereinbarung ermöglicht hätte [17]. Schließlich genehmigte die EU-Kommission eine Änderung des Vertrags, nach der die Europäische Union in diesem Jahr mit 1,25 Millionen Dosen allerdings nur einen Bruchteil der ursprünglich vereinbarten Impfstoffmenge kauft − mit der Option, die Anzahl der Dosen im Verlauf des Jahres noch einmal zu verdoppeln. Laut Herstellerangaben werden die ersten Impfstoffdosen in den kommenden Wochen an die teilnehmenden EU-Mitgliedstaaten (Deutschland, Österreich, Dänemark, Finnland und Bulgarien) geliefert (Stand 20. Juli 2022) [18]. Wann genau der Impfstoff in Deutschland zur Verfügung steht, ist noch nicht klar. Die Bundesregierung erwartet die Lieferung von einer Million Dosen VLA2001 im August und September [2]. Valneva wird nach Herstellerangaben die übrigen bereits produzierten Bestände für mögliche zusätzliche Lieferungen an diese EU-Mitgliedstaaten zurückhalten, falls die Nachfrage steigen sollte, und parallel dazu etwa acht bis zehn Millionen Dosen des Impfstoffs auf internationalen Märkten anbieten. In Anbetracht des geänderten Vorabkaufvertrags hat Valneva laut eigenen Angaben die weitere Herstellung von VLA2001 vorläufig eingestellt [18]. |
Literatur
[1] Bund und Länder wollen Impfkampagne für Herbst vorbereiten. Süddeutsche Zeitung, Stand: 2. Juni 2022, www.sueddeutsche.de/politik/bundesregierung-berlin-bund-und-laender-wollen-impfkampagne-fuer-herbst-vorbereiten-dpa.urn-newsml-dpa-com-20090101-220602-99-527883
[2] Corona-Totimpfstoff von Valneva ab September in Deutschland. mdr-Wissen, Stand: 8. August 2022, www.mdr.de/wissen/corona-totimpfstoff-von-valneva-ab-september-in-deutschland100.html
[3] COVID-19 – VLA2001. Informationen der Valneva SE, https://valneva.com/research-development/covid-19-vla2001/?lang=de
[4] COVID-19-Impfstoff (inaktiviert, adjuvantiert) Valneva (COVID-19-Impfstoff (inaktiviert, adjuvantiert, adsorbiert)). EMA, www.ema.europa.eu/en/documents/overview/covid-19-vaccine-inactivated-adjuvanted-valneva-epar-medicine-overview_de.pdf
[5] COVID-19 Vaccine (inactivated, adjuvanted) Valneva: Summary of Product Characteristics. EMA, www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-inactivated-adjuvanted-valneva-epar-product-information_en.pdf
[6] COVID-19 Vaccine Valneva zur Impfung gegen Corona. Informationen des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), Stand: 7. Juli 2022, www.gesundheitsinformation.de/covid-19-vaccine-valneva-zur-impfung-gegen-corona.html
[7] Maul A, Hamann, S. Corona-Impfstoff von Valneva: So funktioniert der Totimpfstoff. gesundheit.de, Stand: 28. Juni 2022, www.gesundheit.de/krankheiten/infektionskrankheiten/atemwegsinfektionen/coronavirus/valneva-impfstoff
[8] Dingermann T. Erster Ganzvirus-Impfstoff gegen COVID-19 wird geprüft. Pharmazeutische Zeitung vom 25. August 2021, www.pharmazeutische-zeitung.de/erster-ganzvirus-impfstoff-gegen-covid-19-wird-geprueft-127618/seite/2/
[9] Negt A. Valneva: Totimpfstoff mit T-Zellantwort. Apotheke Adhoc vom 9. Februar 2022, www.apotheke-adhoc.de/nachrichten/detail/pharmazie/valneva-totimpfstoff-mit-t-zellantwort-dna-basierter-wirkverstaerker/
[10] Corona-Impfung: Totimpfstoff, Virusproteine, mRNA- oder Vektorimpfstoff? Informationen des NDR, Stand: 22. Februar 2022, www.ndr.de/ratgeber/gesundheit/Corona-Impfung-Totimpfstoff-Virusproteine-mRNA-oder-Vektorimpfstoff,corona9064.html
[11] Study To Compare The Immunogenicity Against COVID-19, Of VLA2001 Vaccine To AZD1222 Vaccine (COV-COMPARE). ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04864561
[12] Valneva Reports Positive Phase 3 Results for Inactivated, Adjuvanted COVID-19 Vaccine Candidate VLA2001. Pressemitteilung der Valneva SE vom 18. Oktober 2021, https://valneva.com/press-release/valneva-reports-positive-phase-3-results-for-inactivated-adjuvanted-covid-19-vaccine-candidate-vla2001/
[13] Valnevas inaktivierter COVID-19-Impfstoffkandidat neutralisiert nachweislich die Omikron-Variante. Pressemitteilung der Valneva SE vom 16. Januar 2022, https://valneva.com/press-release/valnevas-inactivated-covid-19-vaccine-candidate-shown-to-neutralize-omicron-variant/?lang=de
[14] Valneva Announces Positive Homologous Booster Data for Inactivated, Adjuvanted COVID-19 Vaccine Candidate VLA2001. Pressemitteilung der Valneva SE vom 16. Dezember 2021, https://valneva.com/press-release/valneva-announces-positive-homologous-booster-data-for-inactivated-adjuvanted-covid-19-vaccine-candidate-vla2001/
[15] Valneva startet heterologe Booster-Studie für inaktivierten Impfstoffkandidaten gegen COVID-19. Pressemitteilung der Valneva SE vom 4. Mai 2022, https://valneva.com/press-release/valneva-initiates-heterologous-booster-trial-of-inactivated-covid-19-vaccine-candidate/?lang=de
[16] Pfluger B. Corona: Valnevas Totimpfstoff steht in der EU auf der Kippe. Der Standard vom 13. Juni 2022, www.derstandard.de/story/2000136540306/corona-valnevas-totimpfstoff-steht-in-der-eu-auf-der-kippe
[17] Nun doch: EU kauft Valneva-Impfstoff. Apotheke Adhoc vom 20. Juli 2022, www.apotheke-adhoc.de/nachrichten/detail/coronavirus/nun-doch-eu-kauft-valneva-impfstoff/
[18] Europäische Kommission genehmigt Abänderung des Vorabkaufvertrags für Valnevas inaktivierten COVID-19-Impfstoff. Pressemitteilung der Valneva SE vom 20. Juli 2022, https://valneva.com/press-release/european-commission-approves-purchase-agreement-amendment-for-valnevas-inactivated-covid-19-vaccine/?lang=de
[19] Corona-Totimpfstoff von Valneva im Rolling-Review der EMA. Gelbe Liste, www.gelbe-liste.de/nachrichten/vla2001-valneva-rolling-review-ema (letzter Zugriff am 9. August 2022).
[20] Valneva. Ressourcen für Medien. Informationen der Valneva SE, https://valneva.com/media-kit/?lang=de
[21] Corona-Impfstoffe der nächsten Generation. Informationen des vfa - Die forschenden Pharma-Unternehmen, 19. August 2022, www.vfa.de/de/arzneimittel-forschung/coronavirus/impfstoffe-gegen-sars-cov-2-varianten























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.