
- DAZ.online
- DAZ / AZ
- DAZ 39/2022
- Dem Virus eine Nasenlä...
Impfstoffentwicklung
Dem Virus eine Nasenlänge voraus
Nasale COVID-19-Impfstoffe als Hoffnungsschimmer in der Pandemie
Als die ersten Phase-III-Studienergebnisse der Impfstoffkandidaten von Moderna und Biontech/Pfizer publik wurden, machte sich weltweit Erleichterung breit. 95% Wirksamkeit, das hatten sich selbst die hoffnungsvollsten Optimisten nicht erträumt. Das Ende der Pandemie schien in greifbare Nähe gerückt. Zwei Jahre später wissen wir – es ist komplizierter. Neuen Varianten von SARS-CoV-2 fällt es immer leichter, der Kontrolle des Immunsystems zu entkommen. Die Antikörpertiter in Plasmaproben von dreifach geimpften Erwachsenen fielen einer Studie zufolge zum Beispiel um das Zwei- bis Dreifache gegenüber den neuen BA.4- bzw. BA.5-Omikron-Subtypen [1]. Die Impfstoffhersteller reagieren auf die Entwicklung des Coronavirus mit angepassten Omikron-Vakzinen. Welche neuen Omikron-Typen oder gänzlich neuen Varianten uns aber im Herbst und Winter beschäftigen könnten, ganz zu schweigen davon, wie gut die Impfstoffe gegen sie wirken, das kann im Moment noch keiner sagen. Sicher ist aber, dass die Entwicklung und Zulassung angepasster Impfstoffe der Mutationsfreudigkeit des Virus immer hinterherhinken wird. Die gute Nachricht: die Antikörpertiter im Blut reichen noch aus, um eine schwere Erkrankung zu verhindern, die schlechte: die Transmission des Virus kann so kaum aufgehalten werden und Durchbruchinfektionen nehmen stark zu [1]. Inwieweit die angepassten Vakzine hier punkten können, wird sich zeigen müssen. Die Zulassungsstudien untersuchten lediglich die Antikörpertiter im Blut der Probanden. Großangelegte Wirksamkeitsstudien sind an dieser Stelle der Impfstoffentwicklung nicht mehr nötig.
Mukosales Immunsystem als erste Verteidigungslinie
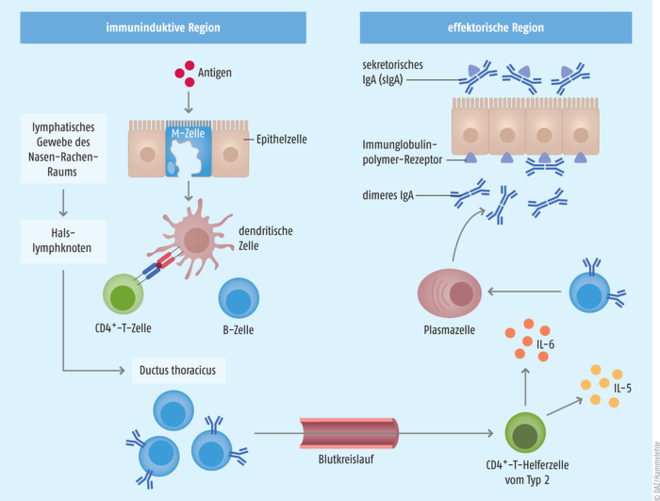
Eine Rolle für den Impferfolg spielt, dass intramuskuläre Impfungen vor allem die systemische Immunität stimulieren. Infektionen mit SARS-CoV-2 betreffen aber primär die Atemwege. Die lokale Infektabwehr wird dort vom sogenannten mukosalen Immunsystem übernommen: Als erste physikalische Barriere dient zunächst die Schleimhaut der Atemwege. Der Schleim besteht aus Mucinen, besonders stark glykosylierten Proteinen, die über ihre Zucker-Seitenketten Wasser binden und dem Schleim seine Viskosität verleihen. Epithel- sowie Immunzellen sezernieren in diese Schutzschicht zusätzlich Enzyme und Antikörper zur Abwehr von Eindringlingen. Diese unwirtliche Barriere müssen Erreger erst einmal durchdringen, ohne darin abgefangen und von den Flimmerhärchen des Epithels, den Zilien, beseitigt zu werden. Zwischen den Epithelzellen befinden sich in bestimmten Regionen sogenannte M-Zellen, die den Zugang zum eigentlichen Immunsystem der Schleimhäute, dem Mukosa-assoziierten lymphatischen Gewebe (MALT, mucosa-associated lymphoid tissue) bilden [2]. Der Nasopharynx besitzt sein eigenes lymphatische Gewebe, das sogenannte NALT (nasopharyngeal-associated lymphoid tissue) welches vor allem von den Tonsillen im Rachenraum, dem sogenannten Waldeyer-Rachenring, gebildet wird. Die M-Zellen leiten die Pathogene zu den unter dem Epithel befindlichen lymphatischen Gewebe weiter, wo die Antigene T- und B-Lymphozyten präsentiert werden, die im Rahmen der humoralen Immunantwort zusammen mit den Epithelzellen sekretorisches IgA (dimeres IgA) bilden (s. Abb.). Der Clou: die aktivierten B-Zellen verteilen sich über das lymphatische System zu anderen Schleimhäuten. B-Zellen aus der Nase können sich also auch in der Lunge ansiedeln oder auch in Genitalschleimhäuten und dort die Schleimhäute immunisieren. Die Immunreaktion bleibt aber nicht nur auf die Schleimhäute beschränkt, sondern stimuliert auch die systemische Immunantwort. Man vermutet, dass antigenpräsentierende dendritische Zellen aus der Nase über das Lymphsystem zur Milz migrieren und die dortigen Immunzellen stimulieren [3].
Abb.: Funktionsweise des Schleimhautimmunsystems Das Mukosa-assoziierte lymphatische Gewebe besteht aus induktiven und effektorischen Regionen. In den induktorischen Regionen gelegene M-Zellen, z. B. im lymphatischen Gewebe des Nasen-Rachen-Raums (NALT), nehmen die Pathogene auf und transportieren sie zu den unter der Epithelschicht liegenden Immunzellen: Antigen-präsentierende Zellen (z. B. dendritische Zellen) absorbieren die Erreger und präsentieren deren Antigene an ihrer Oberfläche. Passende T-Zellen werden dadurch aktiviert und stimulieren in B-Zellen den Isotypen-Switch von IgG zu IgA. Die B-Zellen verteilen sich über das lymphatische System zu den effektorischen Regionen, beispielsweise den Schleimhäuten der Nasengänge und Atemwege. Angekommen an ihrem Zielort, den effektorischen Regionen, wandeln sich die B-Zellen in Plasmazellen um, unterstützt von T-Helferzellen, die z. B. Interleukin (IL) 5 und 6 ausschütten. Die Plasmazellen produzieren dimeres IgA, welches von den Epithelzellen zu sekretorischem IgA (sIgA) prozessiert und in den Schleim abgegeben wird (modifiziert nach [2]).
Kaum Schleimhautimmunität durch intramuskuläre COVID-19-Impfstoffe
Ob eine intramuskulär applizierte Impfung auch die weit entfernte Mukosa stimuliert, wird kontrovers diskutiert. Im Falle von COVID-19 stimmen erste Indizien jedoch skeptisch. Eine Studie identifizierte im Blut von Genesenen und Geimpften zwar vergleichbare Antikörpertiter gegen das Ursprungsvirus als auch die Delta- und Omikron-BA-1.1-Variante [4]. Jedoch in der bronchoalveolären Lavage (bronchoskopische Spülung der tiefen unteren Atemwege mit isotonischer Kochsalzlösung) von Geimpften fielen diese Werte im Vergleich zu den genesenen Probanden empfindlich ab. IgA-Antikörper gegen das Virus konnten die Forscher nur im Lungensekret Genesener nachweisen, ebenso wie virusspezifische B- und T-Zellen.
Schon seit einiger Zeit werden deshalb nasale Impfstoffe als Anwärter gehandelt, diese Impflücke in der Mukosa der Atemwege zu schließen und so auch endgültig der Transmission des Virus Einhalt zu gebieten (s. Tab). Neu ist die Idee einer Schleimhautimpfung nicht. Zu den bereits zugelassenen Präparaten zählen z. B. der nasale Grippeimpfstoff Fluenz® zur Anwendung bei Kindern oder die Typhus-Schluckimpfung Typhoral®, beide nutzen attenuierte Erreger. Das Prinzip ist einfach: Der nasal oder auch oral eingebrachte Impfstoff soll eine Infektion mit dem Erreger simulieren und eine lokale und systemische Immunantwort hervorrufen. Nasal-Impfstoffe können hierzu mittels Nasenspray oder als Tropfen eingebracht werden. Weitere denkbare Formulierungen sind Pulver oder Gele [5].
Zehn nasale Impfstoffe in der Pipeline
Gegen COVID-19 sind mittlerweile zehn nasale Kandidaten in der klinischen Pipeline, drei davon bereits in der entscheidenden Phase III und zwei wurden kürzlich in China bzw. Indien zugelassen (s. Tab.). Dabei werden verschiedene Impfstoff-Technologien eingesetzt. Die drei im Phase-III-Stadium befindlichen nasalen COVID-19-Impfstoffe basieren auf viralen Vektoren, attenuierten Erregern und auf Proteinpartikeln. Kürzlich erhielt zudem das Projekt „Zell Trans“ des Klinikums der Universität München 1,7 Mio. Euro Validierungsförderung des Bundesforschungsministeriums. Ziel der Forscher ist es, mRNA- bzw. Plasmid-DNA-Lipidnanopartikel-basierte Impfstoffe zu entwickeln, die als Spray in die Atemwege eingebracht nicht nur als Impfstoffe gegen Atemwegserkrankungen dienen sollen, sondern möglicherweise auch als Vehikel für die Gentherapie von Lungenkrankheiten. Neben den nasalen Impfstoffen befinden sich außerdem drei Schluckimpfstoffe und zwei inhalative Impfstoffe in der Pipeline (s. Tab.).
Impfstoffbezeichnung | Impfstoffplattform | Hersteller | Applikationsroute | Dosierung | klinische Entwicklung |
|---|---|---|---|---|---|
CoviLivTM | attenuiertes Virus | Codagenix (USA) | intranasal | ein bis zwei Dosen | Phase III |
BBV154 | adenoviraler Vektor (nicht replizierend) | Bharat Biotech (IN) (bereits national zugelassen) | intranasal | eine Dosis | Phase III |
DelNS1-2019-nCoV-RBD-OPT1 | Influenza-Vektor (replizierend) | Beijing Wantai Biological Pharmacy Enterprise (CN) | intranasal | zwei Dosen im Abstand von 28 Tagen | Phase III |
CIGB-669 | proteinbasiert | Center for Genetic Engineering and Biotechnology (CUB) | intranasal | drei Dosen im Abstand von je 14 Tagen | Phase I/II |
MV-014-212 | attenuiertes Virus | Meissa Vaccines (USA) | intranasal | eine Dosis | Phase I |
CVXGA1 | Influenza-Vektor (nicht replizierend) | CyanVac LLC (USA) | intranasal | eine Dosis | Phase I |
ChAdOx1 nCOV-1 (d. h. intranasales Vaxzevria®) | adenoviraler Vektor (nicht replizierend) | University of Oxford/AstraZeneca (UK) | intranasal | zwei Dosen im Abstand von 28 Tagen | Phase I |
Razi Cov Pars | proteinbasiert | Razi Vaccine and Serum Research Institute (IRN) | intranasal und intramuskulär | drei Dosen im Abstand von je 20 Tagen | Phase III |
NDV-HXP-S | Spalt-Impfstoff | Laboratorio Avi-Mex (MEX) | intranasal oder intramuskulär | zwei Dosen im Abstand von 21 Tagen | Phase II/III |
Ad5-nCOV-IH | adenoviraler Vektor (nicht replizierend) | CanSino Biological (CN) (bereits national zugelassen) | inhalativ | eine Dosis | Phase III |
MVA-SARS-2-S | modifizierter Vacciniavirus-Ankara(MVA)-Vektor (nicht replizierend) | Deutsches Zentrum für Infektionsforschung / Medizinische Hochschule Hannover / Fraunhofer-Institut für Toxikologie und Experimentelle Medizin (D) | inhalativ | eine Dosis | Phase I |
VXA-CoV2-1 | adenoviraler Vektor (nicht replizierend) | Vaxart Inc. (USA) | oral (Tabletten) | zwei Dosen im Abstand von 28 Tagen | Phase II |
CoV2-OGEN1 | proteinbasiert | USSF/Vaxform (USA) | oral (Suspension) | ein bis zwei Dosen im Abstand von 14 Tagen | Phase I |
DNA bacTRL-Spike | DNA-basiert | Symvivo Corporation (CND) | oral (Suspension) | eine Dosis | Phase I |
Von den Phase-III-Kandidaten hat z. B. das amerikanische Biotech-Unternehmen Codagenix per Pressemitteilung schon positive Daten zu seinem nasalen attenuierten Impfstoff CoviLiv™ bekannt gegeben [6]: Zwei Impfungen mit dem Vakzin induzierten eine robuste IgG-Immunantwort im Serum, sowie mukosale IgA-Antikörper bei 40% der Probanden. Darüber hinaus teilt die Firma mit, dass der Lebendimpfstoff eine ausgeprägte T-Zell-Immunantwort auch gegen Nicht-Spike-Proteine hervorruft. Da diese Virusbestandteile über die Varianten im Gegensatz zum Spike-Protein hinweg konserviert sind, sieht Codagenix darin einen Schlüssel im Kampf gegen zukünftige Varianten. Solch eine breite Immunität wäre in der Tat ein Meilenstein, denn grundsätzlich laufen auch nasale Impfstoffe Gefahr, von neuen Varianten überlistet zu werden.
Warum IgA so wichtig ist
Während IgG die Zerstörung des Erregers einleitet, indem es das Komplement aktiviert und durch Opsonisierung phagozytische Immunzellen anlockt, fehlen IgA diese Eigenschaften weitestgehend. IgA-Antikörper immobilisieren den Eindringling lediglich und halten ihn vom Eindringen in die Epidermis ab. Das hat den Vorteil, dass eventuelle Toxine des Erregers nicht freigesetzt werden, da dieser gebunden an IgA intakt bleibt. Über die mukoziliäre Clearance wird der Erreger mit dem Schleim dann in den Rachen befördert und entweder abgehustet oder geschluckt.
Besondere Formulierungs-Anforderungen
Auch wenn diese Daten ermutigend klingen, sind nasale Vakzine keine Selbstläufer. Dass eine nasale Impfung oft keine ausreichende mukosale Immunantwort induziert, gilt als das größte Hindernis. Altimmune z. B. erklärte vor einem Jahr, dass das Unternehmen die Entwicklung seines nasalen Vektor-Impfstoffes AdCOVID™ einstellt, da das Vakzin in der Phase-I-Studie keine adäquate Immunantwort hervorrief [7]. Nasale Vakzine kommen mit ihren eigenen Anforderungen an die Formulierung. Wie auch Viren müssen die Impfstoffe zunächst die unwirtliche Schleimhautbarriere überwinden, um überhaupt an den Wirkort zu gelangen. Die darunter liegende Epithelschicht stellt aufgrund der Tight Junctions zwischen den Zellen ebenfalls keine einfach zu überwindende Hürde für den Impfstoff dar. Isolierte Impf-Antigene interagieren meist nicht mit dem Nasenepithel und werden deshalb oft zügig durch die mukoziliäre Clearance entfernt. Attenuierte Viren oder Vektoren, die aktiv in die Nasenschleimhaut eindringen können, sind hier im Vorteil. Aber auch Polymere können helfen, die Verweilzeit des Impfstoffs an der Nasenschleimhaut zu erhöhen, z. B. Chitosan, Poly(lactid-co-glycolid) (PLGA), Dextran [5]. Chitosan wirkt nicht nur mukoadhäsiv, sondern stimuliert adjuvant noch die lokalen Immunzellen [5]. Zu den weiteren Systemen, die die Passage von Antigenen durch die Epidermis und gleichzeitig die Stabilität des Vakzins fördern können, zählen Nanopartikel und Liposomen. Um die Immunantwort auf den Impfstoff zu erhöhen, werden auch Agonisten an den sogenannten Pattern-Recognition-Rezeptoren als Adjuvanzien hinzugefügt. Diese Rezeptoren, z. B. in Epithelzellen lokalisiert, erkennen bestimmte Pathogen-assoziierte molekulare Muster (PAMP, pathogen-associated molecular pattern), also molekulare Bestandteile, die oft bei Erregern auftreten, und führen zur Freisetzung von Zytokinen, die die Immunantwort stimulieren. Virale DNA-Bestandteile, bakterielle Polysaccharide, Flagellin oder zyklische Nucleotide werden als solche Adjuvanzien erforscht [8]. Bei der Suche nach einer passenden Strategie für das mukosale Delivery muss aber auch auf die Sicherheit des Impfstoffes geachtet werden. Potenziell besteht die Gefahr, dass der Impfstoff, insbesondere attenuierte Viren, über die Riechnerven ins Gehirn gelangen kann und neurologische Komplikationen nach sich zieht. Der in der Schweiz ehemals zugelassene nasale Grippeimpfstoff Nasalflu wurde nach der Markteinführung mit einem 19-fach erhöhten Risiko für eine Fazialisparese assoziiert [9]. Der Vertrieb musste eingestellt werden.
Vorteile sprechen für nasale Impfstoffe
Trotz der anspruchsvollen Entwicklung nasaler Vakzine lohnt sich der Aufwand nicht nur aufgrund des Versprechens der sterilen Immunität. Nasale Impfstoffe bieten weitere Vorteile. Die Verabreichung erfordert nicht unbedingt medizinisches Personal, eine schnelle und breite Impfkampagne ließe sich so einfach organisieren. Nasale Impfstoffe können grundsätzlich zur Grundimmunisierung oder als zusätzlicher Booster zu einer intramuskulären Impfung eingesetzt werden. Da kein Nadelpiks notwendig ist, könnte sich außerdem eine breitere Akzeptanz einer Impfung einstellen. |
Literatur
[1] Tuekprakhon A et al. Antibody escape of SARS-CoV-2 Omicron BA.4 and BA.5 from vaccine and BA.1 serum. Cell 2022;185:2422-2433
[2] Tibona M et al. Nasal vaccination against SARS-CoV-2: Synergistic or alternative to intramuscular vaccines? Int J Pharm 2021;603:120686
[3] Borges O et al. Mucosal vaccines: Recent progress in understanding the natural barriers. Pharm Res 2010;27:211-223
[4] Tang J et al. Respiratory mucosal immunity against SARS-CoV-2 following mRNA vaccination. Sci Immunol 19. Juli 2022;eadd4853, doi: 10.1126/sciimmunol.add4853, Online ahead of print
[5] Tai J et al. Different Methods and Formulations of Drugs and Vaccines for Nasal Administration. Pharmaceutics 2022;14:1073
[6] Codagenix Intranasal COVID-19 Vaccine Shows Potent Cellular Immune Response Against Conserved Viral Proteins, Indicating Potential for Immunogenicity Against Omicron and Future Variants in Phase 1 Data. Pressemitteilung Codagenix Inc. vom 17. März 2022, https://codagenix.com/codagenix-intranasal-covid-19-vaccine-shows-potent-cellular-immune-response-against-conserved-viral-proteins-indicating-potential-for-immunogenicity-against-omicron-and-future-variants-in-phase-1-dat/
[7] Altimmune Announces Update On AdCOVID™ Phase 1 Clinical Trial. Pressemitteilung Altimmune vom 29. Juni 2021, https://ir.altimmune.com/news-releases/news-release-details/altimmune-announces-update-adcovidtm-phase-1-clinical-trial
[8] Alu A et al. Intranasal COVID-19 vaccines: From bed to bench. EBioMedicine 2022;76:103841
[9] Mutsch M et al. Use of the Inactivated Intranasal Influenza Vaccine and the Risk of Bell‘s Palsy in Switzerland. N Engl J Med 2004;350:896-903
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.