
- DAZ.online
- News
- Zweifel an der ...
Biosimilars
Zweifel an der Austauschbarkeit
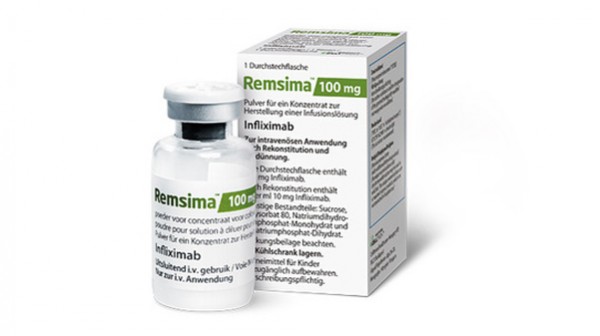
Im Juli 2013 wurde in der EU das erste Biosimilar des monoklonalen Antikörpers (mAb) Infliximab (Inflectra, Remsima) für die gleichen Indikationen wie das Originalpräparat Remicade zugelassen – unter anderem Morbus Crohn und Colitis ulcerosa. Doch an dem Vertrauen in den Einsatz von Biosimilars muss noch erheblich gearbeitet werden. Dies zeigen die Ergebnisse einer Mitgliederbefragung der Europäischen Crohn und Colitis Organisation (ECCO).
Insgesamt 307 Mitglieder der ECCO, allesamt Experten auf diesem Gebiet, beteiligten sich an der Umfrage. 68 Prozent arbeiteten in einer Universitätsklinik, 87 Prozent haben mehr als zwei Jahre Erfahrung mit der Verordnung von monoklonalen Antikörpern. Auf die Frage nach den Vorteilen eines mAb-Biosimilars nannten fast 90 Prozent die Kostenersparnis. Viele hegen jedoch Zweifel an der tatsächlichen Identität der Präparate. Manche befürchten andere Immunogenitäts-Muster oder erhöhte Neurotoxizität durch ein Biosimilar.
Weniger als die Hälfte der Befragten (39 %) würde sich bei der Verschreibung von Biosimilars sicher fühlen, der Rest erklärte, sich entweder gar nicht oder kaum sicher zu fühlen. Hinsichtlich der Austauschbarkeit gaben zwei Drittel an, dass sie bei einem Patienten nicht auf ein Biosimilar umsteigen würden, da es keine krankheitsspezifischen Erkenntnisse über die Austauschbarkeit gebe. Lediglich knapp sechs Prozent würden einen Präparate-Wechsel vornehmen, 22 Prozent nur nach vorheriger detaillierter Aufklärung des Patienten.
Eine automatische Substitution durch die Apotheker wird weitgehend abgelehnt. 85 Prozent der Befragten würden dies nicht befürworten.
Unter Berufung auf eine Erhebung aus dem Jahr 2012 rechnet GaBI zwischen 2007 und 2020 mit Gesamteinsparungen zwischen 11,8 und 33,4 Milliarden Euro durch den Einsatz von Biosimilars in Europa. Der Löwenanteil davon entfiele auf Frankreich, Deutschland und Großbritannien.


























Remagen - 27.08.2014, 11:13 Uhr