
- DAZ.online
- News
- Regierung plant keinen ...
Medizinprodukte
Regierung plant keinen Systemwechsel
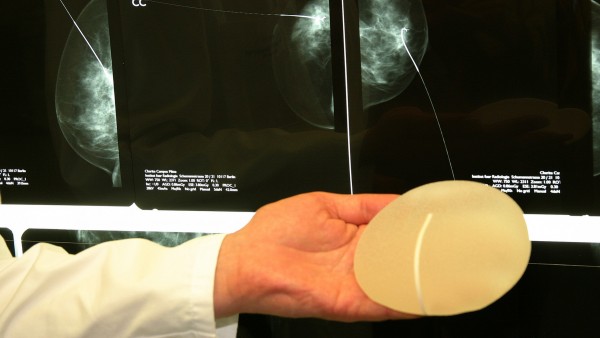
Immer mehr kritische Stimmen fordern, in Bezug auf Medizinprodukte, Reformen, um künftig Skandale, wie etwa den um die PIP-Brustimplantate, zu verhindern. Die Bundesregierung lehnt grundsätzliche Veränderungen aber ab: „Ein Systemwechsel wäre sehr zeit- und bürokratieaufwendig und würde allein nicht zu einer messbaren Verbesserung der Patientensicherheit führen“, erklärt Ingrid Fischbach, parlamentarische Staatssekretärin im Bundesgesundheitsministerium auf eine Kleine Anfrage der Grünen.
Nach Auffassung der Bundesregierung stellt ein Systemwechsel „keine adäquate Lösung“ hinsichtlich der vom Sachverständigenrat in seinem Gutachten angeführten Kritik dar. Das Beratergremium hatte angeregt, das Konzept der zentralen Arzneimittelzulassung auf den Medizinproduktesektor zu übertragen. Doch das wäre unter anderem „mit einem erheblichen Zeitaufwand, hohen Kosten und der Zerschlagung gerade erst verbesserter Marktzugangsstrukturen verbunden“, erklärt Fischbach. Die Probleme könnten und müssten vielmehr „innerhalb des Systems gelöst werden“.
Entsprechende Vorschläge habe die deutsche Regierung bereits in Verhandlungen auf EU-Ratsebene eingebracht: strengere Anforderungen an die benannten Stellen und deren Benennungsprozess, engmaschige Kontrollen der benannten Stellen und die Entwicklung spezifischer Produktanforderungen, insbesondere auch hinsichtlich klinischer Bewertungen und Prüfungen. Im Übrigen gebe es auch keine Erkenntnisse darüber, dass staatliche Behörden per se für die Produktzulassung besser geeignet seien als benannte Stellen.
Zu weiteren Vorschlägen führt Fischbach aus: Kernanliegen der Regierung sei es, die zügige Einführung eines funktionierenden UDI-Systems (Unique Device Identifier) zur Identifizierung und Rückverfolgbarkeit auf europäischer Ebene, voranzutreiben. Zudem habe man mit der neuen „Verordnung zur Abgabe von Medizinprodukten und zur Änderung medizinprodukterechtlicher Vorschriften“ implantierende Einrichtungen mit einer Übergangsfrist verpflichtet, ihre Aufzeichnungen so zu führen, dass betroffene Patientenkreise bei korrektiven Maßnahmen innerhalb von drei Werktagen ermittelt werden können, sowie bei bestimmten Implantaten einen Implantateausweis auszuhändigen.
Darüber hinaus verweist Fischbach auf den Koalitionsvertrag, der die Zielsetzung enthalte, das Bewertungsverfahren des gemeinsamen Bundesausschusses im Hinblick auf Methoden mit Medizinprodukten hoher Risikoklasse weiterzuentwickeln. Wegen der Unterschiede zu Arzneimitteln komme eine einfache Übertragung des im AMNOG geregelten Prozesses allerdings nicht unmittelbar in Betracht. Ebenfalls wenig hält die Regierung von einer frei zugänglichen Rechercheplattform aller Medizinprodukte: „Gemessen am bürokratischen Aufwand ist nicht ersichtlich, worin der Nutzen für eine Plattform aller Medizinprodukte […] liegen soll.“ Relevante Informationen bei Vorkommnissen liefere bereits die Seite des Bundesinstituts für Arzneimittel und Medizinprodukte.
Aus Sicht der Grünen ist diese Reaktion der Regierung eine bittere Enttäuschung: „Unter Union und SPD wird es zu keiner wesentlichen Verschärfung der Zulassung und des Inverkehrbringens von Medizinprodukten im Hochrisikobereich kommen“, kritisiert die Sprecherin für Prävention und Gesundheitswirtschaft, Kordula Schulz-Asche. „Die Große Koalition muss endlich den Mut für einen echten, längst überfälligen Systemwechsel aufbringen, anstatt an kleinen Stellschrauben zu drehen. Diesen Mut hatte die SPD zu Oppositionszeiten, in der Regierung hat er sie wohl verlassen.“ Diese Rolle rückwärts schade den Patienten. Es brauche strengere Zulassungsregeln für Medizinprodukte im Hochrisikobereich sowie eine langfristige Marktüberwachung.
























Berlin - 08.09.2014, 14:14 Uhr