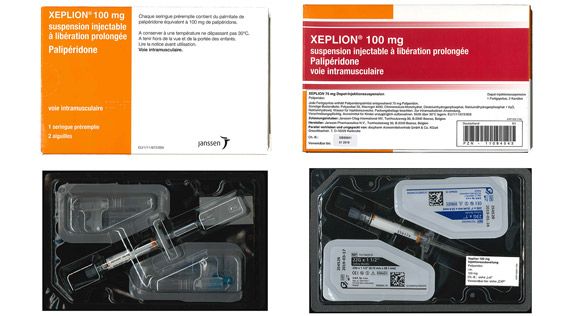
„Das BfArM weist Großhändler, Apotheker und Ärzte darauf hin,
die Packung, die Chargenbezeichnung und den Vertreiber vor Anwendung zu prüfen
und Verdachtsfälle dem BfArM zu melden“, erklärt die Behörde. Die
Untersuchungen seien noch nicht abgeschlossen, die Lieferkette der Fälschung
werde weiter untersucht. „Sicher ist, dass die Fälschungen über
Parallelvertreiber auf den deutschen Markt gelangt sind“, heißt es in der Meldung.
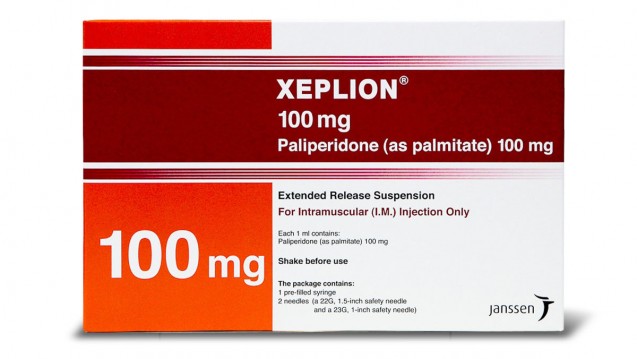
Die Reimporteure Orifarm, FD Pharma, Abacus Medicine A/S und Haemato Pharm haben bereits Rückrufe für beide Chargen veranlasst, ADL Pharma und Axicorp haben nur die Charge GFB4D00_BG-RO zurückgerufen, CC Pharma nur die Charge GEB3Z00. Die Rückrufe gehen bis auf Patientenebene, belieferte Einrichtungen sollen informiert und gegebenenfalls eine Rückholung veranlasst werden. Apotheker werden außerdem aufgefordert, ihren Warenbestand zu prüfen. Nach Auskunft von Orifarm sei die betroffene Ware am 11. Januar 2017 erstmalig ausgeliefert worden, bei den anderen Reimporteuren war dies zu späteren Zeitpunkten der Fall.
Untersucht wird derzeit auch die These, ob es sich bei dem Arzneimittel um Originalware handelt, das von Fälschern neu verpackt wurde. Laut Janssen sind durch die Rückrufe keine Lieferengpässe in Deutschland zu erwarten, da das Arzneimittel im Original ausreichend verfügbar sei.
Bereits im März hatte der Reimporteur Docpharm einen Rückruf einer Charge Xeplion® 100 mg Depot-Injektionssuspension mit einer Fertigspritze veranlasst – versehentlich habe das Arzneimittel das Etikett von Xeplion® 100 mg Depot-Injektionssuspension erhalten. Laut Hersteller Janssen gibt es keinen Zusammenhang mit dem aktuellen Fälschungsfall.
Update: Aufgrund der BfArM-Meldung vom Dienstagnachmittag wurde der Artikel entsprechend aktualisiert.



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.