Guselkumab war erster IL-23-Antikörper
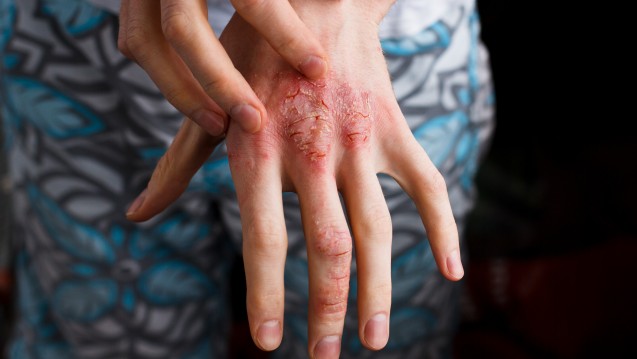
Die Bedeutung von IL-23 bei Psoriasis haben auch andere Pharmakonzerne erkannt und nutzen IL-23 bereits als Target. Der erste selektive IL-23-Antikörper erhielt im November 2017 die EU-weite Zulassung: Guselkumab in Tremfya®. Janssen überholte mit Guselkumab den ebenfalls selektiven IL-23-Antikörper Tildrakizumab. Bereits vor einem Jahr, im März 2017, hatte Almirall Tildrakizumab bei der EMA zur Zulassung eingereicht – jedoch, bislang offenbar erfolglos.
Risankizumab testete Abbvie nicht nur gegen Placebo. In ultIMMA-1 und ultIMMA-2 verglich der Pharmakonzern seinen IL-23p19-Antikörper Head-to-Head mit Ustekinumab (Stelara®). Laut Abbvie erreichten die Patienten unter Risankizumab ein signifikant besseres Ansprechen als unter Ustekinumab. Ustekinumab richtet sich dual gegen IL-12 und IL-23.
Auch im direkten Vergleich (IMMvent) zu Abbvies hauseigenem TNF-α-Antagonisten Adalimumab (Humira®) zeigte sich nach Mitteilung des Unternehmens Risankizumab als signifikant überlegen.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.