
- DAZ.online
- News
- Pharmazie
- Glucagon in Baqsimi: ...
CHMP-Zulassungsempfehlung
Glucagon in Baqsimi: nasal statt Injektion
Stuttgart - 22.10.2019, 11:29 Uhr
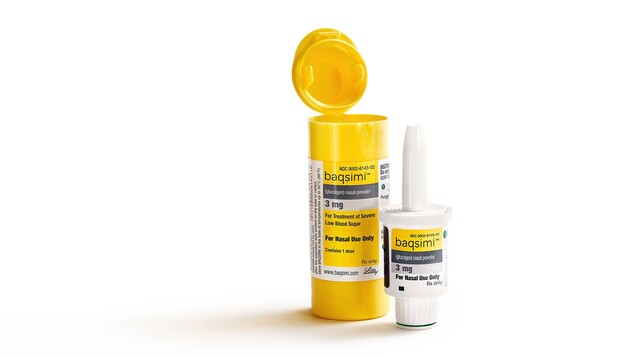
Baqsimi ist das erste Notfall-Glucagon, das nicht injiziert werden muss. Das Glucagon-Nasenpulver soll zur Notfallbehandlung schwerer Hypoglykämien zum Einsatz kommen und darf bei Diabetikern bereits ab vier Jahren angewendet werden. ( r / Packshot: Baqsimi / Lilly)
Die Therapie schwerer Hypoglykämien bei Diabetikern wird einfacher: Der CHMP empfiehlt, Baqsimi Nasenpulver auch in der EU zuzulassen. Es ist das erste Notfall-Glucagon, das nicht injiziert werden muss. Auch Kinder ab vier Jahren dürfen, so die Europäische Kommission die Zulassung erteilt, Baqsimi anwenden. Laut Hersteller Lilly funktioniert die Hypoglykämie-Therapie auch bei verstopfter Nase und Schnupfen.
Baqsimi® – Nasenpulver statt Injektion: Das erste Glucagon zur Notfallbehandlung schwerer Hypoglykämien – das nicht injiziert werden muss – steht auch Diabetikern in Europa voraussichtlich bald zur Verfügung. Nachdem BaqsimiTM in den Vereinigten Staaten bereits im August dieses Jahres das „Go“ der amerikanischen Arzneimittelbehörde FDA erhielt, hat das Glucagon-Nasenpulver jetzt auch die Europäische Arzneimittel-Agentur EMA (European Medicine Agency) überzeugt: Der dortige Ausschuss für Humanarzneimittel (CHMP) empfahl in seiner letzten Oktobersitzung, Baqsimi® auch in der EU zuzulassen. Hersteller hinter Baqsimi® ist der Pharmakonzern Lilly. Die CHMP-Zulassungsempfehlung ist nur ein „Zwischenschritt“ zum Marktzugang des innovativen Arzneimittels. Die finale Zulassungsentscheidung fällt die Europäische Kommission.
Mehr zum Thema

Diabetes: FDA lässt Baqsimi Nasenpulver zu
Erstes nasales Glucagon bei schwerer Hypoglykämie
Baqsimi: auch für Kinder
Das Glucagon-Nasenpulver soll zur Notfallbehandlung schwerer Hypoglykämien zum Einsatz kommen und darf bei Diabetikern bereits im Kindesalter angewendet werden. Mindestalter der pädiatrischen Diabetiker ist vier Jahre.
Nur bei schweren Hypoglykämien
Glucagon kommt nur bei schweren Hypoglykämien zum Einsatz, die in der Regel unter Insulintherapie auftreten. Die sich derzeit in Überprüfung befindende Leitlinie „Therapie des Typ-2-Diabetes“ unterscheidet bei Hypoglykämien zwischen „klinisch leichten“ Unterzuckerungen, bei denen der Patient diese selbst erkennt und behebt, und „schweren“ Hypoglykämien, bei denen Fremdhilfe notwendig ist. Der CHMP definiert eine „schwere Hypoglykämie“ analog: Die Blutzuckerspiegel sind derart niedrig, dass der Patient dadurch verwirrt oder bewusstlos wird und auf die Hilfe anderer angewiesen ist.
Glucagon mobilisiert – endogen oder nach externer Applikation – Glucosereserven der Leber, in deren Folge die Blutglucosespiegel steigen, und fungiert so als Gegenspieler zum Insulin.
Schneller im Notfall
Baqsimi® ist das erste Glucagon-Präparat, das im Notfall, bei schweren Hypoglykämien, nicht injiziert werden muss. In Deutschland ist derzeit nur Glucagen® beziehungsweise Glucagen® Hypokit „zur Behandlung schwerer hypoglykämischer Reaktionen, die bei der Insulintherapie von Kindern und Erwachsenen mit Diabetes mellitus auftreten können“ zugelassen.
Bis im Notfall dieses Glucagon jedoch appliziert werden kann, sind mehrere Schritte erforderlich, denn das Glucagonpulver muss zunächst mit Wasser für Injektionszwecke rekonstituiert werden, bevor dann die subcutane oder intramuskuläre Gabe erfolgen kann: Aufziehen des Wassers für Injektionszwecke in einer Einwegspritze, Injizieren des Wassers für Injektionszwecke in die Durchstechflasche, die das komprimierte Glucagon Pulver enthält, vollständiges Lösen des Glucagons, Aufziehen der Lösung wieder in die Spritze, Applikation.
Das benötigt Zeit, was im hypoglykämischen Notfall nicht optimal ist.
Mit nasalem Baqsimi® soll dies einfacher werden. Die FDA hob den Vorteil des nasalen Glucagons anlässlich der Zulassung von BaqsimiTM in einer Mitteilung im August wie folgt hervor: „Die neue Art der Verabreichung von Glucagon kann diesen Prozess nun vereinfachen. In kritischen Situation, in denen der Patient bewusstlos ist oder krampft, wollen wir die Behandlung des Patienten so einfach wie möglich machen.“
Gebrauchsfertiger nasaler Einmalspender
Lilly verpackt das Glucagon in Baqsimi® in einem nasalen und gebrauchsfertigen Einmalspender. In den USA steckt der Nasenapplikator in einer mir Folie verschweißten Kunststoffbox – beides darf erst im Notfall geöffnet werden, da Glucagon dadurch vor Feuchtigkeit geschützt ist. Es ist anzunehmen, dass Lilly diese Verpackung auch für den europäischen Markt wählen wird.
Der Einmalspender enthält lediglich eine Dosis und muss nach Anwendung weggeworfen werden. Sollte nach 15 Minuten keine Wirkung eintreten, kann der Patient eine zweite Dosis verabreicht bekommen – falls ein weitere Baqsimi®-Packung vorrätig ist. Auf der Baqsimi®-Homepage empfiehlt Lilly, dass sich Familie und Freunde beziehungsweise Pflegepersonal mit der Anwendung von Baqsimi® vertraut machen – und zwar bevor ein hypoglykämischer Notfall eintritt. Baqsimi® wird in ein Nasenloch verabreicht und muss nicht inhaliert werden, laut Lilly wirkt Baqsimi® auch bei Schnupfen und verstopfter Nase. Das betont auch der CHMP: „Patienten müssen nach der Dosierung nicht einatmen oder tief durchatmen, was die Medikamentenverabreichung auch bei bewusstlosen Patienten ermöglicht“, heißt es in einer Mitteilung.
Baqsimi muss nicht in den Kühlschrank
Vorteilhaft ist, dass Baqsimi® nicht im Kühlschrank gelagert werden muss, Lilly empfiehlt eine Lagerung unter 30 °C. Das ist bei injizierbarem Glucagon anders. Das in Deutschland zugelassene Produkt von Novo Nordisk, Glucagen® Hypokit muss bei 2 bis 8 °C im Kühlschrank gelagert werden, der Anwender kann es sodann für 18 Monate bei unter 25 °C aufbewahren.
Blutzuckererhöhende Wirkung von nasalem und injizierbarem Glucagon vergleichbar
Die Wirksamkeit und Sicherheit von Baqsimi® Nasenpulverglucagon zur Behandlung schwerer Hypoglykämie wurden in zwei Studien an 83 und 70 Erwachsenen mit Diabetes untersucht. Patienten mit insulinbedingter Hypoglykämie erhielten entweder eine Einzeldosis Baqsimi® oder eine Einzeldosis eines injizierbaren Glucagons: Baqsimi® und injiziertes Glucagon erhöhten die Blutzuckerspiegel vergleichbar. Ähnliche Ergebnisse zeigte Baqsimi® auch in einer pädiatrischen Studie an 48 Typ-1-Diabetikern (älter als vier Jahre).
Nebenwirkungen von Baqsimi
Zu den häufigsten Nebenwirkungen bei der Anwendung von Baqsimi® zählten Übelkeit, Erbrechen, Kopfschmerzen, Reizungen der oberen Atemwege, tränende Augen, Rötungen der Augen und Juckreiz. Die bei der nasalen Anwendung von Glucagon beobachteten Nebenwirkungen ähneln somit denen von injizierbarem Glucagon – allerdings kommen bei der nasalen Applikation zusätzlich nasale und augenbezogene Symptome, wie tränende Augen und eine verstopfte Nase, hinzu. Das führt die EMA auf die Anwendungsart des Medikaments zurück.
EMA ordnet risikominimierende Maßnahmen an
Der CHMP sieht offenbar die Gefahr einer fehlerhaften Anwendung des Nasenapplikators. Der Humanarzneimittelausschuss spricht sich mit der Zulassungsempfehlung für zusätzliche Maßnahmen aus, um das potenzielle Risiko einer unsachgemäßen Verwendung von Baqsimi® zu minimieren und zu verhindern. Dazu gehört ein Demonstrationskit mit einem Übungsgerät sowie eine Broschüre und ein Video zur Anwendung des nasalen Glucagons. Das Demonstrationskit soll in erster Linie an Ärzte ausgegeben werden, die Baqsimi verschreiben, auf Nachfrage soll es jedoch auch Diabetikern, deren Angehörigen oder Pflegekräften zur Verfügung gestellt werden.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.