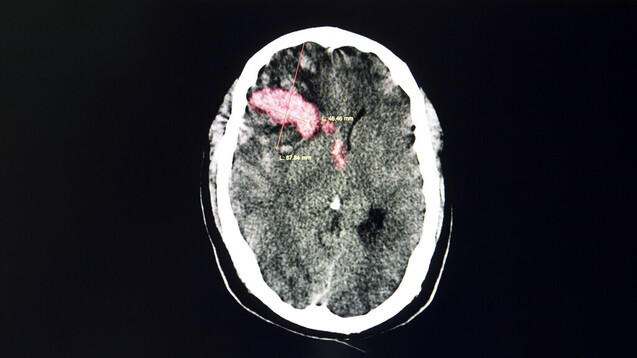
So wirkt Andexanet alfa
Andexanet alfa ist eine rekombinante Form des humanen FXa Proteins. Das Serin im aktiven Zentrum wurde durch Alanin ersetzt, somit fehlt ihm die enzymatische Aktivität von FXa. Ferner wurde die γ-Carboxyglutaminsäure (Gla)-Domäne entfernt. Auf diese Weise wurden dem Protein sämtliche antikoagulatorische Wirkungen entzogen. Andexanet alfa kann die Wirkung der FXa-Inhibitoren spezifisch inhibieren, sodass sie für die Entfaltung ihrer antikoagulatorischen Wirkungen nicht mehr zur Verfügung stehen. Man geht davon aus, dass der primäre Wirkmechanismus in der Bindung des FXa-Inhibitors besteht. Unter Umständen spielt auch die Hemmung der Aktivität des Gewebefaktor-Pathway-Inhibitors (tissue factor pathway inhibitor, TFPI) über die Bindung an den TFPI einen eine kleine Rolle bei der Gesamtwirkung. Das Zusammenspiel ist aber noch nicht vollständig erforscht.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.