
- DAZ.online
- News
- Pharmazie
- Wann welcher COVID-19-...
Bivalenter Booster für Kinder ab fünf Jahren
Wann welcher COVID-19-Impfstoff – und für welche Altersgruppe?
Stuttgart - 14.11.2022, 16:45 Uhr
Der Humanarzneimittelausschuss der EMA hat empfohlen, die Zulassung für die bivalente Version von Comirnaty, die sich gegen BA.4 und BA.5 richtet, auf Kinder ab fünf Jahren zu erweitern. (Foto: IMAGO / Beautiful Sports)
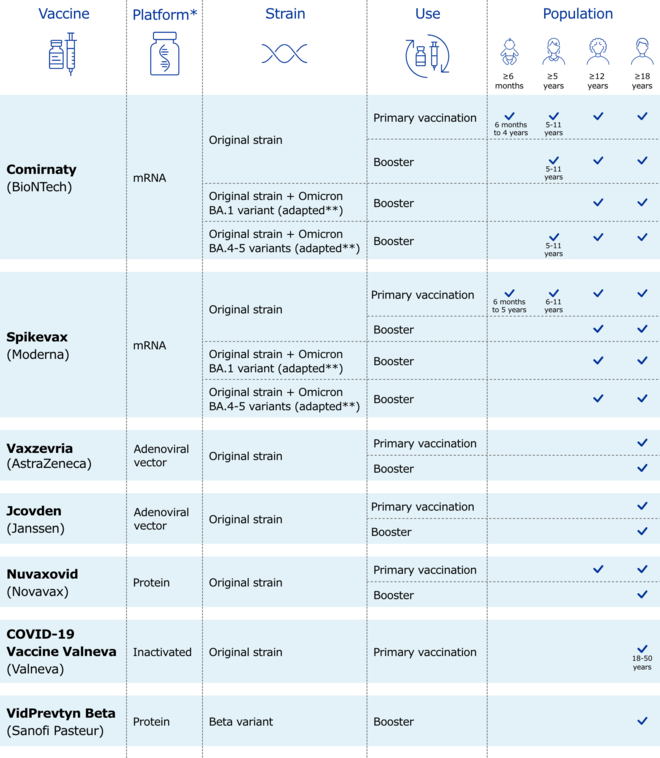
Die Palette der COVID-19-Impfstoffe in der EU umfasst mittlerweile sieben Zulassungen. Während manch einer davon erst vor Kurzem für die Anwendung bei Erwachsenen zugelassen wurde, wurde bei anderen die Zulassung bereits auf Kleinkinder oder bivalente Auffrischimpfungen erweitert. Die EMA bietet eine tabellarische Übersicht darüber, wann welcher Impfstoff in welcher Altersgruppe zugelassen ist.
Seit Oktober dürfen auch Kleinkinder laut Zulassung in Europa (noch keine STIKO-Empfehung) sowohl mit Comirnaty als auch Spikevax gegen COVID-19 geimpft werden. Dabei handelt es sich um die herkömmlichen mRNA-Impfstoffe, die sich gegen den ursprünglichen SARS-CoV-2-Stamm richten und nicht um die neuen für die Auffrischimpfungen in höheren Altersgruppen empfohlenen bivalenten Impfstoffe.
„Comirnaty Original / Omicron BA.1“ und „Spikevax Bivalent Original/Omicron BA.1“ sind seit September für Auffrischimpfungen von Personen ab zwölf Jahren vorgesehen, genauso wie kurz darauf „Comirnaty Original/Omicron BA.4-5“ und seit Oktober auch „Spikevax bivalent Original/Omicron BA.4-5“.
Mehr zum Thema
Vielfalt als Schlüsselelement der Impfstrategie
EMA empfiehlt an Omikron BA.1 angepasste Corona-Impfstoffe zur Zulassung

Comirnaty Original/Omicron BA.4-5
EMA empfiehlt auch an BA.4 und BA.5 angepassten Impfstoff zur Zulassung

COVID-19-Impfstoffe
EMA empfiehlt Standardzulassungen für Comirnaty und Spikevax
Ende September hatte sich zudem bereits abgezeichnet, dass die angepassten bivalenten Impfstoffe bald auch für Kinder ab fünf Jahren zugelassen werden könnten. Wie die EMA vergangenen Freitag verkündete, ist es jetzt so weit: Der Humanarzneimittelausschuss hat empfohlen, die Zulassung für die bivalente Version von Comirnaty, die sich gegen BA.4 und BA.5 richtet, auf Kinder ab fünf Jahren zu erweitern. Damit bietet Biontech den ersten bivalenten COVID-19-Impfstoff, der in der EU für die Auffrischimpfung von Kindern zugelassen wurde.

Auch für Kleinkinder?
Biontech / Pfizer: Zulassungsantrag für an BA.4/BA.5 angepassten COVID-19-Impfstoff

COVID-19-Impfstoff von Sanofi
Vidprevtyn beta: Booster-Zulassung für weiteren Protein-Untereinheiten-Impfstoff
Wer mittlerweile den Überblick verliert, welcher COVID-19-Impfstoff für welche Impfung in welcher Altersgruppe zugelassen ist, der findet bei der EMA eine tabellarische Übersicht:
Daraus geht beispielsweise hervor, dass lediglich Comirnaty sowohl in seiner ursprünglichen Version als auch in der bivalenten BA.4/BA.5-Variante für Kinder ab fünf Jahren für Auffrischimpfungen zugelassen ist. Spikevax darf in seinen verschiedenen Varianten ab zwölf Jahren als Booster zum Einsatz kommen – Vaxzevria, Jcovden, Nuvaxovid und VidPrevtyn Beta als Booster erst bei Erwachsenen.
Boostern mit COVID-19-Impfstoffen – ein Überblick
Welches Vakzin soll es sein?

Aktualisierte STIKO-Empfehlung
COVID-19: Wer sollte jetzt boostern und mit welchem Impfstoff?
Die Ständige Impfkommission STIKO in Deutschland empfiehlt aktuell „für Auffrischimpfungen ab 12 Jahren vorzugsweise einen der zugelassenen und verfügbaren Omikron-adaptierten bivalenten mRNA-Impfstoffe (Comirnaty Original/Omicron BA.1, Comirnaty Original/Omicron BA.4/5 oder Spikevax bivalent Original/Omicron BA.1).“ Bei der STIKO heißt es aber auch (noch): „Für die Grundimmunisierung in allen Altersgruppen und für die Auffrischimpfung im Alter von 5 –11 Jahren mit einer entsprechenden Indikation müssen weiterhin die jeweils für die Altersgruppe empfohlenen und zugelassenen herkömmlichen, monovalenten Impfstoffe verwendet werden.“ Es bleibt also abzuwarten, ob die STIKO künftig auch den bivalenten Impfstoff von Biontech für Auffrischimpfungen ab fünf Jahren empfiehlt.
Generell wird von der STIKO für alle gesunden Kinder zwischen fünf und elf Jahren zunächst nur eine Impfstoffdosis zur Grundimmunisierung empfohlen. Bei individuellem Wunsch von Kindern und Eltern bzw. Sorgeberechtigten kann laut STIKO aber auch die vollständige COVID-19-Grundimmunisierung ohne Vorerkrankungen nach ärztlicher Aufklärung erfolgen. Auffrischimpfungen sind bei gesunden Kindern zwischen fünf und elf Jahren zunächst also nicht vorgesehen.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.