
- DAZ.online
- DAZ / AZ
- DAZ 10/2015
- Angriff der Mikroben
Infektiologie
Angriff der Mikroben
Grundlagen der Infektiologie
Worüber reden wir?
Um sich mit dem Titel umfänglich auseinanderzusetzen, ist es hilfreich, einige Begriffe zu definieren. Zunächst einmal „Mikrobe“: Eigentlich ist es ja trivial, dass darunter Mikroorganismen, also kleinste Lebewesen, fallen. Bei genauerer Betrachtung umfasst dieser Begriff aber doch sehr unterschiedliche Organismusformen. Viren sind z. B. gar keine eigenständig lebensfähige Organismen, sondern vielmehr Informationspakete, die in der Lage sind, höher organisierte Zellen zu entern und sie für ihre Zwecke arbeiten zu lassen. Auch bei den Bakterien lassen sich sehr unterschiedliche Typen unterscheiden: grampositive oder gramnegative, fakultativ aerobe und fakultativ anaerobe, intrazellulär lebende und nur vorübergehend intrazellulär lebende. Zusätzlich zu den prokaryontischen Organismen können uns Menschen auch eukaryontische Lebewesen wie Pilze und einzellige Parasiten (Plasmodien, Trypanosomen) gefährlich werden; sogar die recht hoch entwickelten Schistosomen werden teilweise als Mikroben bezeichnet. Man kann also nicht von „der“ Mikrobe schlechthin sprechen.
Unter dem Begriff „Infektiologie“ verstehen die meisten die Lehre von Infektionskrankheiten und den sie auslösenden Mikroorganismen. Somit sind hier Teile der Bakteriologie, Virologie und Parasitologie zu finden. Von erheblicher Bedeutung ist aber auch die Epidemiologie. Denn nur über die Kenntnis, wie und wie schnell sich übertragbare Erkrankungen ausbreiten, lassen sich gegebenenfalls rechtzeitig geeignete Gegenmaßnahmen ergreifen. Dies konnten und können wir in Westafrika an der Ebola-Epidemie beobachten.
Wenn sich Infektionen ausbreiten, ist eine möglichst eindeutige Erfassung der Erkrankungszahlen wichtig, und hier spielen die Begriffe „Prävalenz“ und „Inzidenz“ eine Rolle:
- Unter der Prävalenz einer Krankheit in einer Population versteht man den Anteil an erkrankten Personen an einem Stichtag (Punktprävalenz) oder in einem definierten Zeitraum (Periodenprävalenz, Lebenszeitprävalenz).
- Mit Inzidenz wird hingegen der Anteil der Neuerkrankten pro Zeitraum – in der Regel pro Jahr – in der Population beschrieben.
Endemie, Epidemie und Pandemie
Bei Infektionskrankheiten wird je nach Auftreten und Verbreitung zwischen den Begriffen „Endemie“, „Epidemie“ und „Pandemie“ unterschieden, und zwar völlig unabhängig davon, wie tödlich eine Infektionskrankheit verläuft.
Unter einer Endemie ist ein andauernd gehäuftes Auftreten einer Krankheit in einem begrenzten Bereich zu verstehen. Die Inzidenz in dem Gebiet bleibt mehr oder weniger gleich, ist aber im Verhältnis zu anderen Gebieten erhöht. Ein Beispiel ist die Malaria, die in etwa 100 Ländern tropischer und subtropischer Regionen in Afrika, Asien und Amerika endemisch ist. Etwa 40 Prozent der Weltbevölkerung lebt in diesen Malaria-Endemiegebieten. Jedes Jahr erkranken dort schätzungsweise 250 Millionen Menschen an Malaria, und ca. 800.000 bis 1,2 Millionen sterben daran.
Demgegenüber tritt bei einer Epidemie eine Erkrankung zeitlich und örtlich gehäuft auf, sodass die Inzidenz im Verlauf zunimmt. Derzeit ist Westafrika von einer schweren Ebola-Epidemie betroffen. Ebola tritt immer wieder sporadisch und bisher recht kurzzeitig auf, sodass man nicht von einer endemischen Erkrankung sprechen kann. Auch die stärkeren Grippewellen in den Wintermonaten sind als Epidemie einzustufen, ebenso die 2011 aufgetretenen Fälle der EHEC-Infektion (Enterohämorrhagische E. coli).
Eine Epidemie wird zur Pandemie, wenn sie sich über mehrere Länder und Kontinente ausbreitet; eine Pandemie ist zwar zeitlich, aber nicht örtlich begrenzt. Die letzten Pandemien, die von der WHO klassifiziert wurden, waren das severe acute respiratory syndrome (SARS) in den Jahren 2003 bis 2004 und die pandemische Influenza 2009. Auch die HIV-Infektion ist eigentlich eine Pandemie. Dennoch sind auf der Homepage des Robert Koch-Instituts deutlich mehr Eintragungen unter „HIV-Epidemie“ als unter „HIV-Pandemie“ zu finden.
Verlauf einer Infektionskrankheit
Der Verlauf einer Infektionskrankheit ist gekennzeichnet durch
1. die Infektion,
2. die Inkubationszeit,
3. die akute Phase, die eventuell mit dem Tod endet,
4. die Abklingphase und
5. die Genesungsphase.
All diese Phasen können sehr unterschiedlich ausgeprägt sein je nach dem Pathogen, das die Infektion verursacht.
Wichtiger Start: die Infektionsquelle
Mindestens so variabel wie der Erreger ist sein Reservoir, also die Infektionsquelle. Idealerweise verfügen Pathogene über ein Reservoir, wo sie möglichst unauffällig lebensfähig bleiben können. Nur in Ausnahmefällen, nämlich bei den Saprophyten, handelt es sich dabei nicht um lebende Organismen. Allerdings sind gerade unter Saprophyten nur selten humanpathogene Spezies zu finden.
Ist der Mensch das einzige Reservoir für das Pathogen, ist eine Mensch-zu-Mensch-Übertragung obligat. Derartige Pathogene lassen sich tatsächlich ausrotten, wenn konsequent, z. B. durch einen guten Impfstatus einer Population, gegen die Ausbreitung des Pathogens vorgegangen wird. Beispiele hierfür sind die bereits weltweit ausgerotteten Pocken und die auf dem amerikanischen Kontinent ausgerotteten Masern. (Die Masern wurden allerdings wieder in die USA eingeschleppt, wo es im Januar 2015 schon über 80 Krankheitsfälle gab.) Vielfach bilden aber auch bestimmte Tierspezies ein Erreger-Reservoir, wie z. B. bei Influenzaviren, die neben Menschen auch Vögel, Schweine und andere Tiere infizieren können. Bei einigen Pathogenen ist der Mensch ein versehentlicher Zwischenwirt, der zwar erkrankt, aber den Krankheitserreger nicht mehr abgeben kann. Dafür ist die Echinokokkose ein Beispiel, die durch den kleinen Hundebandwurm oder den kleinen Fuchsbandwurm hervorgerufen werden kann. Normalerweise entwickeln sich die Bandwurmlarven in Zysten in verschiedenen Organen des Zwischenwirts und gelangen in den eigentlichen Endwirt, wenn dieser den Zwischenwirt erlegt und roh verzehrt – was beim Menschen als Zwischenwirt eher nicht vorkommt.
Es geht weiter: Infektionsmodus
Noch vielfältiger als die Infektionsquelle gestaltet sich der Infektionsmodus, also wie es zur Übertragung des infektiösen Agens kommt. Möglichkeiten zur Ansteckung ergeben sich z. B. über Tröpfcheninfektion (Aerosol), Kontaktinfektion (z. B. direkt von Mensch zu Mensch oder indirekt über die Umwelt zum Menschen) oder auch in Form von Anthropozoonosen (Übertragung von Wirbeltier auf den Menschen). Influenzaviren beispielsweise können über alle drei Wege übertragen werden, was eine Ausbreitung natürlich beschleunigt.
Bei der Tröpfcheninfektion gelangen Krankheitserreger, die im Rachenraum oder im Atemtrakt siedeln, beim Niesen, Husten und Sprechen durch winzige Speicheltröpfchen in die Luft und können anschließend von einem anderen Menschen eingeatmet bzw. direkt über die Schleimhäute der oberen Atemwege aufgenommen werden. Tröpfchen mit einem Durchmesser über 5 µm sinken in der Luft rasch ab und werden somit nur bis zu einer Distanz von gut 1 m übertragen. Hier lässt sich eine Ansteckung am besten durch einen ausreichenden Abstand zum Infizierten vermeiden. Sehr kleine Tröpfchen (< 5 µm) können lange Zeit in der Luft schweben und dadurch Erreger auch über große Distanzen verbreiten. Während sich vermutlich Influenzaviren überwiegend über Tröpfchen > 5 µm ausbreiten, wird beispielsweise der Tuberkuloseerreger Mycobacterium tuberculosis von Infizierten mit einer offenen Lungentuberkulose vor allem über sehr kleine Aerosoltröpfchen < 5 µm weitergegeben. Bleiben solche Speicheltröpfchen an Gegenständen wie Türgriffen oder Armaturen hängen, können Pathogene über die Hände an die Schleimhäute gelangen und darüber infizieren. Weitere Gegenstände, über die Pathogene übertragen werden können, sind Bettzeug, Spielzeug, Bücher, chirurgische Instrumente usw. Derartige Objekte bezeichnet man als Fomite.
Einige Pathogene reagieren äußerst sensitiv auf Umweltfaktoren wie Trockenheit oder Hitze. Sie sind daher nicht in der Lage, ohne ihren Wirt einen längeren Zeitraum zu überleben. Zu diesen Pathogenen, die nur durch engen Kontakt von Mensch zu Mensch übertragen werden, gehören beispielsweise Treponema pallidum, der Erreger der Syphilis, oder Neisseria gonorrhoeae, der Überträger der Gonorrhö, und auch HIV. Ebolaviren sind nur nach direktem Kontakt mit Körperflüssigkeiten eines infizierten Menschen gefährlich, und Adenoviren sind nur durch direkte Berührung des Augensekrets übertragbar.
Einen anderen Infektionsweg nahm die EHEC-Epidemie im Jahr 2011. Hier waren kontaminierte Lebensmittel, wahrscheinlich Sprossen von Bockshornkleesamen, die Auslöser. Immer wieder führen auch Salmonellen, die sich munter in rohen Eiern, Rohwurstsorten oder nicht durchgegartem Fleisch vermehren können, über diesen Weg zu plötzlichen Durchfallerkrankungen, denn bei derartigen Darmbakterien sind Enterotoxine als Pathogenitätsfaktoren am Krankheitsgeschehen mitbeteiligt.
Wenn man die genaue Ursache für die Ausbreitung von „Lebensmittel“-Pathogenen sucht, findet sich oft genug mit Fäkalien verunreinigtes Wasser, das zum Bewässern z. B. von Bockshornklee genutzt wurde. Also ist auch (Trink-)Wasser ein möglicher Infektionsweg. Bei uns sorgen das Infektionsschutzgesetz und die Trinkwasserverordnung dafür, dass eine effiziente Wasseraufbereitung und strenge Kontrollen die Qualität des Wassers sichern. Mittlerweile müssen beispielsweise Warmwasserinstallationen regelmäßig auf über 60 °C erhitzt werden, um eine Infektion mit Legionellen über zerstäubtes, entsprechend kontaminiertes Wasser zu verhindern.
Etliche Pathogene nutzen Arthropoden (Insekten, Spinnentiere) als sogenannte Vektoren, um in den Menschen zu gelangen. In unseren Breiten werden die Borreliose und FSME gefürchtet, die durch Zeckenbisse übertragen werden. Und alle Reisenden, die gern in tropischen Ländern ihren Urlaub verbringen, wissen, dass sie sich mit entsprechenden Repellenzien vor Stichen durch Anopheles-Mücke, Tsetsefliege oder Tigermücke schützen sollen, um sich möglichst keine Malaria, Schlafkrankheit oder Gelbfieber einzufangen.
Neben diesen horizontalen Übertragungswegen besteht bei etlichen Infektionskrankheiten auch die Gefahr eines vertikalen Transfers von der Mutter über die Plazenta auf das ungeborene Kind. Besonders gefürchtet sind hier eine Röteln- oder eine HIV-Infektion der Mutter, weshalb in diesen Fällen spezielle Präventionsprogramme befolgt werden.
Infektionsanfälligkeit
Glücklicherweise bedeutet ein direkter Kontakt mit einem Pathogen nicht zwangsläufig, dass man sich auch tatsächlich infiziert. Eine Einflussgröße ist die sogenannte Disposition, also die Empfänglichkeit eines Organismus, eine Infektionserkrankung zu akquirieren. Sie hängt u. a. ab vom Lebensalter, vom Ernährungszustand und von psychischer sowie körperlicher Beanspruchung. Sicherlich hat sich schon der ein oder andere Sportler darüber gewundert, dass ihn trotz der allgemeinen körperlichen Fitness nach einem Marathonlauf oder einem Triathlon eine starke Erkältung erwischt hat. Grund dafür ist das Cortisol, das bei einer Glucose-Unterversorgung während einer längeren sportlichen Anstrengung ausgeschüttet wird und vorübergehend das Immunsystem supprimiert – daher die Infektanfälligkeit.
Häufigkeit und Ausbreitung einer Infektion
Auf der anderen Seite des Infektionsgeschehens liegen ebenfalls Einflussfaktoren. Hier spielen die Kontagiosität und Infektiosität eine wichtige Rolle. Die Kontagiosität beschreibt die Übertragungsfähigkeit des Pathogens von infizierten auf nicht infizierte Personen; die statistische Übertragungsrate ist der Kontagiositätsindex (Tab. 1). Der „durchschlagende Erfolg“ von Masernpartys beruht darauf, dass sich fast 100 Prozent der exponierten und nicht-immunen Personen mit dem Masernvirus anstecken.
| Krankheit | KI | Krankheit | KI |
|---|---|---|---|
| Masern | 0,98 | Scharlach | 0,1 – 0,3 |
| Pocken | 0,95 | Röteln | 0,15 – 0,2 |
| Keuchhusten | 0,9 | Diphtherie | 0,1 – 0,2 |
| Mumps | 0,8 | Bakterienruhr | 0,15 |
| Typhus abdominalis | 0,5 | Poliomyelitis | 0,1 |
Die Infektiosität beschreibt die Fähigkeit eines Krankheitserregers, nach erfolgter Übertragung einen Wirt auch tatsächlich zu infizieren, und ist abhängig von den Pathogenitätsfaktoren des Erregers sowie von den Abwehrmechanismen des Wirts. Interessant ist in diesem Zusammenhang die minimale Infektionsdosis, also die Mindestanzahl an Pathogenen, die für eine Infektion nötig ist. Beispielsweise reichen wahrscheinlich zehn bis 100 Noroviren, um das Krankheitsbild mit Durchfall und Erbrechen hervorzurufen.
Pathogenität und Virulenz
Die Fähigkeit eines Organismus, einen anderen Organismus krank zu machen, bezeichnet man als Pathogenität. Sie ist spezies- und zum Teil auch stammspezifisch. Beispielsweise ist der Tetanuserreger Clostridium tetani immer pathogen, während beim Darmbakterium Escherichia coli nur bestimmte Stämme pathogen sind. Wie stark sich das Krankheitsleiden ausprägt, ist wiederum von der Virulenz des Pathogens abhängig. Diese wird von genetisch festgelegten Virulenzfaktoren, wie bestimmten Toxinen, charakterisiert, die sich bei Pathogenen von Stamm zu Stamm oder von Serotyp zu Serotyp unterscheiden. Der Auslöser der EHEC-Epidemie 2011, der E. coli-Stamm O104:H4, war besonders virulent. Für den Einsatz als Lebendimpfstoffe, beispielsweise gegen Masern und Windpocken, wird die Virulenz der Pathogene abgeschwächt, sodass die Vakzine zwar noch infektiös ist, aber eben keine Krankheitssymptome mehr auslösen kann.
Für die Ausbreitung einer Erkrankung ist zudem die Basisreproduktionszahl R0 relevant. Sie bezeichnet die mittlere Zahl von Sekundärfällen, die ein Indexfall während seiner gesamten infektiösen Periode in einer Population verursacht. Bei R0 > 1 kommt es zur Ausbreitung der Infektion und zur Epidemie (Abb. 1; Tab. 2). Fällt die Basisreproduktionszahl auf R0 < 1, kommt die Epidemie zum Erliegen. Um dieses Ziel bei der Ebola-Epidemie zu erreichen, hatte die WHO im Oktober 2014 die „70-70-60-Formel“ erlassen:
| Krankheit | R0 | Krankheit | R0 |
|---|---|---|---|
| Masern | 12 – 18 | Röteln | 5 – 7 |
| Pertussis | 12 – 17 | Mumps | 4 – 7 |
| Diphtherie | 6 – 7 | HIV / Aids | 2 – 5 |
| Pocken | 5 – 7 | Influenza | 2 – 3 |
| Poliomyelitis | 5 – 7 |
- 70 Prozent der Ebola-Patienten so behandeln, dass sie niemanden anstecken,
- 70 Prozent der an Ebola Verstorbenen so bestatten, dass sich niemand am Leichnam infiziert,
- und das alles innerhalb von 60 Tagen.
Wie gut sich eine Infektion ausbreiten kann, hängt auch davon ab, wie lange ein Infizierter die Krankheitserreger weiterverbreiten kann, bevor er selbst an der Krankheit stirbt. Die Mortalität (Sterblichkeit) einer Infektionskrankheit beschreibt die relative Anzahl der Todesfälle (in der Regel pro 100.000 Personen) durch die Infektionskrankheit in einer Population. Davon zu unterscheiden ist die Letalität (Tödlichkeit). Zwischen Mortalität und Letalität besteht folgender Zusammenhang: Mortalität = Letalität × Inzidenz. Die Letalität zeigt somit an, wie hoch der Anteil der Verstorbenen an sämtlichen Erkrankten ist.
Die Morbidität beschreibt die Häufigkeit (in der Regel pro 100.000 Personen) einer Infektionskrankheit in einer Population. Sie schließt tödliche und nichttödliche Verläufe ein. Sie kann gering sein bei teils extrem hoher Letalität, wie normalerweise im Fall einer Ebola-Infektion (eine Ausnahme erleben wir gerade eben in den Epidemie-Gebieten, wo wir zu der hohen Letalität sehr untypisch auch eine hohe Morbidität beobachten). Oder sie kann hoch sein bei teils äußerst geringer Letalität. Hierzu gehören in den entwickelten Ländern akute Infektionen des Verdauungstraktes.
Was schädigt den Körper?
Einige Krankheitserreger exprimieren Virulenzfaktoren, die direkt das Gewebe schädigen. So bildet Clostridium tetani die Toxine Tetanospasmin und Tetanolysin, die die muskelsteuernden Nervenzellen bzw. das Herz schädigen. Bei Viren führt häufig allein die Infektion zur Schädigung der Wirtszelle und erst die Freisetzung der neuen Viren zu ihrer Lyse.
Häufig sind die gegen den Erreger gerichteten Immunreaktionen entscheidend an den Krankheitssymptomen beteiligt, z. B. im Frühstadium der Tuberkulose. M. tuberculosis wird nach der Infektion von Makrophagen aufgenommen, wird aber nicht in den Phagosomen vernichtet, sondern kann so recht unbeschadet in der Wirtszelle überdauern. Um den initialen Infektionsherd errichtet das Immunsystem mehrere Schichten verschiedener Abwehrzellen, und es kommt zur Nekrose, während das Bakterium am Leben bleibt.
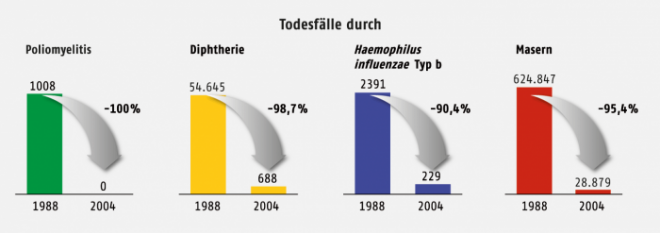
Abb. 2: Erfolge der Schutzimpfung. Abnahme der Fallzahlen einiger Infektionserkrankungen in Europa zwischen 1988 und 2004.
Das Zusammenleben von Wirt und Pathogen
In der belebten Natur trachtet jeder Organismus danach, seine Art (genauer: sein Genom) zu erhalten und zu vermehren. Erst bei uns Menschen will sich auch das Individuum selbst erhalten. Für Pathogene gilt, eine besondere Vorsicht walten zu lassen: Wird der Wirt durch die Infektion zu schnell getötet, werden eventuell keine oder zu wenige Pathogene weitergegeben, und es kommt irgendwann zur Ausrottung von Wirt und Pathogen. Aus Sicht des Pathogens ist es also besser, dem Wirt nicht zu sehr zu schaden, um eine möglichst lange Verbreitung sicherzustellen. Zudem ermöglicht eine gute Anpassung an den Wirt, dass das Immunsystem eventuell keine endgültige Beseitigung des Krankheitserregers erzielt, wodurch er sich besser im Wirt entwickeln kann. Herpes-simplex-Viren erreichen durch ihre gute Anpassung an ihren Wirt Infektionsquoten (Durchseuchungsraten) von über 90 Prozent der deutschen Bevölkerung, ohne ausgeprägte Symptome zu induzieren. Ist die Gelegenheit günstig, können sie wieder Lippenbläschen hervorrufen und „hoffentlich“ neue Wirte finden. Das simiane Immundefizienz-Virus (SIV) erzeugt in seinen natürlichen Wirten kein Aids, im Gegensatz zu HIV beim Menschen. Dennoch ist die Krankheitsentstehung auch beim Menschen ausreichend verzögert, sodass ein HIV-Infizierter im Extremfall durchaus mehrere andere Personen anstecken kann, bevor er überhaupt von seiner eigenen Infektion weiß.
Ganz anders war bisher die Situation bei einer Infektion mit dem Ebolavirus. Die natürlichen Wirte des Virus sind Fledermäuse, die das Virus nicht oder kaum schwächt. Dagegen wird ein Mensch durch die Infektion extrem geschwächt und verstirbt sehr schnell, sodass er das Virus kaum weiterverbreiten kann. Ebola-Epidemien dauerten daher immer nur kurz. Diese „Regel“ scheint jedoch bei der jüngsten Ebola-Epidemie in Westafrika nicht mehr zuzutreffen.
Ein schwerer Infektionsverlauf mit hoher Sterblichkeit ist zumeist ein Anzeichen dafür, dass der verursachende Erreger noch nicht an den betreffenden Organismus als seinen Reservoir-Wirt angepasst ist. Mit der Zeit beobachtet man dann aber einen Übergang des Pathogens mit einer hohen Replikationsrate und ausgeprägter Pathogenität zu einer dauerhaften Infektionsquote mit ausbleibenden Schäden. Somit neigen angepasste Pathogene zur Persistenz und einer regulierten Reproduktionsrate, wohingegen weniger angepasste Pathogene tendenziell zur vorzeitigen Beendigung der Infektionskette führen.
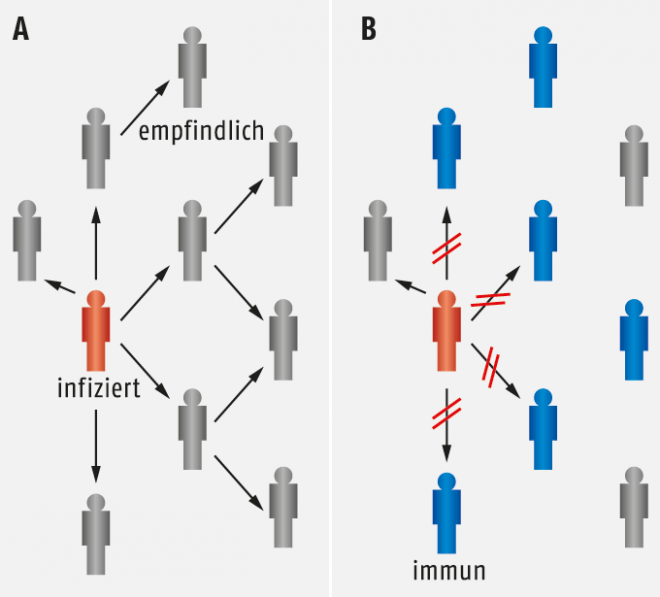
A. In einer Population ohne Immunschutz kann das Pathogen hemmungslos weiterverbreitet werden und alle Individuen infizieren. B. In einer Population mit hohem Immunschutz (hier: 60%) unterbrechen resistente Individuen (blau) den Übertragungszyklus des Pathogens und schützen dadurch auch empfindliche Individuen (Herdenimmunität).
Bakterien verwenden zur Herabsetzung ihrer Pathogenität u. a. das Quorum sensing. Darunter versteht man die Fähigkeit von Einzellern, über chemische Kommunikation die Zelldichte der Population zu messen. So wird sichergestellt, dass eine bestimmte Zelldichte keinesfalls überschritten wird. Beispiele für eine kaum angepasste Pathogenität sind H5N1-Viren in Vögeln sowie Yersinia pestis und Pockenviren im Menschen. Sie alle verursachen bei Epidemien extrem hohe Opferzahlen.
Meist erfolgt die Anpassung vonseiten des Wirts. Dessen Anpassung an das Pathogen wird als Wirtsrestriktion oder ‑resistenz bezeichnet. Zu den bekannten antiviralen und antibakteriellen Mechanismen gehören beim Menschen z. B. der Myxovirus-Resistenzfaktor Mx1, die PAMP-Rezeptoren, der dsRNA-aktivierte Inhibitor der Translation (DAI), die RNA-Interferenz und noch etliche andere. Darüber hinaus lässt sich das Immunsystem durch eine Impfung mit einem (relativ) unschädlichen Agens trainieren, sodass es bei einer tatsächlichen Infektion mit dem Pathogen eine schnelle und effiziente Immunantwort gibt und eine Erkrankung verhindert.
Dank der Einführung von Impfungen sind die Fallzahlen der impfpräventablen Erkrankungen auf der ganzen Welt dramatisch gesunken (Abb. 2). Dabei greifen zwei Effekte:
- Zum einen ist der Geimpfte selbst vor dem Ausbrechen der Infektion geschützt,
- zum anderen kommt bei einer ausreichend hohen Durchimpfungsrate in einer bestimmten Population auch die sogenannte Herdenimmunität zum Tragen (Abb. 3). Dadurch, dass jeder Infizierte in seiner Umgebung zu einem hohen Prozentsatz auf Geimpfte trifft, sinken die Kontagiosität der Erkrankung und auch die Basisreproduktionszahl. Die Infektion kann sich also weniger gut ausbreiten, wodurch letztlich auch Ungeimpfte „in der Herde“ geschützt werden.
Etliche Impfungen gegen verschiedene Erkrankungen sind in Deutschland verfügbar (Tab. 3).
| Bakterien | Viren | |
|---|---|---|
|
|
|
Nach wie vor gestalten sich allerdings einige Krankheiten, für die mit großem Aufwand nach guten Impfstoffen gesucht wird, als schwierige Kandidaten. Dazu gehören immer noch Malaria, HIV, Hepatitis C und auch Ebola. Zudem sind Pathogene zum Teil so wandlungsfähig, dass sie dem Immunschutz entkommen, wie die Grippefälle in dieser Saison zeigen. Und es kommen auch immer wieder neue Pathogene auf, wie kürzlich bei MERS-CoV zu beobachten war. |



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.