
- DAZ.online
- DAZ / AZ
- DAZ 27/2017
- Therapeutische Strategien
Pharmakotherapie
Therapeutische Strategien
Eine kausale Therapie der Endometriose existiert nicht, da die genaue Pathophysiologie der Erkrankung bis heute nicht abschließend geklärt ist. Entsprechend stehen auch keine Präventivmaßnahmen zur Verfügung. Die Therapie erfolgt symptomorientiert und umfasst operative, medikamentöse und komplementäre Behandlungsansätze, die separat oder in Kombination eingesetzt werden.
Das therapeutische Vorgehen orientiert sich an Lokalisation und Ausprägung der Endometriose-Herde sowie der hiermit einhergehenden Symptomatik. Die Nebenwirkungen einer medikamentösen Behandlung und die Risiken einer operativen Intervention müssen bei der Therapieplanung ebenfalls berücksichtigt werden. Die Therapie sollte den individuellen Bedürfnissen der Patientin angepasst werden und die aktuelle Lebenssituation berücksichtigen. Genauer gesagt sollte vorab festgelegt werden, ob die Behandlung primär mit dem Ziel der Schmerzbeseitigung oder aufgrund eines bisher unerfüllten Kinderwunsches erfolgt.
Ziele der Behandlung sind:
- Schmerzreduktion,
- Rückgang der Endometriose-Herde,
- Rezidivprophylaxe sowie
- Vermeidung von sekundären Beschwerden (Folgen eines infiltrativen und destruierenden Wachstums).
Bei Patientinnen mit asymptomatischer Endometriose ohne Kinderwunsch sind chirurgische oder medikamentöse Maßnahmen nicht zwingend erforderlich. Eine Ausnahme stellt jedoch z. B. die endometriosebedingte Harnleiterstenose mit Hydronephrose als eine absolute Indikation dar.
Leitlinien
Die interdisziplinäre Leitlinie für die Diagnostik und Therapie der Endometriose wurde in Zusammenarbeit der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) mit weiteren Fachgesellschaften aus den Gebieten Gynäkologie, Urologie und Psychosomatik sowie vier Patientinnenvereinigungen erstellt. In der aktuellen Version wurde erstmals ein S2k-Evidenzniveau erreicht. Die Leitlinie beinhaltet neben Empfehlungen zur hormonellen und operativen Therapie auch Hinweise zu psychosomatischen Therapien sowie Informationen zu alternativen Therapieverfahren. Weiterer Schwerpunkt ist die Behandlung von Frauen mit Endometriose und unerfülltem Kinderwunsch. Neben den Empfehlungen für die behandelnden Ärzte sind auch patientinnengerecht aufgearbeitete Kommentare enthalten, die das Verständnis für die Erkrankung und das Wissen hierüber weiter erhöhen sollen. Geben Sie den Webcode I2PA7 in die Suchfunktion bei DAZ.online ein und Sie gelangen direkt zur Leitlinie. Die deutsche S2k-Leitlinie nimmt eine eigenständige Einteilung nach betroffenen Regionen vor und beschreibt in Analogie hierzu entsprechende diagnostische, operative und medikamentöse Maßnahmen. Eine Übersicht der Empfehlungen zeigt Tabelle 2.
Laparoskopie – Goldstandard zur Schmerzreduktion
Die Laparoskopie gilt nicht nur als Goldstandard in der Diagnosestellung, sondern ist laut S2k-Leitlinie in Form der laparoskopischen Chirurgie auch Therapie der Wahl zur Symptomkontrolle. Wird die Diagnose durch die Laparoskopie gestellt und handelt es sich um eine schwere Form der Erkrankung, kann die diagnostische Laparoskopie durch einen operativen Eingriff zur therapeutischen Intervention erweitert werden.
Die laparoskopische Beseitigung peritonealer Herde kann nachweislich die Schmerzen reduzieren [19]. Auch für die Resektion in sano, also die Entfernung im gesunden Gewebe bei der tief infiltrierenden Endometriose, konnte ein positiver Effekt auf die Schmerzen, die Lebensqualität insgesamt und die Fertilität demonstriert werden [20]. Entsprechende Verfahren (z. B. Koagulation, Vaporisation, Exzision etc.), die bei den verschiedenen Endometriose-Formen eingesetzt werden, sind auch in Tabelle 2 aufgeführt. Dem therapeutischen Erfolg einer Resektion stehen allerdings die operationsbedingte Morbidität und die Rezidivrate der Endometriose gegenüber.
So muss mit zum Teil schweren intra- und postoperativen Komplikationen wie z. B. Anastomoseninsuffizienzen, rektaler Dysfunktion und Blasenatonie (gegebenenfalls mit permanentem Selbstkatheterismus) gerechnet werden.
Der Erfolg der Laparoskopie bei Frauen mit Kinderwunsch wird kontrovers diskutiert. Die Leitlinie der DGGG empfiehlt die Operation, um die Wahrscheinlichkeit einer spontanen Schwangerschaft zu erhöhen (siehe „Der besondere Fall – Unerfüllter Kinderwunsch“ auf S. 56). Sie schränkt jedoch ein, dass in Rezidivfällen die künstliche Befruchtung einer weiteren Operation bezüglich der Schwangerschaftsrate überlegen ist [3].
Hohe Rezidivrate
In Fällen von extensiver bzw. tief infiltrierender Endometriose kann nicht immer eine vollständige Resektion erreicht werden. Selbst bei erfolgreicher operativer (und/oder medikamentöser) Therapie erleiden in Abhängigkeit vom Alter sowie vom Stadium der Endometriose 37 bis 75% der Frauen nach fünf Jahren ein Rezidiv [3, 21]. Eine postoperative medikamentöse Behandlung kann Einfluss auf die Länge der Rezidivfreiheit nehmen.
Pharmakotherapeutische Therapieprinzipien
Die medikamentöse Therapie der Endometriose umfasst die endokrine Behandlung und die klassische Schmerztherapie (siehe Kasten „Medikamentöse Therapie der Endometriose“).
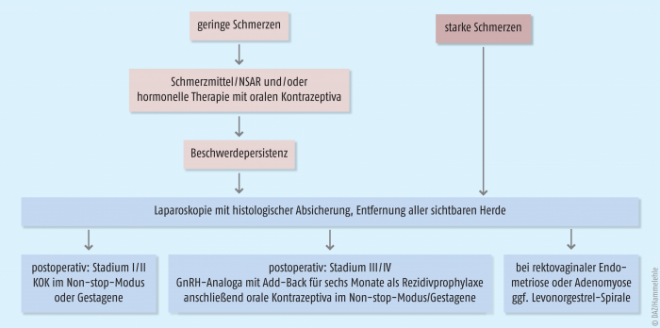
Die Endometriose ist eine Estrogen-abhängige Erkrankung. Das Gewebe unterliegt genau wie die Gebärmutterschleimhaut hormonellen Einflüssen. Therapeutisch empfiehlt sich daher ein „Estrogen-Entzug“ (Herbeiführung einer Amenorrhö) zur „Austrocknung“ der Endometriose-Läsionen. Im Rahmen der endokrinen Therapie werden Gestagene, orale Kontrazeptiva (kontinuierlich) und GnRH-Analoga eingesetzt. Diese reduzieren gleichermaßen die Endometriose-assoziierten Beschwerden [22, 23, 24]. Die endokrine Therapie wird unterstützend prä- oder postoperativ sowie alternativ zur Operation eingesetzt. Eine empirische Therapie mittels kombinierter oraler Kontrazeptiva (KOK) ist über einen gewissen Zeitraum bei mäßigen Schmerzen gerechtfertigt (Abb. 2). Der Nutzen einer präoperativen medikamentösen Therapie wird kontrovers diskutiert. Die präoperative GnRH-Analogon-Gabe kann z. B. zur Verkleinerung des Endometrioms führen. Fraglich ist, ob dadurch operationstechnische Vorteile erzielt oder die Rezidivraten verringert werden. Die Empfehlungen sind je nach Organbefall unterschiedlich (Tab. 2).
Medikamentöse Therapie der Endometriose
- Gestagene (progesteron only pill, POP)
- kombinierte orale Kontrazeptiva (KOK), monophasisch
- GnRH-Analoga mit „add-back“
- Analgetika
- Kombinationen hieraus
- Therapien im Rahmen von experimentellen Studien
Postoperative Rezidivprophylaxe
Bei milder peritonealer Endometriose (rASRM-Stadium I/II) wird postoperativ dauerhaft („non-stop“) mit Gestagenen (als kombiniertes orales Kontrazeptivum oder als „progesteron only pill“) oder lokal als Gestagen-haltige Spirale behandelt (siehe Abb. 2). Bei fortgeschrittener peritonealer Endometriose (rASRM-Stadium III/IV) ist die sechsmonatige Gabe der GnRH-Analoga am effektivsten. Anschließend kommen – sofern kein Kinderwunsch besteht – kombinierte orale Kontrazeptiva oder Gestagene als Non-stop-Medikation zum Einsatz.
→ Bei Patientin L. G. wird eine laparoskopische Entfernung der peritonealen Endometriose-Läsionen mittels Koagulation vorgenommen. Postoperativ kommen in den anfänglichen Stadien der Erkrankung Gestagene oder kombinierte orale Kontrazeptiva dauerhaft („non-stop“) zum Einsatz.
Alternativ zur Operation wird auch rein medikamentös behandelt. Mögliche Gründe hierfür sind z. B.
- asymptomatische Herde ohne Progression,
- Operation nicht gewünscht,
- Aufklärung und Durchführung einer regelmäßigen klinischen Kontrolle.
Klinische Pharmakotherapie
GnRH-Analoga
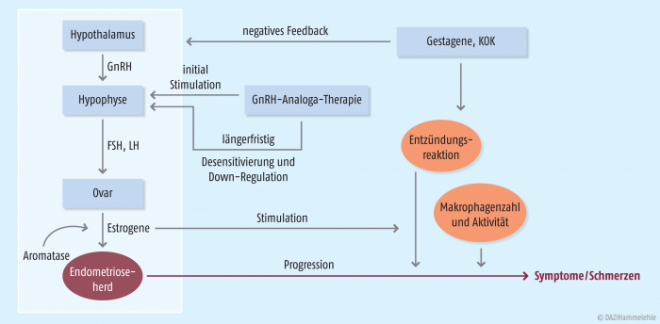
GnRH-Analoga sind synthetische Analoga des Gonadotropin-Releasing-Hormons (GnRH). Das Hormon wird im Hypothalamus gebildet und stimuliert im Hypophysenvorderlappen die Ausschüttung von follikelstimulierendem Hormon (FSH) und luteinisierendem Hormon (LH). Diese sogenannten Gonadotropine regen wiederum die Synthese von Estrogen und Testosteron in den Keimdrüsen (Ovar bzw. Hoden) an (siehe Abb. 3). Initial kommt es unter der Gabe von GnRH-Analoga zu einem Anstieg der Gonadotropin-Freisetzung. Die kontinuierliche Applikation führt jedoch zu einer Down-Regulation der GnRH-Rezeptoren in der Hypophyse, wodurch diese die Freisetzung von FSH und LH einstellt. Letztlich sinkt damit die Estrogen-Konzentration auf Werte, wie sie auch bei postmenopausalen Frauen auftreten. Diese therapeutisch induzierte Amenorrhö führt zur „Austrocknung“ der Endometriose-Läsionen und schließlich zur Symptomreduktion.
Darüber hinaus sind GnRH-Analoga indiziert zur Behandlung des fortgeschrittenen hormonabhängigen Prostatakarzinoms sowie des Mammakarzinoms prä- und perimenopausaler Frauen, sofern eine endokrine Behandlung angezeigt ist. Des Weiteren wird die Substanzklasse zur Ovulationsinduktion im Rahmen der In-vitro-Fertilisation, zur Therapie des symptomatischen Uterus myomatosus (gutartige Uterusmyome) sowie zur Behandlung der Pubertas praecox vera bei Mädchen unter neun Jahren und Jungen unter zehn Jahren eingesetzt.
Die Senkung der Estradiol-Konzentration führt zu den typischen Nebenwirkungen dieser Substanzklasse wie Knochenschmerzen, Hitzewallungen, Scheidentrockenheit etc. (siehe Tab. 4). Die Behandlung mit GnRH-Agonisten verringert während einer sechsmonatigen Behandlungsphase die Knochenmineraldichte wahrscheinlich um durchschnittlich 1% pro Monat [28]. Bei den meisten Frauen normalisiert sich die Knochenmineraldichte innerhalb von sechs bis neun Monaten nach Behandlungsende. Es liegen jedoch keine speziellen Daten für Osteoporose-Patientinnen oder Patientinnen mit Osteoporose-Riskofaktoren (z. B. chronischer Alkoholmissbrauch, Rauchen, Langzeitbehandlung mit Corticoiden, Osteoporose in der Familie, Fehlernährung etc.) vor. Eine Therapie sollte bei diesen Patientinnen sorgfältig abgewogen werden. Zudem ist die Behandlung mit GnRH-Agonisten mit einem erhöhten Risiko von zum Teil schwerwiegenden Depressionen assoziiert. Patientinnen sollten hierüber informiert und bei Auftreten von Symptomen entsprechend behandelt werden.
Die Behandlungsdauer ist abhängig vom anfänglichen Schweregrad der Endometriose. Die meisten Frauen reagieren spätestens drei Monate nach Therapiebeginn mit einer Amenorrhö. In der Regel wird eine Therapie mit GnRH-Analoga über insgesamt sechs Monate fortgeführt. Eine dreimonatige Therapie der peritonealen Endometriose ist zwar genauso effektiv, jedoch ist das rezidivfreie Intervall dann kürzer [29]. Eine Therapiedauer von neun Monaten sollte aufgrund der genannten Nebenwirkungen nicht überschritten werden. Wiederholungsbehandlungen sollten nur nach sorgfältiger Nutzen-Risiko-Abwägung erfolgen, da additive Effekte bei der Abnahme der Knochenmasse nicht auszuschließen sind [28].
Aufgrund der Chronizität der Erkrankung bedarf es in einigen Fällen auch einer Verlängerung der GnRH-Therapie über den Zeitraum von sechs Monaten hinaus. Für diese Fälle eignet sich eine sogenannte Add-back-Therapie nach dem Format einer Hormonersatztherapie. Hierbei werden geringe Mengen Estrogen appliziert, um den vasomotorischen Nebenwirkungen und dem Verlust von Knochensubstanz entgegenzuwirken. Die Dosierung ist so auszurichten, dass der Behandlungserfolg nicht beeinträchtigt wird. Liegt die Estrogen-Konzentration oberhalb des therapeutischen Fensters, wird das Endometriose-Wachstum erneut gefördert.
Die GnRH-Analoga werden als Nasenspray oder Depot-Injektion (Implantat oder Depot-Injektionssuspension) appliziert. Depot-Darreichungsformen haben sich in der Praxis bewährt. Sie wirken zuverlässig und sind für die Patientin unkompliziert. Allerdings sind lokale allergische Reaktionen an der Einstichstelle sowie mögliche anaphylaktische Reaktionen zu bedenken. Damit die Wirkstoffe ausreichend über die Nasenschleimhaut aufgenommen werden können, ist eine sachgemäße Anwendung sowie eine entsprechend gute Compliance der Patientin Voraussetzung, da ein GnRH-haltiges Nasenspray bis zu dreimal täglich angewendet werden muss. Entsprechende Dosierungen sind in Tabelle 3 angegeben.
Wirkstoff (Auswahl) |
Dosierung |
|---|---|
GnRH-Analoga | |
Leuprorelinacetat |
3,75 mg/vier Wochen s. c. oderDreimonats-Depot s. c. |
Goserelinacetat |
3,8 mg/vier Wochen s. c. |
Buserelinacetat |
3 bis 4 × 300 µg/Tag |
Nafarelinacetat |
2 bis 4 × 460 µg/Tag |
Triptorelinacetat |
150 µg/Tag |
parenterale Gestagen-Präparate | |
Medroxyprogesteronacetat |
150 bzw 104 mg i.m. alle zwölf Wochen |
Etonogestrel |
68 mg s. c. Implantat bis zu drei Jahren |
Norelgestromin |
ein Pflaster für eine Woche |
Gestagen-haltiges Intrauterinpessar | |
Levonorgestrel |
20 µg/24 Stunden |
Nortestosteron-Derivate | |
Desogestrel |
0,075 bis 0,15 mg (1 bis 2 Tbl/Tag) |
Dienogest |
2 mg/Tag |
kombinierte orale Kontrazeptiva (+ Ethinylestradiol [EE]) | |
Levonorgestrel |
100 µg/150 µg/250 µg + 20/30 µg EE |
Norethisteron |
0,5 mg + 20 µg EE |
Dienogest |
2 mg + 30 µg EE |
Norgestimat |
250 µg + 35 µg EE |
Gestoden |
0,750 µg + 30 µg EE |
Desogestrel |
150 µg + 20/30 µg EE |
Chlormadinonacetat |
2 mg + 30 µg EE |
Orale Kontrazeptiva
Gestagene. Ursprünglich galten die GnRH-Analoga als Goldstandard in der medikamentösen Endometriose-Therapie. Hauptsächlich werden sie immer noch bei extremen Befunden oder einer Behandlung im Rahmen einer In-vitro-Fertilisation eingesetzt. Aufgrund der geringen Kosten und eines günstigeren Nebenwirkungsprofils gegenüber den GnRH-Analoga rücken die Gestagene als alternative Behandlungsoption immer mehr in den Vordergrund, zumal sie dauerhaft eingenommen werden können.
Die Zahl der Gestagene, die therapeutisch genutzt werden, ist groß. Jedes Gestagen hat in Abhängigkeit vom Rezeptorprofil unverwechselbare Eigenschaften, die es für bestimmte Einsatzgebiete prädestinieren. Relevant für die Therapie der Endometriose ist die Reduktion der Estrogen-Spiegel. Gestagene supprimieren durch Wirkung (negatives Feedback) auf die Hypothalamus-Hypophysen-Ovar-Achse die Gonadotropin- und somit auch die Estrogen-Freisetzung (siehe Abb. 3). Hierdurch werden die trophischen Effekte von Estradiol am Endometrium unterdrückt. Grundsätzlich ist die Wahl des Präparates von der Verträglichkeit, dem Nebenwirkungsprofil und den Bedürfnissen der Patientin abhängig.
Allerdings ist derzeit ausschließlich Dienogest 2 mg (Visanne®) zur Behandlung der Endometriose zugelassen. Dienogest ist ein Nortestosteron-Derivat ohne androgene, mineralocorticoide oder glucocorticoide Eigenschaften aber mit antiandrogener Aktivität. Es wird schon lange zur hormonellen Kontrazeption und in der Hormonersatztherapie eingesetzt. Im Jahr 2010 wurde Dienogest 2 mg dann auch zur Behandlung der Endometriose zugelassen.
In einer vergleichenden Analyse des Gestagens Dienogest mit dem GnRH-Analogon Leuprorelinacetat bei 252 Frauen mit Endometriose aus dem Jahr 2012 zeigte sich Dienogest hinsichtlich der Schmerzreduktion (gemessen an der VAS-Skala) als therapieäquivalent [30].
Bei kontinuierlicher Gabe führt Dienogest zu einem hypoestrogenen, hypergestagenen endokrinen Zustand, der eine initiale Dezidualisierung endometrialen Gewebes, gefolgt von einer Atrophie endometriotischer Läsionen, hervorruft [31]. Zugleich werden (Durchbruch-)Blutungen reduziert, und das Risiko einer Verschleppung von Endometriumzellen wird gesenkt. Außerdem zeigt Dienogest antiinflammatorische Eigenschaften.
Die häufigsten Nebenwirkungen, die unter der Behandlung mit Dienogest berichtet wurden, sind Kopfschmerzen, Brustbeschwerden, depressive Stimmung und Akne. Weitere unerwünschte Arzneimittelwirkungen sind in Tabelle 4 aufgeführt. Diese treten häufiger während der ersten Monate der Therapie auf und nehmen mit fortgesetzter Behandlung ab.
Gestagene, einschließlich Dienogest, werden hauptsächlich durch das Cytochrom-P450-3A4-System (CYP3A4) metabolisiert. Induktoren oder Inhibitoren von CYP3A4 können den Metabolismus der Gestagene beeinflussen. Eine Enzyminduktion durch Arzneistoffe wie Phenytoin, Barbiturate, Primidon, Carbamazepin, Rifampicin etc. kann die therapeutische Wirkung der Gestagene reduzieren. Enzyminhibitoren erhöhen wiederum die Wirkspiegel der Sexualhormone und führen damit gegebenenfalls zu Nebenwirkungen.
GnRH-Analoga |
Gestagene |
kombinierte orale Kontrazeptiva |
|
|---|---|---|---|
Beispiel |
Triptorelinacetat 3,75 mg
(Decapeptyl® Gyn) [28]
|
Dienogest 2 mg
(Visanne®) [31]
|
Ethinylestradiol 0,03 mg, Dienogest 2 mg (Valette®) [32]
|
Kontraindikation |
Schwangerschaft
Stillzeit
|
Schwangerschaft, Erkrankungen mit Gefäßbeteiligung (thromboembolische, kardiovaskuläre Erkrankungen, z. B. Myokardinfarkt), schwere Lebererkrankungen/Lebertumoren, sexualhormonabhängige maligne Tumoren, diagnostisch nicht abgeklärte vaginale Blutungen |
Vorliegen einer oder Risiko für eine venöse Thromboembolie, Vorliegen einer oder Risiko für eine arterielle Thromboembolie (ATE), Pankreatitis mit schwerer Hypertriglyceridämie, schwere Lebererkrankung, Lebertumorerkrankung, sexualhormonabhängige maligne Tumoren, diagnostisch nicht abgeklärte vaginale Blutungen |
unerwünschte Wirkungen |
sehr häufig: verringerte Libido, Stimmungsveränderungen, Schlafstörungen, Kopfschmerzen, Hitzewallungen, Bauchschmerzen, Hyperhidrose, Knochenschmerzen, Vaginalblutungen, Scheidentrockenheit, Schmerzen beim Geschlechtsverkehr, Beckenschmerzen, Dysmenorrhö, ovarielles Hyperstimulationssyndrom, Schwäche/Kraftlosigkeit |
häufig: Gewichtszunahme, depressive Stimmung, Schlafstörungen, Nervosität, Libidoverlust, Stimmungswandel, Kopfschmerzen, Migräne, Übelkeit, abdominelle Schmerzen und Probleme, geblähtes Abdomen/Flatulenz, Akne, Alopezie, Rückenschmerzen, Brustbeschwerden, Ovarialzysten, Hitzewallungen, uterine/vaginale Blutungen, Asthenie, Reizbarkeit |
häufig: Brustschmerzen, Kopfschmerzen, gelegentlich: vaginale Zwischenblutungen, Ovarialzysten, Akne, Alopezie, Ausschlag, Müdigkeit, Gewichtszunahme, Pilzinfektionen, erhöhter Appetit, depressive Verstimmungen, Schwindel, Migräne, Hyper-/Hypotonie, gastrointestinale Beschwerden, Brustveränderungen |
Wechselwirkungen |
nicht ausreichend untersucht |
Dienogest ist ein Substrat von Cytochrom P4503A4; Substanzklassen, die CYP3A4 inhibieren (z. B. Ketoconazol) oder induzieren (z. B. Phenytoin, Barbiturate, Primidon, Carbamazepin, Rifampicin), beeinflussen den Metabolismus der Gestagene
Einfluss auf bestimmte Laborparameter
|
|
Cave! |
|
Absetzen oraler Kontrazeptiva vor Therapiebeginn → alternative Verhütungsmethode erforderlich (zwar wird bei den meisten Patientinnen während der Behandlung die Ovulation gehemmt, doch handelt es sich bei Visanne® nicht um ein Verhütungsmittel) |
Kombinierte orale Kontrazeptiva. Wie die reinen Gestagene werden kombinierte orale Kontrazeptiva (KOK) in der Endometriose-Therapie mit dem Ziel der therapeutischen Amenorrhö eingesetzt. Die Anwendung erfolgt in jedem Fall off label, da keines der kombinierten oralen Kontrazeptiva für die Therapie der Endometriose zugelassen ist. Bei der Entscheidung, ein Kontrazeptivum anzuwenden, sollten auch die Gegenanzeigen und Risikofaktoren (Tab. 5) der Anwenderin beachtet werden, insbesondere die Risikofaktoren für eine venöse Thromboembolie (siehe „Erweitertes Medikationsmanagement und AMTS-Tipps“). Als Orientierungshilfe können die Empfehlungen zum Einsatz von kombinierten oralen Kontrazeptiva zur Empfängnisverhütung herangezogen werden. Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat zusammen mit den anderen europäischen Behörden und der Europäischen Arzneimittelagentur (EMA) das Verhältnis von Nutzen und Risiko dieser Arzneimittel für die Schwangerschaftsverhütung bewertet. 2014 wurde hierüber in einem Rote-Hand-Brief informiert. Entsprechende Meldungen sowie ergänzende Unterlagen zur sicheren Arzneimittelanwendung für Ärzte (siehe „Checkliste für Ärzte“) und Patientinnen stehen auf der Homepage des BfArM (www.bfarm.de) bereit.
Analgetika
Viele Frauen greifen – lange bevor die Diagnose gestellt wird – auf klassische Analgetika in der Selbstmedikation zurück. An dieser Stelle ist die kompetente Beratung des pharmazeutischen Personals gefragt. Im Rahmen der ärztlichen Betreuung werden weitere Analgetika wie Metamizol oder COX-2-Hemmer verordnet, bei starken Schmerzen auch Opioide. Neben der Analgesie wirken sich nicht-steroidale Antirheumatika (NSAR) aufgrund ihrer entzündungshemmenden Eigenschaften möglicherweise positiv in Bezug auf ein proinflammatorisches Milieu in Endometriose-Herden aus. Auch die Therapie mit COX-2-Hemmern ist von pathogenetischer Seite interessant, da Endometriose-Herde die Cyclooxygenase 2 (COX-2) im Vergleich zu normalem Endometrium überexprimieren und somit zusätzlich auch ein kausaler Behandlungsansatz denkbar ist [9]. Obwohl Antiphlogistika und NSAR im klinischen Alltag häufig verwendet werden, fehlt laut einem Cochrane-Review aus dem Jahr 2009 jedoch der eindeutige Beweis für einen positiven Effekt auf die spezifischen Endometriose-assoziierten Beschwerden [33].
Medikamentöse Schmerztherapie der Endometriose [34]
klassische Analgetika
- NSAR (z. B. Ibuprofen, Diclofenac, Naproxen)
- Metamizol
- selektive COX-2-Hemmer
Opioide, tricyclische Antidepressiva, Antiepileptika
- Tramadol
- Tilidin/Naloxon
- Morphinsulfat
- Fentanyl
- Amitriptylin
- Nortriptylin
- Gabapentin
Auch kleine Befunde können große Schmerzen auslösen. Das Ausmaß der Endometriose korreliert nicht mit der Schmerzintensität. Häufig wird das Schmerzgeschehen chronisch. Dies bedeutet, dass die Schmerzen nach Diagnosestellung und operativer Entfernung der Endometriose-Läsionen weiterhin bestehen bleiben.
Komplementäre Maßnahmen
Betroffene Frauen berichten zum Teil über eine Linderung der Beschwerden und eine Verbesserung der Lebensqualität durch den Einsatz komplementärer therapeutischer Maßnahmen [35, 36]. Hierzu zählen die Verfahren der Akupunktur und Chinesischen Medizin, der klassischen Homöopathie, der Phytotherapie, der Physiotherapie und andere. Die DGGG spricht aufgrund der unzureichenden Studienlage in ihrer Leitlinie jedoch keine Empfehlung zum Einsatz komplementärer Maßnahmen aus [3].
Rehabilitation
Insbesondere chronische Schmerzpatientinnen oder Frauen, die aufgrund einer tief infiltrierenden Endometriose ausgedehnten oder wiederholten operativen Eingriffen ausgesetzt sind, profitieren von Rehabilitationsmaßnahmen oder Anschlussheilbehandlungen in spezialisierten Einrichtungen.
Psychische Belastung
Der chronische Unterbauchschmerz als Leitsymptom der Endometriose geht mit einer deutlichen Einschränkung der Lebensqualität einher. In der Folge kann es zu dysfunktionalem Krankheitsverhalten (z. B. Vermeidung körperlicher Aktivität) kommen, das sich im Sinne eines circulus vitiosus gegebenenfalls schmerzverstärkend auswirkt. Ein unerfüllter Kinderwunsch bedeutet für die betroffenen Frauen eine hohe emotionale Belastung. Diese psychosomatischen Aspekte sollen in der Behandlung der Endometriose unbedingt frühzeitig bedacht und integriert werden.
Der besondere Fall – Unerfüllter Kinderwunsch
Fruchtbarkeitsstörungen und Endometriose sind häufig assoziiert. Etwa 30 bis 70% aller Frauen mit Endometriose leiden unter Infertilität. Umgekehrt liegt bei 25 bis 50% aller Frauen im fruchtbaren Alter, die trotz regelmäßigen Geschlechtsverkehrs innerhalb eines Jahres nicht schwanger werden, eine Endometriose vor.
Man geht davon aus, dass mechanische Faktoren wie Adhäsionen oder Tubenverschlüsse ebenso wie wiederholte operative Eingriffe an den Ovarien (Herabsetzung der Eizellreserve) zu einer Reduktion der Schwangerschaftsrate führen. Diskutiert werden auch immunologische Störungen und ein proinflammatorisches Milieu, welches die Eizellreifung oder die Tubenmotilität negativ beeinflusst. Ein kausaler Zusammenhang ist jedoch letztlich nicht zweifelsfrei belegt.
Bei der Therapie sollten die Anamnese, der Grad der Endometriose, die Beschwerden, das Alter der Patientin sowie die Dauer des Kinderwunsches berücksichtigt werden. Die alleinige medikamentöse Therapie führt nicht zu einer Verbesserung der Fruchtbarkeit und damit bei Patientinnen mit Kinderwunsch nicht zum Erfolg. Sie sollte aus reproduktionsmedizinischer Sicht nicht durchgeführt werden. Die S2k-Leitlinie empfiehlt zur Verbesserung der Fertilität die operative Entfernung von Endometriose-Läsionen. Da bei diesen Patientinnen der Organerhalt oberstes Gebot ist, muss die Radikalität hierbei häufig eingeschränkt werden. Bei Patientinnen mit ovarieller Endometriose ist außerdem zu beachten, dass es operationsbedingt zu einer Reduktion der ovariellen Reserve kommen kann. Für die Behandlung der betroffenen Frauen sind Erfahrungen und Fertigkeiten in der operativen Fertilitätstherapie sowie die Kooperation mit der Reproduktionsmedizin Voraussetzung.
→ Auch bei Patientin C. G. ist davon auszugehen, dass die ovarielle Endometriose ursächlich für den unerfüllten Kinderwunsch ist. Bei dem operativen Eingriff ist besonders vorsichtig zu verfahren, damit es nicht zu einer Reduktion der ovariellen Reserve kommt.
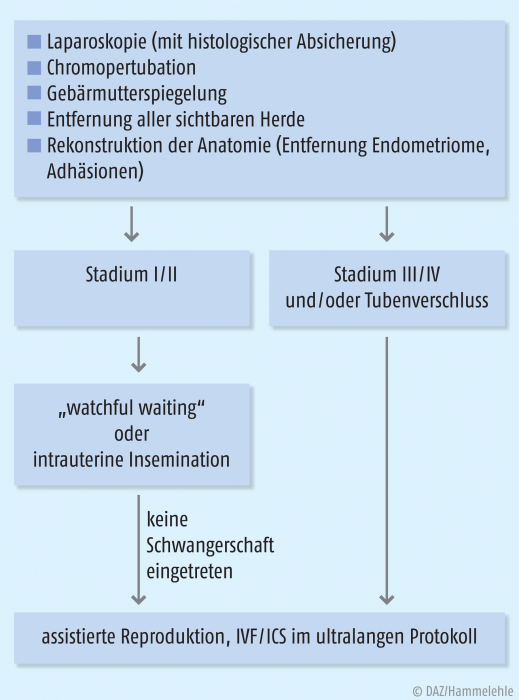
Im Anschluss an die operative Entfernung der Endometriose-Herde kommen unterschiedliche therapeutische Maßnahmen in Betracht (Abb. 4).
Die postoperative medikamentöse Gabe von GnRH-Analoga verbessert die spontane Schwangerschaftsrate bei Sterilitätspatientinnen nicht und wird daher auch nicht empfohlen.
In anfänglichen Stadien (I bis II nach rASRM) ist bei jüngeren Patientinnen z. B. eine Ovulationsinduktion (OI) mit intrauteriner Insemination (IUI) zu empfehlen. Auch ein „abwartendes Management“ kommt in Betracht.
Bei ausgeprägtem Befund (Stadium II bis III nach rASRM) und mit zunehmendem Alter sollten eine In-vitro-Fertilisation oder eine intra-zytoplasmatische Spermien-Injektion (IVF-/ICSI-Therapie) früh erwogen werden. Bei moderater und schwerer Endometriose können durch die Gabe von GnRH-Agonisten im Ultralong-Protokoll (z. B. über zehn Wochen) im Vorfeld der Stimulationstherapie höhere Schwangerschaftsraten erzielt werden [37, 38].
→ Bei Patientin C. G. ist aufgrund eines postoperativen Rezidivs innerhalb von zwei Jahren wiederholt keine Schwangerschaft eingetreten. In diesem Fall ist nun die In-vitro-Fertilisation einem wiederholten operativen Eingriff vorzuziehen. Die Gabe eines GnRH-Agonisten im Ultralong-Protokoll kann aufgrund des Befundes der moderaten Endometriose im Vorfeld der Stimulationstherapie erwogen werden.
Zu beachten ist jedoch, dass aufgrund der Estradiol-Exposition unter der ovariellen Stimulation Rezidive auftreten können bzw. sich die Erkrankung verschlechtern kann. Bei Rezidivfällen ist die assistierte Reproduktion einem wiederholten operativen Eingriff bezüglich der Schwangerschaftsrate überlegen. |






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.