
- DAZ.online
- DAZ / AZ
- DAZ 37/2018
- Giftige „Heilpflanzen...
Toxikologie
Giftige „Heilpflanzen“ bei Paracelsus
Gefahr durch toxische Pyrrolizidinalkaloide
Zum Weiterlesen
„Giftige ‚Heilpflanzen‘ bei Hildegard von Bingen – Gefahr durch toxische Pyrrolizidinalkaloide“ von Prof. Dr. Dr. Erhard Röder finden Sie in DAZ 2015, Nr. 50, S. 60.
Nach dem frühen Tod der Mutter zog der Vater mit seinem Sohn 1502 nach Villach in Kärnten, wo er eine medizinische Praxis aufbaute und führte. Hier erhielt der Sohn, der sich später selbst Paracelsus nannte, in Medizin und der damals bekannten „Allchimie“ die ersten wichtigen Kenntnisse.
Nach Studium und Promotion wurde Paracelsus durch seine wissenschaftlichen Arbeiten sehr bekannt.
Er lebte ab 1527 in Basel und hielt an der dortigen Universität im medizinischen Bereich Vorlesungen. Da er mit dem damaligen theoretischen medizinischen Wissen nicht einverstanden war, versuchte er dieses zu grundieren und zu erweitern. Es gab enorme Widerstände und er erhielt Schmähschriften und persönliche Bedrohungen. Paracelsus musste seine Tätigkeit aufgeben und ins Elsass flüchten.
Aus dem Umfeld seiner Lehre waren es etwa 700 Pflanzen, die in Bayern, Süditalien und der Schweiz wachsen, die von ihm verwendet wurden. Seine Erfahrungen flossen in seine Publikationen ein. 1541 zog Paracelsus nach Salzburg, wo er im September des gleichen Jahres verstarb.
Toxizität der Pyrrolizidinalkaloide
Durch intensive Forschung in der Medizin und der Naturstoffchemie gerieten erst in der zweiten Hälfte des 20. Jahrhunderts einige altbekannte Arzneipflanzen ins Blickfeld von Forschern, weil sie toxische Pyrrolizidinalkaloide (PA) enthalten. Daraufhin wurden PA-Höchstgrenzen in Arzneimitteln festgelegt und Pflanzensorten gezüchtet, die frei von diesen Inhaltsstoffen sind. Eine Gefahr besteht jedoch weiterhin, wenn man wiederholt PA-haltige Pflanzen wild sammelt, um daraus z. B. einen „Gesundheitstee“ zu bereiten.
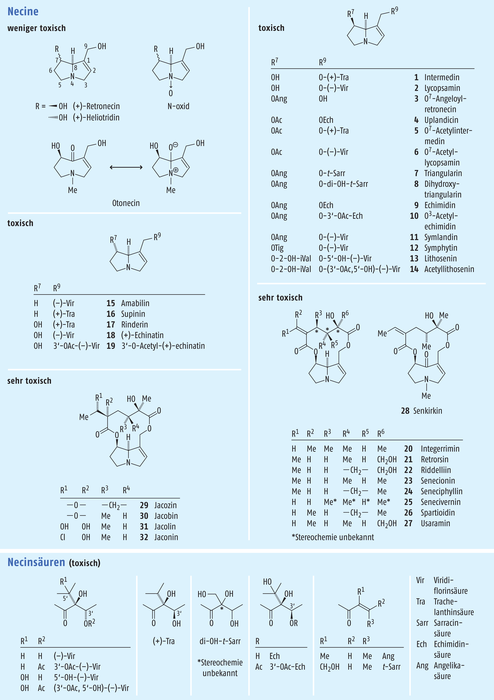
Grundlage dieser Alkaloide sind die Hydroxy- und die Hydroxymethyl-Pyrrolizidine in den wiedergegebenen Formeln. Sie werden Necine genannt.
Die Necine, die in Abb. 1 gezeigt werden, sind in der Lage, mit einer Vielzahl von Mono- und Dicarbonsäuren Esterverbindungen einzugehen und werden dann Necinsäuren genannt. Bislang konnten mehr als 650 dieser Pyrrolizidinalkaloide isoliert und strukturell aufgeklärt werden.
Die Alkaloide werden von den Pflanzen als Schutzfunktion gegen Tierfraß gebildet, da sie einen bitteren Geschmack haben und so von den Tieren gemieden werden.
Die Alkaloide kommen hauptsächlich in der Familie der Boraginaceae, in der Familie der Compositen, hier in den Unterfamilien Senecioneae und Eupatorieae, und ferner in der Familie der Fabaceae, hier in der Unterfamilie der Faboideae, vor.
Während der Wachstumsphase und Bioaktivität werden sie in den Wurzeln synthetisiert. Die „Rezeptur“ hierfür ist in der DNA der Pflanzen vorgegeben. Anschließend werden sie in die wasserlöslichen N-Oxide umgewandelt und im Phloem mit dem Saft in die oberirdischen Organe (Blätter, Blüten, Früchte) verbracht, wo sie als Abwehrstoffe gegen Tierfraß dienen.
Mehr als 90 dieser Verbindungen können sowohl bei Tieren als auch bei Menschen toxisch bis sehr toxisch sein, wenn sie in der Position 1,2 eine Doppelbindung tragen (Abb. 1).
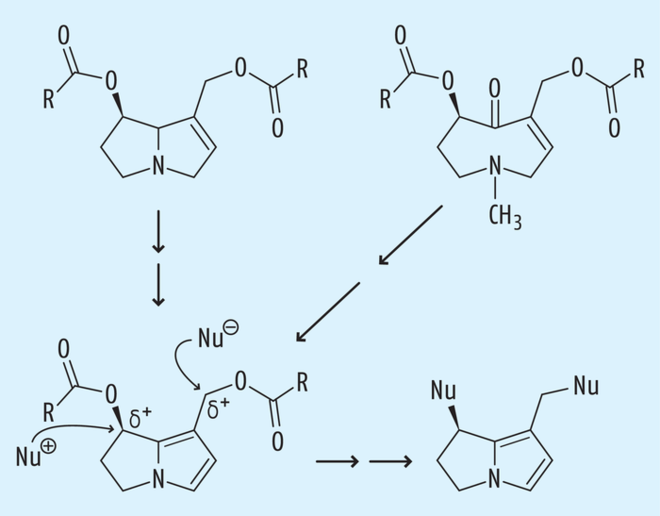
Die Alkaloide sind zunächst nicht direkt toxisch, sondern erst dann, wenn sie über das Blut in die Leber gelangen. Dann werden sie „toxifiziert“ [13], d. h. die Necine mit Doppelbindung werden per funktioneller Oxidation in Acyloxymethylpyrrolonecine (AMPN) umgewandelt.
Die Metabolite sind dann in der Lage, mit nucleophilen Proteinen und/oder DNA-Derivaten (Nu-) stabile Verbindungen einzugehen, wie das im Schema der Abb. 2 vereinfacht dargestellt ist [6,7]. Dadurch sind sie in der Leber sowohl akut als auch chronisch toxisch, mutagen, teratogen oder karzinogen wirksam.
PA-haltige Pflanzen bei Paracelsus
Aus der Vielzahl der von Paracelsus beschriebenen und verwendeten Heilpflanzen mit denen sich Manfred Junius [10] eingehend befasst hat, enthalten etliche toxische Pyrrolizidinalkaloide. Sie sollen im Folgenden besprochen werden und sind durch ihre jeweiligen Strukturformeln illustriert.
Anchusa officinalis, Ochsenzunge (Boraginaceae), ist im ganzen Mittelmeergebiet, nördlich bis Südfrankreich und Südschweiz beheimatet, angebaut wird sie im südlichen Europa. Wegen ihrer adstringierenden Wirkung wurde sie bei Diarrhoe, äußerlich zur Behandlung von Hauterkrankungen, die Wurzeldroge zur Färbung von Arzneimitteln, Lebensmittel und in der Kosmetik als Farbmittel verwendet. Neben dem intensiven roten Farbstoff Alkannin enthält sie die Alkaloide O7-Angeloylretronecin (3), Triangularin (7), Dihydroxytriangularin (8) [15].
Borago officinalis, Borretsch (Boraginaceae), ist verbreitet im Mittelmeergebiet und Mitteleuropa. Es diente bei Venenentzündungen, gegen Brust- und Bauchfellentzündungen, zur Blutreinigung, allgemein schleimlösend, schmerzlindernd. Es enthält die Alkaloide Intermedin (1), Lycopsamin (2), O7-Acetylintermedin (5), O7-Acetyllycopsamin (6), Amabilin (15) Supinin (16) [13].
Cynoglossum officinale, Echte Hundszunge (Boraginaceae), ist eine in Mitteleuropa weit verbreitete Pflanze. Arzneilich wird das Kraut innerlich und äußerlich als Antineuralgikum und äußerlich als Wundheilmittel verwendet. Es enthält die toxischen Alkaloide Amabilin (15), Supinin (16), Rinderin (17), Echinatin (18), 3’-O-Acetylechinatin (19) [3].
Echium vulgare, Natternkopf (Boraginaceae), kommt im ganzen europäischen Raum vor, in der Schweiz bis in Höhen von 2400 Metern. Ihm werden hustenlösende, harntreibende und wundheilende Eigenschaften zugeschrieben. Auch bei äußerlichen Entzündungen und Furunkeln soll es wirksam sein. Er enthält die Alkaloide Echimidin (9), O3`-Acetylechimidin (10) [4].
Lithospermum officinale L. (L. minus), Echter Steinsame (Boraginaceae), ist verbreitet in Mitteleuropa, West- und Zentralasien, eingebürgert in Nordamerika. Die Samen wurden gegen Steinleiden (Galle und Harn), weiterhin gegen Rheuma und Gicht eingesetzt. Enthält die Alkaloide Lithosenine (13) und Acetyllithosenine (14) [11].
Senecio jacobaea, Jacobs-Kreuzkraut (Compositae, Senecioneae), ist verbreitet in Europa, in westlichen Teilen Asiens und Nordafrika. Es wurde eingesetzt gegen Angina, Durchfall, Husten, Insektenstiche, Hämorrhoiden. Es enthält die sehr toxischen Alkaloide Senecionin (23), Seneciphyllin (24), Jacozin (29), Jacobin (30), Jacolin (31), Jaconin (32) [16].
Senecio vulgaris, Gemeines Kreuzkraut (Compositae, Senecioneae), ist in den gemäßigten Zonen Europas weit verbreitet. Vor ein bis zwei Jahrhunderten wurde es in Amerika eingeschleppt und ist dort in den gemäßigten Zonen ebenfalls weit verbreitet. Es wurde als blutstillendes Mittel, vor allem bei Nasenbluten eingesetzt. Enthält die sehr toxischen und karzinogenen Alkaloide Integerrimin (20), Retrorsin (21), Riddelliin (22), Senecionin (23), Seneciphyllin (24), Senecivernin (25), Spartioidin (26), Usaramin (27) [1, 17].
Symphytum officinale, Beinwell (Boraginaceae), ist in Europa, West- und Kleinasien weit verbreitet. Eingesetzt wurde Beinwell bei Knochenbrüchen, Muskel- und Gelenkbeschwerden, Prellungen, Verstauchungen und als Wundheilmittel. Es enthält die toxischen karzinogenen Alkaloide Intermedin (1), Lycopsamin (2), Uplandicin (4), O7-Acetylintermedin (5), O7-Acetyllycosamin (6), Echimidin (9), Symlandin (11), Symphytin (12) [8, 9].
Tussilago farfara, Huflattich (Compositae, Senecioneae), ist weit verbreitet in Europa, Afrika und seit dem 18. Jahrhundert in Nordamerika eingebürgert. Wegen der vorhandenen Schleimstoffe wurde Huflattich schon in der Antike als Mittel gegen Reizhusten eingesetzt. Es enthält die sehr toxischen und karzinogenen Alkaloide Senecionin (23) und Senkirkin (28) [2,15]. |
Literatur
[1] Cheng D, Nguyen VT, Ndihokubwayo, Ge J, Mulder PPJ. Pyrrolizidine alkaloid variation in Senecio vulgaris populations from native and invasive ranges. PeerJ. 2017 Aug 14;5:e3686.
[2] Culvenor CCJ, Edgar JA, Smith LW, Hirono I. The Occurrence of Senkirkine in Tussilago farfara. Aust. J. Chem. 1976;29:229-230
[3] El-Shazly A, Sarg T, Ateya A, Aziz E, Abdel E, Witte L, Wink M. Pyrrolizidine alkaloids of Cynoglossum officinale and Cynoglossum amabile. Biochem. System. Ecolog. 1996;24(5):415-421
[4] El-Shazly A, Sarg T, Ateya A, Aziz AA, El-Dahmy S. J. Nat. Pyrrolizidine Alkaloids from Echium setosus and Echium vulgare. Prod. 1996;59:310-313
[5] Fu PP, Xia Q, Lin G, Chou MW. Genotoxic Pyrrolizidine Alkaloids-Mechanism Leading to DNA Adduct Formation and Tumorgenicity. Int. J. Mol. Sci. 2002;3:948-964
[6] Fu PP, Xia Q, Lin G, Chou MW. Pyrrolizidine Alkaloids-Genotoxicity, Metabolism, Enzymes, Metabolic Activation, and Mechanisms. Drug Metabol. Rev. 2004;36(1):1-55
[7] Fu PP Chem. Pyrrolizidine Alkaloids: Metabolic Activation Pathways Leading to Liver Tumor Initiation. Res. Tox. 2017; 30: 81-93.
[8] Furuya T, Araki K. Studies on Constituents of Crude Drugs I. Alkaloids of Symphytum officinale L. Chem. Pharm. Bull. 1968; 16(12): 2512-2516
[9] Furuya T, Hikichi M. Alkaloids and Triterpenoids of Symphytum officinale. Phytochemistry 1971; 10: 2217-2220
[10] Junius Manfred M. Praktisches Handbuch der Pflanzen-Alchemie. Ansata-Verlag Paul A. Zemp, Schweiz
[11] Krenn L, Wiedenfeld H, Roeder E. Pyrrolizidine Alkaloids from Lithospermum officinale. Phytochemistry 1994; 37 (1): 275-277
[12] Lüthy J, Brauchli J, Zweifel U, Schmid P, Schlatter Ch. Pyrrolizidin-Alkaloide in Arzneipflanzen der Boraginaceen: Borago officinalis L. und Pulmonaria officinalis L. Pharm. Acta Helv. 1984; 59(9-10): 242-246
[13] Mutschler E. et al. Arzneimittelwirkung. 2012: 10: 1012-1013, Wiss. Verlagsgesellschaft Stuttgart
[14] Roeder E, Wiedenfeld H, Schraut R. Pyrrolizidine Alkaloids from Alkanna tinctoria. Phytochemistry 1984; 23 (9): 2125-2126
[15] Rosberger DF, Resch JF, Meinwald JF. The Occurrence of Senecionine in Tussilago farfara. Mitt. Gebiete Lebensm. Hyg. 1981; 72: 432-536.
[16] Segall HJ, Toxicol. Pyrrolizidine alkaloids derived from Senecio jacobaea. Lett. 1978; 1(5-6): 279-284
[17] Segall HJ, J. Preparative isolation of pyrrolizidine alkaloids derived from Senecio vulgaris. Liq. Chromatogr. 1979; 2(9): 1319-1323



































0 Kommentare
Das Kommentieren ist aktuell nicht möglich.