
- DAZ.online
- DAZ / AZ
- DAZ 41/2019
- Kurz gemeldet
Arzneimittel und Therapie
Kurz gemeldet
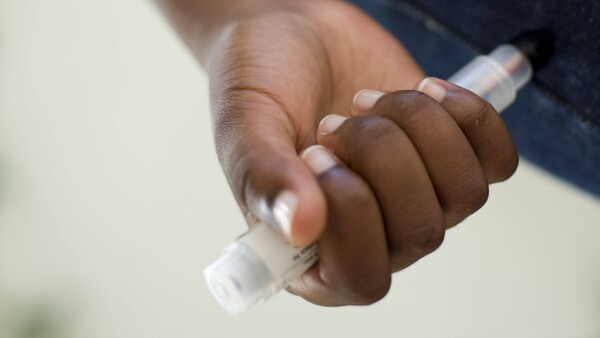
Probleme bei Adrenalin-Pen hören nicht auf
Statt mit einer „Spritzenblockade“ hat der Hersteller des Adrenalin-Pens Emerade® nun mit einem „Aktivierungsfehler“ zu kämpfen. Das gaben die Pharma Swiss Česká republika s.r.o. (Zulassungsinhaber) und die Dr. Gehard Mann chem.-pharm. Fabrik (Mitvertreiber) in einem Rote-Hand-Brief bekannt. Die Mängel, die zu einer Blockade beim Auslösen der Spritze geführt hatten, konnten zwischenzeitlich behoben werden. Die hiervon betroffenen Chargen wurden nun zurückgerufen. Doch Allergiker sollten zur Sicherheit weiterhin zwei Pens mit sich führen. Grund dafür ist ein neues Problem: Der Pen lässt sich unter Umständen nicht aktivieren. Bei normaler Auslösekraft wird die Nadel dann nicht aus ihrer Vorrichtung gelöst. Eine Injektion ist nicht möglich. Stellt der Patient fest, dass der Nadelschutz bei der Anwendung nicht ausfährt, sollen noch zwei weitere Versuche unternommen werden, um den Pen zu aktivieren. Funktioniert das nicht, muss der Zweitpen benutzt werden. Wie der Zulassungsinhaber mitteilt, ist der „Aktivierungsfehler“ nicht spezifisch für eine bestimmte Charge.
Ondansetron erhöht Risiko für Fehlbildungen
Wird Ondansetron im ersten Trimenon der Schwangerschaft eingesetzt, kann dies beim ungeborenen Kind zu Fehlbildungen im Bereich der Lippen, des Kiefers und des Gaumens führen. Davor warnen die Zulassungsinhaber Ondansetron-haltiger Arzneimittel in einem Rote-Hand-Brief. Hintergrund sind Beobachtungen aus epidemiologischen Studien. So wurde in einer Kohortenstudie, in der 1,8 Millionen Schwangerschaften berücksichtigt wurden, ein erhöhtes Risiko für orofaziale Fehlbildungen ermittelt (s. DAZ 2019, Nr. 6, S. 35): Eine Anwendung des Antiemetikums war mit drei zusätzlichen Fällen pro 10.000 Frauen verbunden. Das adjustierte relative Risiko betrug 1,24 (95%-Konfidenzintervall 1,03 bis 1,48). Ondansetron sollte daher nicht während des ersten Trimenons verwendet werden. Ein entsprechender Hinweis wird nun in den Fachinformationen ergänzt. Auch wenn der 5-HT3-Rezeptorantagonist offenbar in zunehmendem Ausmaß für die Behandlung von Übelkeit und Erbrechen in der Schwangerschaft verschrieben wird, ist Ondansetron in dieser Indikation nicht zugelassen.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.