
- DAZ.online
- DAZ / AZ
- DAZ 52/2019
- Neue Arzneimittel 2019
Neue Arzneimittel
Neue Arzneimittel 2019
Analgetika, Migränemittel
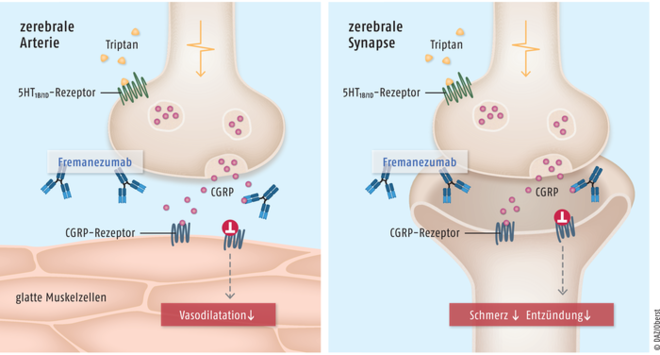
Erenumab, Fremanezumab und Galcanezumab
Das Neuropeptid CGRP (Calcitonin-Gene-Related-Peptide) wird im peripheren und im zentralen Nervensystem exprimiert und ist maßgeblich an der Pathophysiologie der Migräne beteiligt. Über den Eingriff in die nozizeptive Transmission spielt CGRP bei der Schmerzauslösung und der neurogenen Entzündung eine zentrale Rolle. Zudem wirkt es stark vasodilatierend, beispielsweise auf zerebrale Blutgefäße. Der zugehörige G-Protein-gekoppelte CGRP-Rezeptor ist unter anderem an Stellen wie dem Ganglion trigeminale lokalisiert, die für die Auslösung der Migräne relevant sind. Während eines Migräneanfalls wird ein signifikanter Anstieg der CGRP-Konzentration registriert, der sich beim Abklingen der Kopfschmerzen wieder normalisiert. Durch eine intravenöse Infusion von CGRP sind Migräne-ähnliche Kopfschmerzen auslösbar. Bei Patienten mit chronischer Migräne ist durch die Unterbindung der CGRP-Aktivität eine signifikante Reduktion der Kopfschmerz-Frequenz möglich. Erenumab (Aimovig®) ist ein vollständig humaner monoklonaler IgG2-Antikörper. Die Substanz ist spezifisch gegen die α-Form des CGRP-Rezeptors gerichtet und konkurriert mit dem körpereigenen Agonisten CGRP um die Bindungsstelle. Der humanisierte monoklonale IgG2Δa/κ-Antikörper Fremanezumab (Ajovy®) ist hochspezifisch gegen beide Isoformen des Neuropeptids α- und β-CGRP gerichtet und unterbindet deren biologische Aktivität, sodass eine Interaktion mit dem zugehörigen Rezeptor nicht mehr stattfindet. Galcanezumab (Emgality®) ist ein humanisierter monoklonaler IgG4-Antikörper der hochspezifisch gegen das Neuropeptid CGRP gerichtet ist und direkt dessen biologische Aktivität unterbindet, sodass eine Interaktion mit dem zugehörigen CGRP-Rezeptor nicht mehr stattfindet.
Das Neuropeptid CGRP (Calcitonin Gene-Related Peptide) spielt bei der Pathophysiologie der Migräne eine zentrale Rolle. Insbesondere im Bereich des Trigeminusnervs führt es zur Schmerzauslösung in Verbindung mit neurogenen Entzündungen sowie zur Vasodilatation zerebraler Gefäße. Fremanezumab ist ein Antikörper, der hochspezifisch gegen das Neuropeptid CGRP gerichtet ist. Erenumab und Galcanezumab sind Antikörper, die gegen den zugehörigen CGRP-Rezeptor gerichtet sind und den körpereigenen Agonisten CGRP von seiner Bindungsstelle verdrängen. Als Folge wird die Anfallshäufigkeit bei Patienten mit chronischer Migräne reduziert.
Antidote
Andexanet alfa
Andexanet alfa (Ondexxya®) gilt als ein bedeutender therapeutischer Fortschritt. Die Substanz ist das erste Antidot, das die Wirkung der sehr häufig eingesetzten Faktor-Xa-Inhibitoren Apixaban und Rivaroxaban aus der Gruppe der direkten oralen Antikoagulanzien aufhebt, die zur Prophylaxe oder Behandlung von venösen Thromboembolien und Schlaganfällen eingesetzt werden. Der Effekt tritt innerhalb kürzester Zeit ein, sodass bei lebensbedrohlichen oder unkontrollierten Blutungen ein schnelles Eingreifen möglich ist und möglicherweise Leben gerettet werden können. Anders als genuiner Faktor Xa enthält das humane Faktor-Xa-Protein Andexanet alfa im Bereich des aktiven Zentrums die Aminosäure Alanin anstelle von Serin. Das Molekül ist daher nicht in der Lage, Prothrombin zu spalten und zu aktivieren. Genau wie der genuine Faktor Xa bindet es jedoch an die Faktor-Xa-Inhibitoren Apixaban bzw. Rivaroxaban und fängt diese ab. Außerdem fehlt in Andexanet alfa die γ-Carboxyglutaminsäure(GLA)-Domäne, sodass auch die Bildung des Prothrombinasekomplexes mit Faktor Va unterbunden wird. Insgesamt wird die antikoagulatorische Wirkung von Faktor-Xa-Inhibitoren aufgehoben. Andexanet alfa ist derzeit nur als Antidot für Apixaban und Rivaroxaban indiziert, wahrscheinlich ist es jedoch auch für Blutungen unter dem weiteren Faktor-Xa-Inhibitor Edoxaban einsetzbar, da auch dieser Wirkstoff an das aktive Zentrum des genuinen Faktors Xa bindet.
Antineoplastische Mittel
Abemaciclib
Postmenopausale Frauen mit fortgeschrittenem Mammakarzinom entwickeln häufig Resistenzen gegen die endokrine Standardtherapie mit antiestrogenen Wirkstoffen. Aufgrund der schlechten Prognose der Betroffenen wird hier ein hoher therapeutischer Bedarf an neuen Pharmaka gesehen. Bei etwa 60% der Patientinnen mit metastasiertem Brustkrebs ist zudem ein HR-positiv-/HER2-negativ-Rezeptorstatus feststellbar. In diesen Fällen bietet sich eine Behandlung mit Abemaciclib (Verzenios®) an, einem oral applizierbaren Proteinkinase-Inhibitor der Cyclin-abhängigen Kinasen 4 und 6 (CDK4/6). Allerdings stellt der neue CDK4/6-Inhibitor Abemaciclib keinen wirklich relevanten therapeutischen Fortschritt dar. Seit mehr als einem Jahr stehen aus dieser Wirkstoffklasse Palbociclib und Ribociclib zur Verfügung, mit denen beim fortgeschrittenen Mammakarzinom ähnlich gute Ergebnisse hinsichtlich Wirksamkeit – eine hochsignifikante Verlängerung des progressionsfreien Überlebens – erzielt werden. Ein Vorteil für Abemaciclib besteht darin, dass es in Kombination mit dem Estrogenrezeptor-Antagonisten Fulvestrant auch bei nicht endokrin vorbehandelten Patientinnen eingesetzt werden kann und dass keine Therapiepausen erforderlich sind.
Brigatinib
Brigatinib (Alunbrig®) ist als Monotherapeutikum zur Behandlung von Erwachsenen mit anaplastischem-Lymphomkinase(ALK)-positivem, fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom (non-small cell lung cancer, NSCLC) indiziert. Die Wirkung der Substanz beruht hauptsächlich auf einer Hemmung der Rezeptor-Tyrosinkinase ALK. In den letzten Jahren wurden bei der Behandlung des ALK-positiven nicht-kleinzelligen Lungenkarzinoms große Erfolge erzielt. Der erste 2012 in Europa zugelassene ALK-Inhibitor Crizotinib ist den häufig als Erstlinien-Behandlung eingesetzten Platin-basierten Chemotherapeutika signifikant überlegen. Aber es führt bei den meisten Patienten zu Erkrankungsprogressionen, insbesondere zur Bildung von Gehirnmetastasen. Für diese Crizotinib-refraktären Patienten wurden 2015 und 2017 Ceritinib und Alectinib als ALK-Inhibitoren der zweiten Generation eingeführt, deren zusätzlicher Nutzen in klinischen Studien bestätigt worden war. Als dritter Wirkstoff aus dieser Klasse stellt nun Brigatinib einen gewissen weiteren therapeutischen Fortschritt dar. Insbesondere die durch Brigatinib gewonnene Lebenszeit ohne Erkrankungsprogression und das Gesamtüberleben sind möglicherweise länger als unter Ceritinib- und Alectinib-Therapie, direkte Vergleichsstudien fehlen aber.
Informationen zu neuen Wirkstoffen
In der monatlich erscheinenden Beilage „Neue Arzneimittel“ stellen wir Ihnen alle neuen Wirkstoffe ausführlich vor und ordnen sie in die bestehenden Therapieoptionen ein. Ein Archiv mit allen seit 2000 eingeführten Wirkstoffen finden Sie auf DAZ.online unter www.deutsche-apotheker-zeitung.de im Bereich „Pharmazie“.
Oder Sie geben einfach in die Suchfunktion auf DAZ.online den Webcode P7YV8 ein und gelangen direkt zur Übersichtsseite der „Neuen Arzneimittel“. Dort können Sie als Abonnent nach Wirkstoffnamen, Handelsbezeichnung, Einführungsjahr oder ATC-Code suchen.
Lorlatinib
In den letzten Jahren sind in der Behandlung des ALK-positiven nicht-kleinzelligen Lungenkarzinoms (NSCLC) große Erfolge erzielt worden. Zwischen 2012 und 2019 wurden verschiedene ALK-Inhibitoren der ersten und zweiten Generation wie Crizotinib bzw. Ceritinib, Alectinib und Brigatinib (s. o.) entwickelt. Lorlatinib (Lorviqua®) ist ein weiterer Inhibitor der Rezeptor-Tyrosinkinase anaplastische Lymphomkinase (ALK). Es ist als Monotherapeutikum zur Behandlung von Erwachsenen mit ALK-positivem, fortgeschrittenem nicht-kleinzelligem Bronchialkarzinom indiziert. Lorlatinib wird derzeit bei therapierefraktären Patienten bei einer Tumor-Progression nach Therapie mit den weiteren ALK-Tyrosinkinase-Inhibitoren Alectinib oder Ceritinib eingesetzt oder nach erfolgloser Therapie mit dem weiteren Tyrosinkinase-Inhibitor Crizotinib und mindestens einem anderen ALK-Tyrosinkinase-Inhibitor. Tierexperimentelle Untersuchungen haben gezeigt, dass Lorlatinib die Blut-Hirn-Schranke passieren kann und auch bei NSCLC-assoziierten Hirnmetastasen effektiv ist.
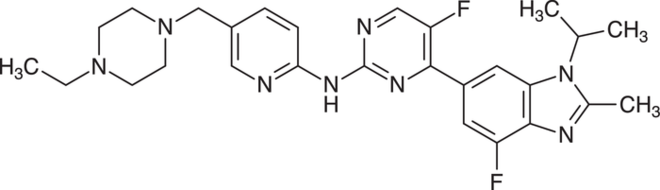
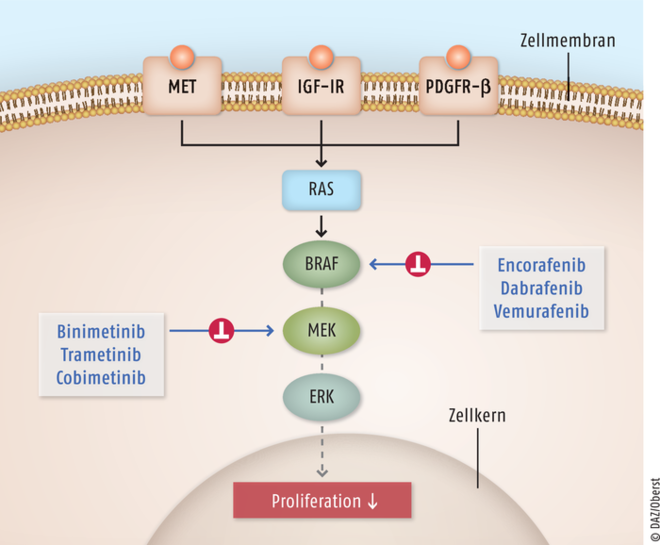
Binimetinib und Encorafenib
Der Proteinkinase-Inhibitor Binimetinib (Mektovi®) wurde zur Behandlung Erwachsener mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600E- oder -V600K-Mutation eingeführt. Der Proteinkinase-Inhibitor wird stets in Kombination mit dem BRAF-Inhibitor Encorafenib (Braftovi®) eingesetzt. Durch die gleichzeitige Hemmung von zwei Kinasen des aktivierten MAPK(Mitogen-aktivierten-Proteinkinasen)-Signalübertragungswegs wird das Fortschreiten der malignen Erkrankung verzögert. Der MAPK-Signalweg umfasst die vier Proteinkinasen RAS, BRAF, MEK und ERK. Über diese Reihe hintereinandergeschalteter Enzyme werden extrazelluläre, proliferationsfördernde Signale in das Zellinnere weiter geleitet. Bei malignen Tumoren ist häufig dieser Signalübertragungsweg dauerhaft aktiviert. Als Folge wird möglicherweise ein Tumorwachstum gefördert. Binimetinib hemmt nicht-ATP-kompetitiv und reversibel die Aktivierung der ME-Kinasen 1 und 2 durch BRAF sowie die ME-Kinase-Aktivität selbst, sodass die Signalübertragung unterbleibt und bei Melanom-Zelllinien mit BRAF-V600-Mutation antitumorale und antiproliferative Effekte sichtbar werden. Binimetinib wirkt bei der Hemmung des MAPK-Signalwegs mit dem direkten BRAF-Kinasen-Inhibitor Encorafenib synergistisch, wodurch die Antitumor-Aktivität größer ist. Zudem ist der kombinierte Einsatz der beiden Substanzen besser verträglich und es entwickeln sich seltener Resistenzen. Binimetinib ist nach Cobimetinib und Trametinib der dritte auf dem Markt befindliche MEK-1/2-Inhibitor. Ebenso ist auch der Wirkansatz des BRAF-Inhibitors Encorafenib nicht völlig innovativ. Mit Dabrafenib und Vemurafenib stehen aus dieser Gruppe bereits zwei Präparate zur Verfügung. Auch die kombinierte Anwendung von MEK- und BRAF-Inhibitoren stellt keine Neuerung dar.
Binimetinib ist ein reversibler, selektiver, nicht-ATP-kompetitiver Inhibitor der Mitogen-aktivierten extrazellulären Signal-regulierten Kinasen (MEK) 1 und 2. Encorafenib ist ein selektiver, ATP-kompetitiver Inhibitor der B-Raf-Protein(BRAF)-Kinase. Die Substanz hemmt spezifisch das Wachstum von Tumorzellen mit BRAF-V600-Mutation. Beide niedermolekularen, peroral verfügbaren Arzneistoffe blockieren den Mitogen-aktivierten-Proteinkinase(MAPK)-Weg an verschiedenen Stellen, sodass eine synergistische Wirkung erreicht wird. Durch die Hemmung der MAPK-induzierten Zellproliferation kommt es bei Melanom-Zelllinien mit BRAF-V600-Mutation zu antitumoralen und antiproliferativen Effekten. MEK: Mitogen-aktivierte Signal-regulierte Kinasen; ERK: extrazelluläre Signal-regulierte Kinasen; RAS: Rat sarcoma-G-Protein; BRAF: B-Raf-Protein (rapidly accelerated fibrosarcom); MET: Rezeptortyrosinkinase; IGF-IR: Insulin-like-growth-factor-Insulin-Rezeptor; PDGFR-β: Platelet-derived-growth-factor-Rezeptor beta
Dacomitinib
Dacomitinib (Vizimpro®) ist ein irreversibler Inhibitor des epidermalen Wachstumsfaktor-Rezeptors (epidermal growth factor receptor, EGFR), der gegen die HER-Unterfamilien HER1, HER2 und HER4 wirkt. Er wird auch als Pan-EGFR/HER-Inhibitor bezeichnet und gilt als mäßiger therapeutischer Fortschritt. Dacomitinib wird als Monotherapeutikum für die Erstlinien-Behandlung Erwachsener mit lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkarzinom eingesetzt. In einer Studie erwies sich der irreversible EGFR-Inhibitor der zweiten Generation zwar hinsichtlich des progressionsfreien Überlebens gegenüber dem reversiblen EGFR-Inhibitor Gefitinib als überlegen. Dieser Unterschied war jedoch nur bei gemeinsamer Betrachtung asiatischer und nicht asiatischer Patienten signifikant. Derzeit ist offen, welche NSCLC-Patienten mit mutierten EGFR-Formen von dem neuen EGFR-Inhibitor profitieren.
Cemiplimab
Das Immuntherapeutikum Cemiplimab (Libtayo®) ist die erste für das metastasierte oder lokal fortgeschrittene kutane Plattenepithelkarzinom speziell zugelassene Therapieoption. Der monoklonale Antikörper richtet sich gegen den Checkpoint-Rezeptor der programmierten Zelltod-Liganden 1 und 2 (Programmed-Death-L1 und -L2, PD-L1 und PD-L2). Der Wirkmechanismus des Antikörpers ist nicht völlig innovativ. Mit Nivolumab und Pembrolizumab sind bereits seit einigen Jahren zwei PD-1-Rezeptor-Inhibitoren zur Behandlung des malignen Melanoms und des nicht-kleinzelligen Lungenkarzinoms im Einsatz.
Durvalumab
Das Immuntherapeutikum Durvalumab (Imfinzi®) wird als Monotherapeutikum zur Behandlung von Erwachsenen mit lokal fortgeschrittenem, nicht operablem nicht-kleinzelligem Lungenkarzinom (NSCLC) eingesetzt. Als monoklonaler Antikörper richtet sich die Substanz gegen den programmierten Zelltod-Liganden 1 (Programmed Death Ligand 1, PD-L1) des entsprechenden Checkpoint-Rezeptors und ist für NSCLC-Patienten geeignet, deren Krankheit nach einer Platin-basierten Radiochemotherapie nicht fortgeschritten ist. Durvalumab stellt nach derzeitigem Kenntnisstand einen moderaten therapeutischen Fortschritt dar. Der Checkpoint-Inhibitor ist nach Avelumab und Atezolizumab der dritte auf dem deutschen Markt verfügbare PD-L1-Antikörper, wobei nur Atezolizumab derzeit auch für die NSCLC-Therapie zugelassen ist.
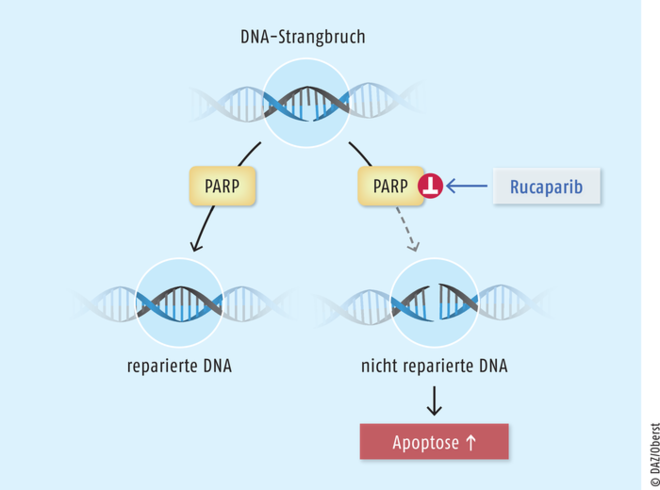
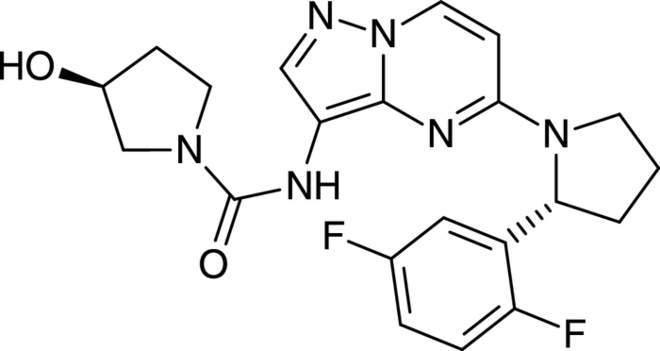
Rucaparib
Da das progressionsfreie Überleben beim Ovarialkarzinom nach jedem Behandlungszyklus etwas kürzer wird und viele Frauen nach zwei bis drei Chemotherapie-Linien keine weitere mehr tolerieren, existiert ein hoher Bedarf an effektiven Zweitlinien-Therapieoptionen zur Lebensverlängerung. Für Frauen mit Platin-sensitivem, rezidiviertem Ovarial-, Eileiter- oder Peritonealkarzinom stellt der PARP-1-, -2- und -3-Inhibitor Rucaparib nach derzeitigem Kenntnisstand einen deutlichen therapeutischen Fortschritt dar. Die humanen Poly(ADP-Ribose)-Polymerase-Enzyme PARP-1, PARP-2 und PARP-3 dienen zur Reparatur von DNA-Einzelstrangbrüchen. Anders als die bereits zur Behandlung des Ovarialkarzinoms auf dem Markt befindlichen beiden PARP-Inhibitoren Niraparib und Olaparib kann Rucaparib nicht nur zur Erhaltungstherapie, sondern auch bei rezidivierten oder progressiven Tumoren als Monotherapeutikum eingesetzt werden, wenn die Behandlung mit Platin-Verbindungen nicht mehr infrage kommt. In diesen Fällen ist allerdings ein Nachweis von Mutationen der BRCA-1- und -2-Tumorsuppressorgene erforderlich, da bei diesen Patientinnen die Tumorzellen durch die alleinige Eliminierung des PARP-DNA-Reparaturwegs unter Umständen nicht effektiv genug bekämpft werden können.
Rucaparib ist ein Inhibitor der humanen Poly(ADP-Ribose)-Polymerase-Enzyme 1, 2 und 3 (PARP-1, -2 und -3), die zur Reparatur von DNA-Einzelstrangbrüchen dienen. Die Substanz bewirkt, dass die DNA-Reparatur durch PARP nicht stattfindet, es zu Doppelstrangbrüchen kommt mit der Folge von Apoptose und Zelltod. Tumorzellen weisen insgesamt häufiger DNA-Schäden auf und sind daher wesentlich stärker auf ein effektives Reparatursystem angewiesen als gesunde Körperzellen.
Streptozocin
Beim Zytostatikum Streptozocin (Zanosar®) handelt es sich um keinen neuen Wirkstoff im eigentlichen Sinne. Seine selektiv toxische, gegen die Betazellen in den Langerhans-Inseln der Bauchspeicheldrüse gerichtete Wirkung ist bereits seit den 1960er-Jahren bekannt. Bereits damals wurde der Nitrosoharnstoff in der experimentellen Diabetesforschung und auch in ersten klinischen Studien zur Behandlung von Insulin-produzierenden Tumoren der Bauchspeicheldrüse eingesetzt. 1982 wurde es zum ersten Mal durch die amerikanische Food and Drug Administration zugelassen, die Kombination aus Streptozocin und 5-Fluorouracil gehört weltweit zu den Standardtherapieregimen für das fortgeschrittene Insulinom. Nun muss die Zubereitung nicht mehr aus dem Ausland importiert werden, sondern kann als Zanosar® direkt innerhalb von Deutschland bezogen werden. Aufgrund seiner mutagenen, karzinogenen und nephrotoxischen Wirkungen ist der Einsatz auf die Behandlung von Insulinomen beschränkt, die nicht operativ entfernt werden können.
Chlormethin
Chlormethin (Ledaga®) ist zur topischen Behandlung von Erwachsenen mit kutanem T-Zell-Lymphom des Typs Mycosis fungoides (mycosis-fungoides-type cutaneous T-cell lymphoma, MF-CTCL) indiziert. Chlormethin ist als Stickstofflost-Derivat ein bifunktionelles Alkylans und bindet mit beiden reaktiven Domänen an DNA, RNA und Proteine. Als Folge wird die Replikation von exponierten Zellen unterbunden und es kommt zur Apoptose. Besonders empfindlich reagieren schnell proliferierende Gewebe wie Tumorzellen. Aufgrund der topischen Applikation wird die systemische Belastung der Patienten niedrig gehalten. Chlormethin wurde bereits seit mehr als 70 Jahren zur Behandlung von Morbus Hodgkin, Lymphosarkomen, chronisch-myeloischer oder -lymphatischer Leukämie oder Lungenkarzinomen eingesetzt. Dennoch gab es bisher in Deutschland kein zugelassenes Fertigarzneimittel mit topischem Chlormethin. Die Handhabung des Alkylans muss mit größter Vorsicht erfolgen, um bei Patienten und Pflegepersonal einen Kontakt zu gesundem Gewebe zu vermeiden.
Larotrectinib
Ein völlig neuer Ansatz wird mit Larotrectinib (Vitrakvi®) verfolgt. Der selektive Tropomyosin-Rezeptor-Kinase(TRK)-Inhibitor wird bei lokal fortgeschrittenen oder metastasierten soliden Tumoren und einer neurotrophen Tyrosin-Rezeptor-Kinase(NTRK)-Genfusion angewendet. Bei etwa einem Prozent aller soliden malignen Tumoren liegt aufgrund von Mutationen ein Fusionsprotein von einem der Gene Neurotrophe-Rezeptor-Tyrosin-Kinase 1 bis 3 (NTRK 1 bis 3) vor. Fusionsproteine entstehen durch die gemeinsame Expression zweier Gene oder Genteile, die hintereinander im Genom liegen. Beide Gene werden so abgelesen, als ob es sich um ein einziges Gen handelt. Bei deren Replikation entstehen chimäre onkogene Tropomyosin-Rezeptor-Kinase(TRK)-Proteine. Als Folge kommt es zur dauerhaften Aktivierung nachgeschalteter Signalwege, die zu gesteigerter Zellproliferation und verbessertem Zellüberleben führen. TRK-Fusionstumoren sind nicht an bestimmte Gewebearten gebunden und können daher überall im Körper auftreten. Die Behandlung mit dem TRK-Inhibitor Larotrectinib ist für bereits austherapierte Tumorpatienten mit entsprechender Mutation als relevanter therapeutischer Fortschritt anzusehen. Die Behandlung ist mit einer frühzeitigen Response und hohen Ansprechraten von mehr als 75% assoziiert, das progressionsfreie bzw. Gesamtüberleben (mindestens zwölf Monate) hält relativ lang an.
Andere Mittel für das alimentäre System und Stoffwechsel
Vestronidase alfa
Die genetisch bedingte lysosomale Speicherkrankheit Mucopolysaccharidose VII ist mit weltweit etwa 200 Betroffenen eine ausnehmend seltene Erkrankung. Meistens treten bereits im Kindesalter fortschreitende Symptome wie grobe Gesichtszüge mit großem Kopf, Gelenkdeformierungen oder Kleinwuchs auf. In schweren Fällen haben schon Neugeborene schwere generalisierte Ödeme, die tödlich sein können. Aber auch bei minderschweren Verläufen führen die schweren zellulären und organischen Dysfunktionen oft schon bei Jugendlichen zum Tode. Bislang ist keine kurative Therapieoption verfügbar. Mithilfe der rekombinant hergestellten Form des humanen Enzyms Beta-D-Glucuronidase Vestronidase alfa (Mepsevii®) können nicht-neurologische Manifestationen der Erkrankung gemildert werden. Das Orphan-Drug Vestronidase alfa ist daher als therapeutischer Fortschritt anzusehen, allerdings ist es nicht möglich, irreversible Schädigungen rückgängig zu machen.
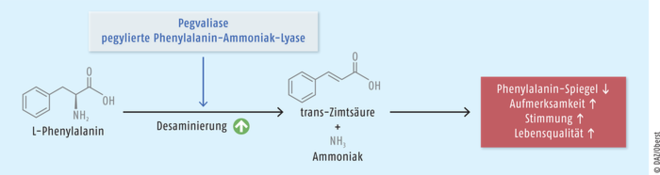
Pegvaliase
Für Patienten mit Phenylketonurie (PKU) gilt der neue Wirkstoff Pegvaliase (Palynziq®) als ein relevanter therapeutischer Fortschritt. Das pegylierte Konjugat des Proteins Phenylalanin-Ammoniak-Lyase ist indiziert, wenn die Blut-Phenylalanin-Werte trotz der Einhaltung einer Diät und weiterer Behandlungsoptionen oberhalb von 600 µmol/l liegen. Patienten mit der autosomal-rezessiv vererbten PKU sind aufgrund des fehlenden bzw. defekten Enzyms Phenylalanin-Hydroxylase nicht in der Lage, die Aminosäure Phenylalanin aus der Nahrung zu Tyrosin zu hydroxylieren. Ohne geeignete Behandlung oder Einhaltung einer Phenylalanin-armen Diät führt die Erkrankung zu einer fortschreitenden geistigen Retardierung, zu einer progredienten Verzögerung der psychomotorischen Entwicklung sowie zu aggressivem und autistischem Verhalten. In Studien konnte bei sehr vielen Patienten durch die Enzymtherapie der angestrebte Bereich zwischen 120 und 600 µmol/l eingehalten werden, das Verhalten besserte sich und auch die Lebensqualität, da die Ernährung weniger reglementiert werden muss.
Die bei Patienten mit Phenylketonurie in hoher Konzentration im Blut vorliegende Aminosäure L-Phenylalanin wird durch den neuen Wirkstoff Pegvaliase zu Zimtsäure und Ammoniak abgebaut. Es handelt sich um das rekombinante bakterielle Enzym Phenylalanin-Ammoniak-Lyase (rAvPAL), das aufgrund einer Pegylierung länger im Organismus verbleibt. Somit wird eine andauernde und gleichmäßige Aufrechterhaltung von reduzierten Phenylalanin-Werten zwischen 120 und 600 µmol/l Blut ermöglicht. Ebenso verbessern sich Aufmerksamkeit, Stimmung und Lebensqualität der Patienten.
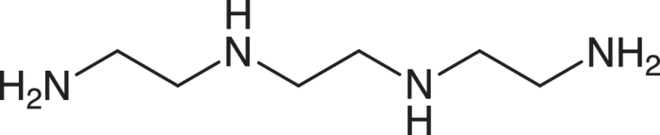
Trientin
Der Kupfer-Chelatbildner Trientin (Cuprior®) wird zur Behandlung der genetisch bedingten Kupfer-Speicherkrankheit Morbus Wilson eingesetzt, bei der es zur Ablagerung von Kupfer-Ionen in verschiedenen Organe und zu Leberfunktionsstörungen und neurologischen Defiziten kommt. Die Substanz ist derzeit für Patienten mit Unverträglichkeit gegen den weiteren Chelatbildner D-Penicillamin zugelassen und ermöglicht ein weitgehend normales Leben mit guter Prognose. Über die vier im Molekül enthaltenen Aminogruppen kommt es mit resorbierten Kupfer-Ionen zur Bildung eines stabilen Komplexes, der leicht mit dem Urin ausgeschieden werden kann. Von einer Innovation oder einem therapeutischen Fortschritt kann jedoch nicht gesprochen werden. Die Substanz ist bereits seit 1985 als Dihydrochlorid (Syprine®) in der EU zugelassen. Für Morbus-Wilson-Patienten mit Unverträglichkeit gegen D-Penicillamin wird sie seit Jahrzehnten aus England importiert. Ein gewisser Vorteil für Cuprior® besteht darin, dass es nicht gekühlt gelagert werden muss. Direkte vergleichende Studien zur Sicherheit und Wirksamkeit der beiden Chelatbildner Trientin und D-Penicillamin liegen nicht vor.
Antivirale Mittel zur systemischen Anwendung
Doravirin
Für Erwachsene, die mit dem humanen Immundefizienzvirus 1 (HIV-1) infiziert sind, wurde ein neuer nicht-nucleosidischer Reverse-Transkriptase-Inhibitor (NNRTI) Doravirin (Pifeltro®) eingeführt. Die Substanz wird in Kombination mit anderen antiretroviralen Arzneimitteln eingesetzt. Das Pyridinon Doravirin hemmt die reverse Transkriptase des HI-Virus 1, so dass die Virus-Replikation nicht stattfinden kann. Der therapeutische Stellenwert des von Doravirin kann derzeit nur sehr eingeschränkt beurteilt werden, möglicherweise gibt es einen Vorteil bei der Behandlung von HIV-1-Stämmen mit Resistenz gegen herkömmliche nicht-nucleosidische Reverse-Transkriptase-Inhibitoren.
Sonstige Antithrombotika
Caplacizumab
Der bivalente kleine Antikörper Caplacizumab (Cablivi®) stellt einen erheblichen Fortschritt dar. Mit ihm können Erwachsene mit erworbener thrombotisch-thrombozytopenischer Purpura (acquired thrombotic thrombocytopenic purpura, aTTP) behandelt werden. Durch mikrovaskuläre Thrombosen führt die Erkrankung zu Multiorgan-Ischämien mit lebensbedrohlichen Komplikationen. Der Wirkstoff ist der erste speziell für die Behandlung von aTTP zugelassene Arzneimittel mit völlig neuem Wirkmechanismus. In klinischen Studien, bei denen die Patienten den bivalenten kleinen Antikörper zusätzlich zur üblichen Standardtherapie erhielten, konnte eine signifikant verkürzte Erholungszeit der Thrombozyten-Zahlen erreicht werden. Außerdem waren deutlich weniger Plasmapherese-Tage erforderlich, und es kam zu kürzeren Krankenhausaufenthalten und weniger Todesfällen. Caplacizumab besteht aus zwei identischen humanisierten Bausteinen, die gentechnisch durch einen 3-Alanin-Linker verbunden sind. Er zielt auf die A1-Domäne des Von-Willebrand-Faktors und hemmt vollständig die Von-Willebrand-Faktor-vermittelte Thrombozytenadhäsion, es kommt zu einer schnellen Normalisierung der Thrombozyten-Spiegel.
β-Lactam-Antibiotika, Penicilline
Temocillin
Temocillin (Temopen®), ein 6-α-Methoxyderivat von Ticarcillin, ist ein bakterizid wirkendes Antibiotikum mit schmalem Wirkungsspektrum. Die bakterizide Wirkung der Substanz ist gegen die meisten aeroben gramnegativen Keime mit Ausnahme von Pseudomonas aeruginosa und Acinetobacter gerichtet. Komplizierte Harnwegsinfektionen, Bakteriämien, Infektionen der unteren Atemwege und Wundinfektionen, die sehr wahrscheinlich durch gramnegative Bakterien verursacht wurden, können gezielt mit dem Schmalspektrum-Penicillin Temocillin behandelt werden. Die Substanz ist bei Erwachsenen und Kindern einsetzbar und wird intravenös oder intramuskulär verabreicht. Durch Temocillin als Alternative zu Carbapenemen kann die Anwendung von diesen wichtigen Reserveantibiotika häufig vermieden werden.
Antihämorrhagika
Damoctocog alfa pegol und Turoctocog alfa pegol
Zur Substitutionstherapie bei Hämophilie A (angeborener Faktor-VIII-Mangel, Bluterkrankheit) zur Behandlung und Prophylaxe von Blutungen bei Erwachsenen und Kindern wurden zwei Wirkstoffe eingeführt. Beide Zubereitungen werden nicht als relevanter therapeutischer Fortschritt eingestuft. Sie werden zwar mit gentechnischen Methoden hergestellt, sodass im Vergleich zu bisher aus menschlichem Plasma gewonnenen Präparaten kein Restrisiko bezüglich der Übertragung von Infektionserkrankungen wie Hepatitis oder HIV mehr besteht. Allerdings erfolgt die Produktion mithilfe von Hamster-Zelllinien, was mit der Gefahr von verstärkten Überempfindlichkeitsreaktionen assoziiert ist. Bei Damoctocog alfa pegol (Jivi®) und Turoctocog alfa pegol (Esperoct®) wurde eine Verlängerung der Eliminationshalbwertszeit durch die Pegylierung erreicht.
Vonicog alfa
Bei Patienten mit Von-Willebrand-Syndrom kann es aufgrund eines Mangels des Von-Willebrand-Faktors bereits bei kleinen Verletzungen oder Operationen zu verstärkten und länger andauernden Blutungen kommen. Die Prävalenz dieser vererbten Blutungskrankheit liegt bei 800 pro 100.000 Menschen, wobei allerdings nur 12,5 von 100.000 signifikante Symptome aufweisen. Der Von-Willebrand-Faktor spielt als Trägerprotein des Blutgerinnungsfaktors VIII eine wichtige Rolle bei der plasmatischen Hämostase. Er schützt den Faktor VIII vor vorzeitigem Abbau, sodass stets eine ausreichende Menge verfügbar ist. Für die Akut- und Langzeitbehandlung von Patienten mit schwerem Von-Willebrand-Syndrom besteht ein erheblicher therapeutischer Bedarf. Der rekombinante humane Von-Willebrand-Faktor Vonicog alfa (Veyvondi®) ist die erste, speziell für Menschen mit Von-Willebrand-Syndrom entwickelte, rekombinante humane VWF-Zubereitung und gilt als relevanter Fortschritt. Er ersetzt den fehlenden endogenen Gerinnungsfaktor und kann sowohl zur Blutstillung bei akuten Blutungen als auch zur Behandlung und Vorbeugung von Blutungen im Rahmen von Operationen eingesetzt werden. Vonicog alfa ist indiziert, wenn eine Behandlung mit Desmopressin allein nicht wirksam ist oder eine Kontraindikation besteht.
Sonstige hämatologische Mittel, Mittel zur Behandlung des hereditären Angioödems
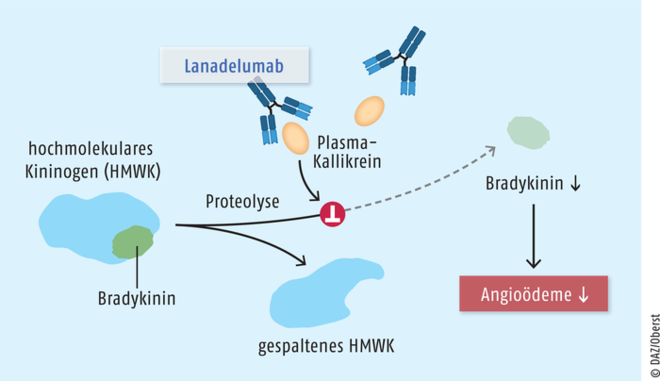
Lanadelumab
Der neue humane monoklonale Antikörper Lanadelumab (Takhzyro®) wird zur routinemäßigen Prophylaxe von wiederkehrenden Attacken des hereditären Angioödems (hereditary angioedema, HAE) angewendet. Das ist eine selten vorkommende, autosomal-dominant vererbte Erkrankung, von der in Deutschland etwa 1600 Patienten betroffen sind. Erste Symptome treten meist noch vor dem 20. Lebensjahr auf. Die akuten Attacken gehen häufig mit entstellenden Haut- sowie schmerzhaften gastrointestinalen Ödemen einher. Sie treten in der Regel mehrmals pro Monat auf und halten mehrere Tage an. Durch eine subkutane Applikation von Lanadelumab alle zwei bis vier Wochen kann die Anfallshäufigkeit hochsignifikant reduziert werden, was für HAE-Patienten ein bedeutender therapeutischer Fortschritt ist.
Das Peptidhormon Bradykinin wird im Körper durch Kallikrein proteolytisch aus hochmolekularen Kininogenen (high molecular weight kininogens, HMWK) freigesetzt. Der spezifisch gegen die Serinprotease Plasma-Kallikrein gerichtete monoklonale Antikörper Lanadelumab hemmt die proteolytische Aktivität des Enzyms. Bei längerfristiger prophylaktischer Anwendung kann bei Patienten mit hereditärem Angioödem (HAE) und somit verstärkter Bradykinin-Biosynthese das Auftreten von mit Schwellungen und Schmerzen assoziierten HAE-Attacken vermindert werden.
Endokrine Therapie, Antiandrogene
Apalutamid
Für die Behandlung von Männern mit nicht-metastasiertem Kastrations-resistentem Prostatakarzinom wurde der selektive Androgenrezeptor-Inhibitor Apalutamid (Erleada®) eingeführt. Die oral applizierbare Substanz ist bei hohem Risiko für die Entwicklung von Metastasen indiziert und bewirkt eine signifikante Verlängerung des Metastasen-freien Überlebens. Das nichtsteroidale Antiandrogen hat eine hohe Affinität zur Liganden-bindenden Domäne des Androgenrezeptors, es kommt zu einer Hemmung der Einwanderung des aktivierten Rezeptors in den Zellkern. Auch die nachgeschalteten Prozesse wie die Bindung dieses Transkriptionsfaktors an die DNA und die Androgenrezeptor-vermittelte Transkription der zugehörigen Gene werden unterbunden. Insgesamt wird durch Apalutamid die Androgen-assoziierte Proteinbiosynthese effektiv abgeschaltet. Ein relevanter therapeutischer Fortschritt ist Apalutamid aber nicht, bereits seit 2013 ist Enzalutamid mit identischem Wirkmechanismus verfügbar.
Andere Mittel für das Nervensystem
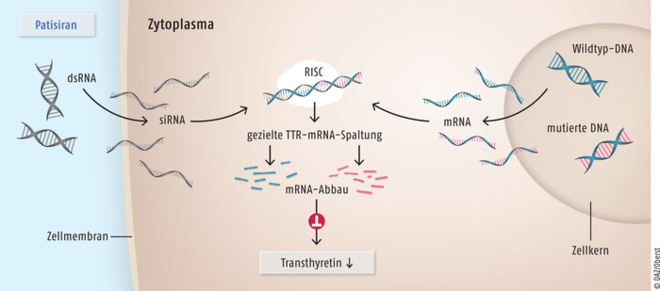
Patisiran
Bei der hereditären Transthyretin(TTR)-vermittelten Amyloidose (hATTR) kommt es zu irreversible Proteinablagerungen im Nervensystem, Herzen, Gastrointestinaltrakt, Knochenmark sowie in Augen, Nieren und Schilddrüse. Damit verbunden sind starke Beeinträchtigungen, die innerhalb einiger Jahre meist zu Multiorganversagen und Tod führen. Bis vor Kurzem stand für die Behandlung fortgeschrittener Organstörungen keine Therapieoption zur Verfügung. Dann wurde das Oligonucleotid Inotersen zur Behandlung von Polyneuropathien der Stadien 1 oder 2 bei erwachsenen hATTR-Patienten zugelassen. Das galt bereits als ein großer therapeutischer Fortschritt, denn es gelang, die Erkrankungsprogression signifikant zu verlangsamen. Kurz danach wurde für diese Erkrankung die doppelsträngige, kleine interferierende Ribonukleinsäure Patisiran (Onpattro®) eingeführt. Der RNA-Interferenz(RNAi)- oder auch small interfering RNA(siRNA)-Wirkstoff hat einen völlig innovativen Wirkmechanismus. Erstmals wird gezielt eine komplette Gensequenz eines pathogenen Proteins abgeschaltet. Der Effekt wird durch in der Zubereitung enthaltene Lipid-Nanopartikel verstärkt, die Patisiran zu den Hepatozyten transportieren, dem primären TTR-Biosyntheseort. Als Folge wird die Transthyretin-Bildung langfristig um mehr als 80% verringert, sodass die Ablagerung von pathogenen Amyloiden reduziert und das Fortschreiten der Krankheit gestoppt oder zumindest verlangsamt wird. Während Inotersen in klinischen Studien lediglich das Fortschreiten der Amyloidose verminderte, wurde nach Applikation von Patisiran außerdem eine Verbesserung der Symptomatik erreicht. Patisiran ist derzeit für Erwachsene im ersten oder zweiten Stadium der Nervenschädigung zugelassen, die noch mit oder ohne Hilfe gehfähig sind.
Patisiran, eine doppelsträngige, kurze interferierende Ribonukleinsäure (dsRNA, links) wird im Zellinneren gespalten. Im Zytoplasma bindet die nun einsträngige kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA) hochselektiv an einen Protein-Komplex, der als RISC (RNA-induced Silencing Complex) bezeichnet wird (Mitte). Der RIS-Komplex erkennt die mRNA von mutiertem ebenso wie von normalem Wildtyp-Transthyretin (TTR) (rechts), die komplementäre Abschnitte zur siRNA besitzt. Als Folge wird das betreffende Gen stillgelegt und die TTR-mRNA im weiteren Verlauf mithilfe des RIS-Proteinkomplexes zerstört. Das RNA-Interferenz(RNAi)-Therapeutikum Patisiran imitiert einen körpereigenen Abwehrmechanismus, der normalerweise gegen RNA-Viren gerichtet ist. Bei Patienten mit hereditärer Transthyretin-vermittelter Amyloidose (hATTR) wird auf diese Weise die Produktion fehlgebildeter TTR-Proteine reduziert und die Symptomatik der Erkrankung gelindert.
Anthrax-Impfstoffe
Anthrax-Antigen
Für Erwachsene, die aufgrund ihres Berufs oder anderer Aktivitäten ein erhöhtes Risiko einer Ansteckung mit dem Milzbrand-Bakterium tragen, wurde der Impfstoff BioThrax® eingeführt. Das Anthrax-Antigen dient zur aktiven Immunisierung und somit zur Prävention, denn nach vollständiger Immunisierung besteht ein praktisch vollständiger Schutz vor einer Infektion. Sporen des grampositiven, aeroben, stäbchenförmigen Milzbrand-Erregers Bacillus anthracis kommen weltweit als Umweltkeime im Erdboden vor. Auch in Europa treten immer wieder Fälle von Milzbrand auf, in Deutschland letztmals 1994 ein Patient mit Hautmilzbrand. Weitaus gefährlicher ist die Tatsache, dass der Einsatz von Bacillus anthracis im Rahmen von Biowaffenprogrammen erforscht wird. In diesem Zusammenhang kam es immer wieder zu Todesfällen, insbesondere durch Lungenmilzbrand. Betroffen waren nicht nur Opfer von Anschlägen, sondern auch Soldaten und Personen, die sich als Forscher mit der Abwehr von Bacillus-anthracis-Angriffen befassten.
Andere Mittel für den Respirationstrakt
Tezacaftor
Bei Patienten mit zystischer Fibrose (Mukoviszidose) kann durch die kombinierte Anwendung des CFTR(Zystische-Fibrose-Transmembran-Regulatorprotein)-Korrektors Tezacaftor und des CFTR-Potenziators Ivacaftor eine Stabilisierung der Lungenfunktion erreicht werden. Das neue Kombinationspräparat Symkevi® gilt als therapeutischer Fortschritt. Es ist für Patienten ab zwölf Jahren mit homozygoter F508del-CFTR-Genmutation oder heterozygoter F508del-Mutation und bestimmten weiteren CFTR-Gen-Mutationen zugelassen und damit für sehr viele Mukoviszidose-Patienten eine neue Behandlungsoption. In klinischen Studien trat die Verbesserung der Lungenfunktion frühzeitig ein und hielt während der gesamten Versuchsdauer an. Das CFTR-Protein ist ein in der Zytoplasmamembran von Epithelzellen lokalisierter ABC-Transporter. Es bildet einen sekretorischen Chlorid-Kanal mit zwei membrandurchspannenden Untereinheiten. Bei der zystischen Fibrose stören Mutationen die zelluläre Verarbeitung, Faltung und Transportsteuerung beim CFTR-Protein. Durch den resultierenden geringen Chlorid-Ionen-Ausstrom wird die Viskosität der pulmonalen und pankreatischen Sekrete stark erhöht, es kommt zu einer verschlechterten Lungenfunktion mit erhöhter Anfälligkeit für Atemwegsinfektionen. Insbesondere die fortschreitende Schädigung der Lunge führt zu einem frühen Tod.
Immunstimulanzien, Interferone
Ropeginterferon alfa-2b
Für die Behandlung von Patienten mit einer Polycythaemia vera ohne symptomatische Splenomegalie wurde Ropeginterferon alfa-2b (Besremi®) eingeführt. Es ist derzeit das einzige Interferon-Präparat, das zur Behandlung der Polycythaemia vera zugelassen ist, und wird alle zwei bis vier Wochen als Monotherapeutikum eingesetzt. Es führt zu einer Normalisierung der Erythrozyten-Zahlen, zur Verbesserung der Lebensqualität und zu einer Verzögerung des Krankheitsverlaufs. Ropeginterferon alfa-2b ist ein rekombinantes Interferon alfa-2b, das mit einem zweiarmigen Methoxypolyethylenglycol konjugiert ist. Die Wirkungen beruhen auf einer Bindung an den transmembranären Interferon-alfa-Rezeptor (IFNAR). Es kommt in der nachgeschalteten Signalkaskade zur Aktivierung von Kinasen, insbesondere von Januskinasen 1 (JAK1), Tyrosinkinasen 2 (TYK2) und von Transkriptionsaktivator(STAT)-Proteinen. Ropeginterferon alfa-2b hemmt somit die Proliferation von hämatopoetischen Zellen und Fibroblasten-Vorläuferzellen im Knochenmark und antagonisiert die Wirkung von Wachstumsfaktoren und anderen Zytokinen, die eine Rolle bei der Entwicklung einer Myelofibrose spielen.
Immunsuppressiva
Ravulizumab
Erwachsene mit paroxysmaler nächtlicher Hämoglobinurie (PNH) können mit dem neuen Wirkstoff Ravulizumab (Ultomiris®) behandelt werden. Der langwirksame, monoklonale, rekombinant hergestellte IgG2/4K-Antikörper ist spezifisch gegen das Komplementprotein C5 gerichtet und für PNH-Patienten mit hoher Erkrankungsaktivität vorgesehen. Die Spaltung von C5 in C5a, das proinflammatorische Anaphylatoxin, und C5b, die initiierende Untereinheit des terminalen zytotoxischen Komplementkomplexes C5b bis C9 (Membranangriffskomplex), wird verhindert. Somit kann bei PNH-Patienten die Schädigung von ungeschützten Blutzellen vermindert werden. Durch die Therapie wird die Hämolyse-Tendenz reduziert, zugleich sinkt die Notwendigkeit von Bluttransfusionen. Der C5-Inhibitor Ravulizumab ist für die Betroffenen durchaus als therapeutischer Fortschritt einzuschätzen. Der Wirkmechanismus ist zwar nicht innovativ, da mit Eculizumab bereits seit 2003 ein weiterer C5-Antikörper mit ähnlichem Sicherheitsprofil zur PNH-Behandlung verfügbar ist. Allerdings hat sich die neuere Substanz in klinischen Studien als mindestens gleichwertig erwiesen. Möglicherweise könnten weitere Studien sogar eine Überlegenheit nachweisen. Ein Vorteil von Ravulizumab ist in jedem Fall, dass er aufgrund der wesentlich länger anhaltenden C5-Inhibition nur alle acht Wochen appliziert werden muss.
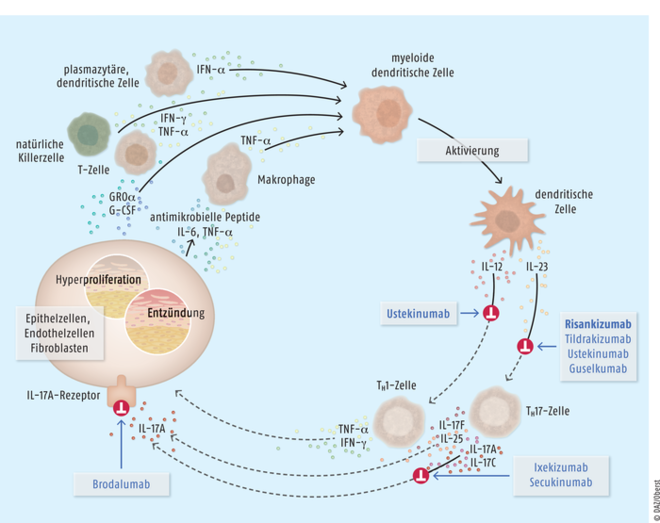
Tildrakizumab und Risankizumab
Interleukin 23 (IL-23) ist neben den Interleukinen 12 und 17 maßgeblich an Entzündungs- und Immunreaktionen im Rahmen der Psoriasis-Pathogenese beteiligt. Es beeinflusst die Differenzierung, Proliferation und das Überleben bestimmter T-Zell-Subpopulationen, wie z. B. TH17- und TC17-Zellen, sowie von unspezifischen lymphoiden Immunzellen, die wiederum proinflammatorische Effektor-Zytokine wie IL-17A, IL-17F und IL-22 produzieren. In der Haut von Patienten mit Plaque-Psoriasis werden erhöhte IL-23-Spiegel vorgefunden. Die monoklonalen Antikörper Tildrakizumab und Risankizumab sind spezifisch gegen Interleukin 23 gerichtet. Tildrakizumab (Ilumetri®) kann als Erstlinien-Therapeutikum bei Erwachsenen mit mittelschwerer bis schwerer Plaque-Psoriasis eingesetzt werden, die für eine systemische Therapie infrage kommen. Der rekombinant hergestellte, humanisierte monoklonale IgG1/κ-Antikörper wird subkutan appliziert und wirkt über eine Hemmung des IL-23-Zytokinwegs entzündungshemmend und immunsuppressiv. Bei den Patienten wird über die Hemmung der Autoimmunreaktion eine Reduktion der Entzündungs- und Proliferationsvorgänge erreicht. Tildrakizumab war nach Guselkumab der zweite, selektiv gegen Interleukin 23 gerichtete Antikörper und stellt keinen relevanten therapeutischen Fortschritt dar. In klinischen Studien erwies sich die gut verträgliche Substanz zwar dem TNF-α-Blocker Etanercept als signifikant überlegen.
Risankizumab und Tildrakizumab hemmen als spezifischer Interleukin-23(IL-23)-Antikörper die Induktion von Entzündungen und Proliferationen, indem das Andocken von IL-23 an bestimmten T-Zell-Subpopulationen wie TH17- und TC17-Zellen unterbunden wird, die Tumornekrosefaktor-α(TNF-α)-vermittelt Entzündungs- und Immunreaktionen im Rahmen der Psoriasis-Pathogenese triggern. Als Folge kommt es zu einer relevanten Verbesserung der Erkrankungssymptomatik.
Auch der Interleukin-23-Inhibitor Risankizumab ist nach derzeitigem Kenntnisstand kein relevanter therapeutischer Fortschritt. In klinischen Studien erwies sich die Substanz zwar dem IL-12/23-Antikörper Ustekinumab und dem TNF-α-Blocker Adalimumab als überlegen. Allerdings konnten bereits mit den beiden IL-23-Antikörpern Guselkumab und Tildrakizumab ähnlich gute Resultate erreicht werden. Direkte vergleichende Untersuchungen zu diesen Antikörpern untereinander liegen noch nicht vor. Aktuell laufen vergleichende Studien mit dem Interleukin-17A-Antikörper Secukinumab und dem Folsäure-Antagonisten Methotrexat bei der Behandlung der Psoriasis. Auch wird der Nutzen von Risankizumab bei Psoriasis-Arthritis, Spondylitis ankylosans, Colitis ulcerosa, Morbus Crohn oder schwerem Asthma bronchiale geprüft. |
Substanz | Handelsname | Gruppe | Hersteller/Vertrieb | Einführungsdatum | NA Nr.-Jahr |
|---|---|---|---|---|---|
Abemaciclib | Verzenios® | antineoplastische Arzneimittel, Proteinkinase-Inhibitoren | Lilly Deutschland GmbH | 1. November 2018 | 3-19 |
Andexanet alfa | Ondexxya® | Antidote | Portola Netherlands B.V. (NL) | 1. September 2019 | 11-19 |
Anthrax-Vakzine | BioThrax® | Anthrax-Impfstoffe | Emergent Sales and Marketing Germany GmbH | 1. Mai 2019 | 7-19 |
Apalutamid | Erleada® | endokrine Therapie, Antiandrogene | Janssen-Cilag GmbH | 1. Februar 2019 | 5-19 |
Binimetinib | Mektovi® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Pierre Fabre Médicament (F) | 15. Oktober 2018 | 1-19 |
Brigatinib | Alunbrig® | andere antineoplastische Mittel, Proteinkinase-Inhibitoren | Takeda GmbH | 15. Januar 2019 | 4-19 |
Caplacizumab | Cablivi® | sonstige Antithrombotika | Sanofi-Aventis-Deutschland GmbH | 1. Oktober 2018 | 3-19 |
Cemiplimab | Libtayo® | antineoplastische Mittel, monoklonale Antikörper | Sanofi-Aventis Deutschland GmbH | 1. August 2019 | 10-19 |
Chlormethin | Ledaga® | antineoplastische Mittel, Stickstofflost-Analoga | Recordati Rare Diseases Germany GmbH | 15. Mai 2019 | 8-19 |
Dacomitinib | Vizimprov® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Pfizer Pharma GmbH | 1. Mai 2019 | 7-19 |
Damoctocog alfa pegol | Jivi® | Antihämorrhagika; Blutgerinnungsfaktor VIII | Bayer Vital Pharma | 1. Januar 2019 | 6-19 |
Doravirin | Pifeltro® | antivirale Mittel zur systemischen Anwendung | MSD Sharp & Dohme GmbH | 15. Januar 2019 | 4-19 |
Durvalumab | Imfinzi® | antineoplastische Mittel, monoklonale Antikörper | AstraZeneca GmbH | 15. Oktober 2018 | 1-19 |
Encorafenib | Braftovi® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Pierre Fabre Pharma GmbH | 15. Oktober 2018 | 1-19 |
Erenumab | Aimovig® | Analgetika, Migränemittel | Novartis Pharma GmbH | 1. November 2018 | 1-19 |
Fremanezumab | Ajovy® | Analgetika, andere Migränemittel | Teva GmbH | 15. Mai 2019 | 9-19 |
Galcanezumab | Emgality® | Analgetika, andere Migränemittel | Lilly Deutschland GmbH | 1. April 2019 | 6-19 |
Lanadelumab | Takhzyro® | sonstige hämatologische Mittel, Mittel zur Behandlung des hereditären Angioödems | Shire Deutschland GmbH | 1. Februar 2019 | 5-19 |
Larotrectinib | Vitrakvi® | antineoplastische und immunmodulierende Mittel, antineoplastische Mittel, Proteinkinase-Inhibitoren | Bayer Vital GmbH | 15. Oktober 2019 | 12-19 |
Lorlatinib | Lorviqua® | antineoplastische Mittel, Proteinkinase-Inhibitoren | Pfizer Pharma GmbH | 1. Juni 2019 | 8-19 |
Patisiran | Onpattro® | andere Mittel für das Nervensystem | Alnylam Netherlands B.V. (NL) | 1. Oktober 2018 | 2-19 |
Pegvaliase | Palynziq® | andere Mittel für das alimentäre System und den Stoffwechsel, Enzyme | Biomarin International Ltd., (Irland) | 1. Juli 2019 | 9-19 |
Ravulizumab | Ultomiris® | Immunsuppressiva, selektive Immunsuppressiva | Alexion Pharma Germany GmbH | 1. August 2019 | 11-19 |
Risankizumab | Skyrizi® | Immunsuppressiva,Interleukin-Inhibitoren | AbbVie Deutschland GmbH | 1. Juni 2019 | 8-19 |
Ropeginterferon alfa-2b | Besremi® | Immunstimulanzien, Interferone | AOP Orphan Pharmaceuticals (A) | 15. September 2019 | 11-19 |
Rucaparib | Rubraca® | andere antineoplastische Wirkstoffe | Clovis Oncology Germany GmbH | 1. März 2019 | 5-19 |
Streptozocin | Zanosar® | antineoplastische Mittel, Nitrosoharnstoffe | Riemser Pharma GmbH | 1. November 2018 | 2-19 |
Temocillin | Temopen® | β-Lactam-Antibiotika, Penicilline | Eumedica Pharmaceuticals GmbH | 1. Oktober 2019 | 12-19 |
Tezacaftor | Symkevi® | andere Mittel für den Respirationstrakt | Vertex Pharmaceuticals Deutschland GmbH | 1. Dezember 2018 | 3-19 |
Tildrakizumab | Ilumetri® | Immunsuppressiva, Interleukin-Inhibitoren | Almirall Hermal GmbH | 15. November 2018 | 2-19 |
Trientin | Cuprior® | andere Mittel für das alimentäre System und den Stoffwechsel, sonstige Mittel für das alimentäre System und den Stoffwechsel | GMP-Orphan SA (F) | 1. Oktober 2018 | 3-19 |
Turoctocog alfa pegol | Esperoct® | Antihämorrhagika, Blutgerinnungsfaktor VIII | Novo Nordisk Pharma GmbH | 1. August 2019 | 10-19 |
Vestronidase alfa | Mepsevii® | andere Mittel für das alimentäre System und Stoffwechsel, Enzyme | Ultragenyx Germany | 1. Oktober 2018 | 2-19 |
Volanesorsen | Waylivra® | noch nicht festgelegt | Akcea Therapeutics Germany GmbH | 15. August 2019 | 10-19 |
Vonicog alfa | Veyvondi® | Antihämorrhagika,Blutgerinnungsfaktor Von-Willebrand-Faktor | Shire Deutschland GmbH | 15. Januar 2019 | 4-19 |
Voretigen Neparvovec | Luxturna® | Ophthalmika, andere Ophthalmika | Novartis Pharma GmbH | 15. April 2019 | 7-19 |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.