
- DAZ.online
- DAZ / AZ
- DAZ 52/2021
- Verunreinigte Sartane, ...
Therapien im Gespräch
Verunreinigte Sartane, auch 2021 ein Problem
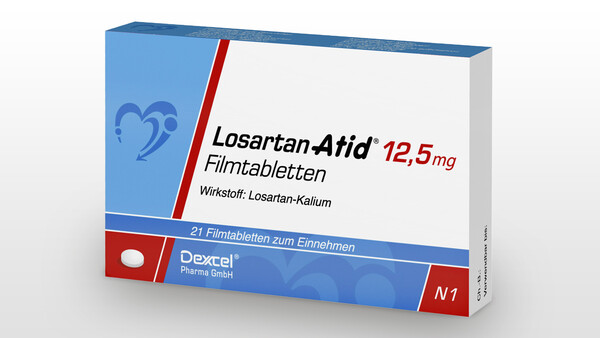
Azido-Verunreinigungen zwangen vor allem Losartan-Hersteller zu Rückrufen
So hatte das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) das vorläufige Ruhen aller Zulassungen von Ranitidin-haltigen Arzneimitteln bis zum 2. Januar 2023 angeordnet. Zuvor waren in Ranitidin-haltigen Arzneimitteln Spuren von N-Nitrosodimethylamin (NDMA) gefunden worden, die über den empfohlenen Grenzwerten des ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) lagen.
Nitrosamine in Ranitidin, auch ein Lagerungsproblem
Allerdings steht im Falle von Ranitidin nicht nur die Synthese im Verdacht. Da mit zunehmender Lagerung auch die Konzentrationen von NDMA stiegen, wird davon ausgegangen, dass Abbauprozesse ebenso zur Nitrosaminbildung führen können wie auch endogene Prozesse nach Applikation. Zulassungsinhaber sind angehalten, hier für Klärung zu sorgen. Das Ruhen der Zulassung ist zunächst zeitlich befristet und kann durch entsprechende Angaben der Zulassungsinhaber vorzeitig aufgehoben werden.
Neues Problem: Azido-Verunreinigungen in Sartanen
Doch was hatte es mit den Azido-Verunreinigungen in den Sartanen auf sich? Wie Buschmann und Holzgrabe in DAZ 41, S. 60 ff., ausführten, entstehen solche Verunreinigungen beim Aufbau des Biphenyl-Tetrazoloyl-Bausteins, der nicht nur in Losartan, Valsartan und Irbesartan zu finden ist, sondern er ist auch in Candesartan und Olmesartan enthalten. Im April 2021 hatte die Coordination Group for Mutual Recognition and Decentralised Procedures die Zulassungsinhaber Sartan-haltiger Arzneimittel über den Nachweis von AZBT (5-(4’-(Azidomethyl)-[1,1’-biphenyl]-2yl)-1H-tetrazol) unterrichtet und auf das mutagene Potenzial dieser Verunreinigung hingewiesen. In der Schweiz waren schon im November 2020 einzelne Irbesartan-Chargen mit AZBT-Verunreinigungen aufgefallen und zurückgerufen worden.
Syntheserouten liefern Erklärung
Buschmann und Holzgrabe kommen bei der Analyse der Syntheserouten der Sartane mit Biphenyl-Tetrazoloyl-Baustein zu dem Schluss, dass diese in der Regel sehr ähnlich hinsichtlich der eingesetzten Derivate und Zwischenprodukte verlaufen. Insbesondere bei Verwendung von Brom-PTBN könne mit verschiedenen Reagenzien das AZBT als Nebenprodukt gebildet werden. Die Wahrscheinlichkeit der AZBT-Bildung in vielen weiteren Syntheserouten, die über diesen Schlüsselbaustein verlaufen, schätzen Buschmann und Holzgrabe eher hoch als niedrig ein.
Im Herbst 2021 löste die Entdeckung einer weiteren Azido-Verunreinigung, diesmal 5-[4‘-[(5-(Azidomethyl)-2-butyl-4-chlor-1H-imidazol-1-yl)methyl]-[1,1‘-biphenyl]2-yl]-1H-tetrazol, eine Losartan-Rückrufwelle aus. Wie AZBT führte auch diese Substanz zu einem positiven Ergebnis im bakteriellen Mutagenitätstest (AMES).
Arzneibuchanalytik reicht nicht
Dass solche Verunreinigungen in immer kleineren Mengen detektiert werden, ist laut Buschmann und Holzgrabe nicht zuletzt verbesserten analytischen Methoden zu verdanken. Für zwei AZBT und ein weiteres Azid verweisen die Autoren auf neue LC-MS/MS-Methoden, die die Detektion ermöglicht haben. Für Buschmann und Holzgrabe ein weiterer Beleg dafür, dass die in den Arzneibüchern vorgeschriebenen HPLC-UV-Techniken für die Detektion kritischer Verunreinigungen wie Nitrosamine oder Azido-Verbindungen nicht ausreichen. Ihre Forderung: „Arzneistoffhersteller müssen bessere Kontrollstrategien für ihre Produktion entwickeln. Die Erstellung von Reaktionsmatrices und die Untersuchung der Endprodukte mittels empfindlicher LC/HRMS-Methoden sollte zum Standardrepertoire für das Risk Assessment werden!“ Und weiter: „Um den hohen Qualitätsstandard einer EDQM-Zertifizierung in Zukunft zu gewährleisten, müssen auch bestehende Zertifizierungen mit dem aktuellen Kenntnisstand vor Ablauf routinemäßig überprüft werden. Hier wäre es ratsam, für alle bestehenden Zertifizierungen mit dem heutigen Kenntnisstand eine erneute potenzielle Verunreinigungsanalyse durchzuführen, um die wahrscheinliche oder auch unwahrscheinliche Bildung von potenziell genotoxischen Verunreinigungen systematisch aufzudecken. ...Teure Rückrufaktionen könnte man im Vorfeld durch eine strengere und mehr fachkundige Kontrolle sicherlich deutlich begrenzen. Da es sich in diesem Fall sogar um eine genotoxische Verunreinigung handelt, ist dieser Appell nicht nur ein gut gemeinter Rat, sondern ein ‚Muss‘, um die Versorgung mit sicheren Arzneimitteln auch in Zukunft sicherzustellen. Immer häufiger werdende Pressemitteilungen von immer wieder neu identifizierten Verunreinigungen können nicht zum Standard in Europa werden.“ |



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.