
- DAZ.online
- News
- Pharmazie
- G-BA: „Nein“ zu ...
Kein Zusatznutzen bei malignem Melanom
G-BA: „Nein“ zu Nivolumab plus Ipilimumab
Bonn / Stuttgart - 11.12.2017, 16:20 Uhr
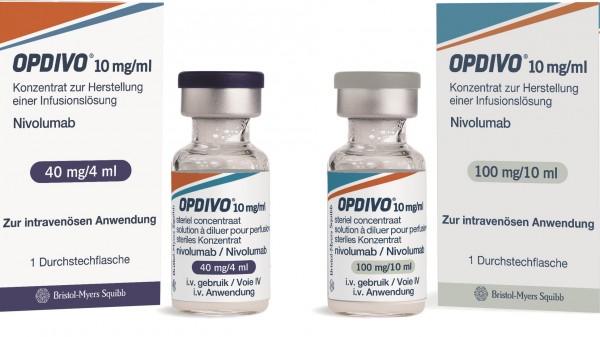
Laut G-BA birgt die Kombination der Checkpoint-Inhibitoren Nivolumab und Ipilimumab keinen Zusatznutzen bei malignem Melanom im Vergleich zur Nivolumab-Monotherapie. (Foto: B-MS)
Verursacht die Kombi mehr Nebenwirkungen?
Auch hinsichtlich des Nebenwirkungsprofils schneidet nach Einschätzung des G-BA die Kombi ungünstiger ab als die Monotherapie mit Nivolumab. Schwere unerwünschte Ereignisse, und Therapieabbrüche seien unter Nivolumab plus Ipilimumab häufiger. „Aufgrund des ausgeprägten Nebenwirkungspotenzials der Kombinationstherapie, bei gleichzeitiger Abwesenheit positiver Effekte, kann aus den vorliegenden Daten kein Zusatznutzen für eine Kombinationstherapie abgeleitet werden. Vor diesem Hintergrund wäre es gerechtfertigt, festzustellen, dass für Nivolumab in Kombination mit Ipilimumab ein Anhaltspunkt für einen geringeren Nutzen im Vergleich zu Nivolumab (Monotherapie) besteht.“
Bristol hält den G-BA auch in diesem Punkt für nicht hinreichend differenziert. Denn: B-MS habe Zusatzanalysen eingereicht, die zeigten, dass schwere unerwünschte Ereignisse vor allem in den ersten vier Zyklen der Kombinationstherapie auftraten. Allerdings gleiche sich mit Fortsetzen der Behandlung die Rate an schweren und schwerwiegenden unerwünschten Ereignissen derjenigen der Monotherapie an.
Kombi kostet 60.000 Euro mehr in der Melanom-Therapie
Der G-BA hat auch eine Kostenanalyse der beiden Therapieoptionen beim metastasierten oder nicht resezierbaren Melanom durchgeführt. Auch dieser Aspekt fließt in die Nutzenbewertung des G-BA ein. Die Jahrestherapiekosten einer Behandlung mit Nivolumab in der Monotherapie belaufen sich auf 77.921 Euro. Die Checkpoint-Inhibitor-Kombination veranschlagt der G-BA mit 137.969 Euro, also rund 60.000 Euro mehr pro Jahr.
IQWiG sah „Anhaltspunkt für geringeren Nutzen“
Der Bescheid des G-BA ist befristet, denn der Gemeinsame Bundesausschuss erachtet die eingereichten Daten von Bristol-Myers Squibb als unvollständig und somit nicht ausreichend, um eine abschließende Nutzenbewertung durchzuführen. Dieser befristete Bescheid betrifft auch ausschließlich die Therapie bei nicht vorbehandelten Patienten mit einem BRAF-V600-Wildtyp-Tumor. Der Zusatznutzen dieser Kombi wurde schon einmal untersucht: am 15. Dezember 2016 wurde der damalige Bescheid bis 15. Juni 2017 befristet. Der G-BA hatte dann das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) erneut mit der Bewertung des Zusatznutzens beauftragt. Die Nutzenbewertung des IQWiG war am 15. September 2017 abgeschlossen. Die Einschätzung des IQWiG lautete: „Anhaltspunkt für einen geringeren Nutzen“.
Bristol hat nun wieder Zeit, die – nach Ansicht des G-BA – fehlenden Daten nachzureichen. Der befristete Bescheid gilt bis 15. Juni 2018.



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.