
- DAZ.online
- News
- Spektrum
- Die FDA fand schon 2017 ...
Zhejiang Huahai Pharmaceutical
Die FDA fand schon 2017 eine unbekannte Verunreinigung beim Valsartan-Hersteller
Stuttgart - 07.09.2018, 07:00 Uhr
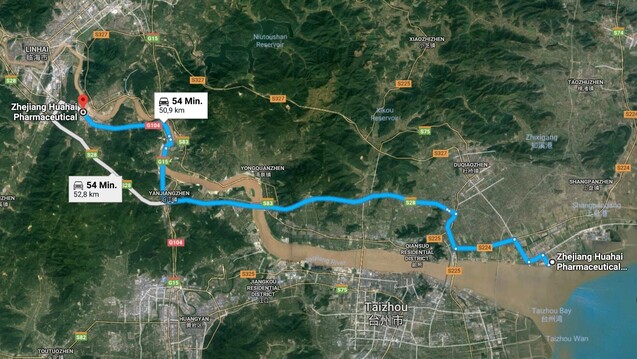
Zhejian Huahai Pharmaceutical besitzt zwei Herstellungsstandorte in direkter Nähe zueinander. (Foto: Screenshot / Google Maps)
Beobachtungen, die an den Fall Valsartan erinnern: „ghost peaks“
Ein weiteres Formular 483, das sich auf eine weitere Inspektion vom 15. bis 19. Mai 2017 bezieht, richtet sich auch an den Valsartan-Wirkstoffhersteller Zhejiang Huahai Pharmaceutical Co., Ltd., ist aber an eine andere Postleitzahl adressiert (317016, Standort an der Küste) als bei der Adresse, unter der das CEP beim EDQM hinterlegt ist. Die dort beobachteten Mängel erinnern jedoch an den Valsartan-Fall:
1. Beobachtung
„Anomalien bei analytischen Tests werden nicht untersucht.“ So seien bei der analytischen Prüfung eines Wirkstoffs die Tests so lange wiederholt worden, bis die gewünschten Ergebnisse erzielt wurden. Traten Verunreinigungen während der analytischen Tests auf, wurden diese nicht konsequent dokumentiert oder quantifiziert. So sei bei einer Analyse mittels Flüssigkeitschromatographie/Massenspektrometrie ein nicht identifizierter Ausschlag erschienen. Das Unternehmen habe diesen unbekannten Ausschlag (Peak) als „ghost peak“ bezeichnet, der von Zeit zu Zeit in den Chromatogrammen auftauche – warum, wisse man nicht. Jedoch soll der Peak der Verunreinigung erheblich größer ausgefallen sein, als der der eigentlichen Test-Substanz. Untersucht wurde die Angelegenheit nicht.
In einem weiteren Beispiel wird beschrieben, dass beim Test bestimmter Chargen ein Peak erschien, der mit dem Peak des eigentlichen Wirkstoffes verschmolz. Diese Verunreinigung wurde laut FDA einfach zum Peak des Wirkstoffs hinzugezählt. Auch dieser Fall wurde nicht weiter untersucht.
Mehr zum Thema

Mutmaßlich gefälschte Dokumentation
Droht der nächste chinesische Pharmaskandal?
2. Beobachtung
„Einrichtung und Ausstattung werden nicht
so instand gehalten, dass die Qualität der Produkte gesichert wird.“ Bei einer Vorrichtung, die ein Produkt für den US-Markt produzierte, beobachtete der FDA-Inspektor einen
kaputten Dichtungsring. Auf dessen Innenseite befand sich Staub und Farbe. Der Dichtungsring war ausgefranst. Ein
anderer Dichtungsring sei so heruntergekommen gewesen, dass Teile abgebrochen waren. Außerdem hatte er sich
braun verfärbt. Das inspizierte Gerät wurde im „sauberen Zustand“ geprüft.
In einer anderen Vorrichtung für den US-Markt wurde vermutlich Rost entdeckt. Für eine bestimmte Charge wurden „schwarze metallische Partikel“ vermerkt.
3. Beobachtung
„Die Nichtvalidierung von Ergebnissen außerhalb der Spezifikation wurde wissenschaftlich nicht ausreichend begründet.“ Hier ermahnt die FDA das Unternehmen erneut wegen der unbekannten Test-Ausschläge, der sogenannten „ghost peaks“. Mehrfach wurden unbekannte Verunreinigungen registriert. Einmal wurde ein solcher Peak mit einem „Laborfehler“ begründet.
Ein anderes Mal wurde Restlösungsmittel registriert. Man begründete diesen Fehler mit „Pollution“, also einer Verunreinigung aus der Umgebung, während der Probenvorbereitung. In einem weiteren Fall vermutete man als Grund für eine Verunreinigung einen Rückstand in der Säule. Bei näherer Nachfrage sprach das Unternehmen erneut von „ghost Peaks“.
Um welche Wirkstoffe es bei den beobachteten Mängeln geht, lässt sich nicht nachvollziehen. Dass aber gerade bei der Überwachung auf Verunreinigungen bei Zhejiang Huahai Pharmaceutical schon im Mai 2017 Missstände aufgefallen sind, scheint nicht von der Hand zu weisen zu sein.



























2 Kommentare
Die FDA fand schon 2017 eine unbekannte Verunreinigung beim Valsartan-Hersteller
von Dr. Christoph Sonntag am 07.09.2018 um 18:08 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Die FDA fand schon 2017 eine unbekannte Verunreinigung beim Valsartan-Hersteller
von Dr. Christoph Sonntag am 07.09.2018 um 17:59 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.