
- DAZ.online
- News
- Pharmazie
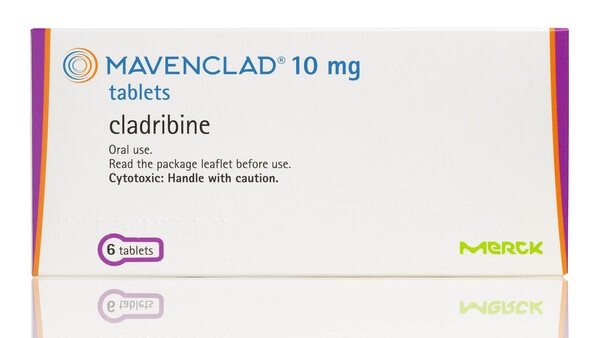
- Welche Therapien gibt es ...
Begrenzte Optionen
Welche Therapien gibt es für Kinder mit MS?
Stuttgart - 07.12.2018, 09:00 Uhr

3 bis 5 Prozent aller MS-Patienten erkranken im Kindes- oder Jugendalter, zugelassene therapeutische Optionen sind begrenzt. ( r / Foto: Africa Studio / stock.adobe.com)
Wieso sieht die EMA manchmal von pädiatrischen Studien ab?
Seit 2008 muss ein Hersteller für jedes neu in der EU zur Zulassung eingereichte Arzneimittel ein pädiatrisches Prüfkonzept (paediatric investigation plan, PIP) vorlegen. Ausgenommen sind lediglich Generika, Biosimilars, Homöopathika, traditionelle pflanzliche Arzneimittel oder Arzneimittel mit mindestens zehnjähriger allgemeiner medizinischer Verwendung in der EU. Ziel des PIP ist es, den im Bereich der Pädiatrie weit verbreiteten Off-Label-Use von Arzneimitteln einzudämmen beziehungsweise die Entwicklung von Kinderarzneimitteln zu fördern.
Thema: Autoimmunerkrankungen
Multiple Sklerose
Das pädiatrische Prüfkonzept ist „integraler Bestandteil“ der Zulassungsunterlagen,
fehlen diese Unterlagen bei Einreichung der Zulassung, wird der Antrag von der EMA als
unvollständig abgewiesen. Jedoch kann der pharmazeutische
Unternehmer von der Verpflichtung der Vorlage eines PIP freigestellt werden. Dies
ist der Fall – laut EU – wenn es Hinweise darauf gibt, dass
a) das spezifische Arzneimittel oder die Arzneimittelgruppe in Teilen oder in der Gesamtheit der pädiatrischen Bevölkerungsgruppe wahrscheinlich unwirksam oder bedenklich ist;
b) die Krankheit oder der Zustand, für den das betreffende Arzneimittel oder die betreffende Arzneimittelgruppe vorgesehen ist, lediglich bei Erwachsenen auftritt;
c) das fragliche Arzneimittel gegenüber bestehenden pädiatrischen Behandlungen keinen signifikanten therapeutischen Nutzen bietet.


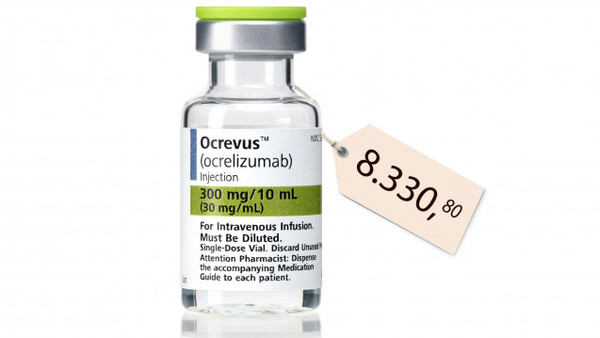




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.