
- DAZ.online
- News
- Pharmazie
- Der RNA dazwischenfunken...
Seltene Erbkrankheit
Der RNA dazwischenfunken: So wirkt Onpattro bei Transthyretin-Amyloidose
Berlin - 27.03.2019, 12:45 Uhr
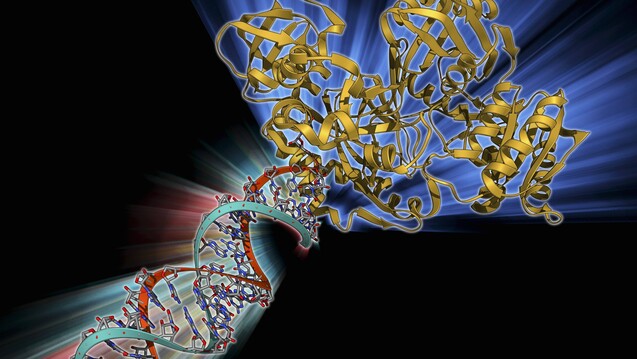
Kampf der Messenger-RNA: Der als RNA-Interferenz bezeichnete physiologische Prozess wird beim Wirkmechanismus von Onpattro ausgenutzt. Kleine RNA-Stücke stören die Ablesung der Messenger-RNA. (s / Foto: imago)
Am vergangenen Freitag veröffentlichte der Gemeinsame Bundesauschuss (G-BA) einige Beschlüsse zu neuen Arzneimitteln. Dabei gab es fünfmal die zweitbeste Note. Unter anderem für das RNA-Interferenz-Therapeutikum Onpattro®, das bei hereditärer Transthyretin-Amyloidose zugelassen ist – eine das Herz und Nervensystem schädigende Krankheit, mit einer Lebenserwartung von wenigen Jahren nach Diagnose.
Messenger-RNA, mach doch mal Pause! So ähnlich wirkt das neue Orphan Drug Onpattro®, das im August 2018 bei hereditärer Transthyretin vermittelter Amyloidose (hATTR) zugelassen wurde. Am vergangenen Freitag hatte der Gemeinsame Bundesauschuss (G-BA) dem neuen Medikament des niederländischen Pharmaunternehmens Alnylam einen beträchtlichen Zusatznutzen bescheinigt – die zweitbeste Note nach „erheblich“.
Bei der seltenen Erbkrankheit ist die Eiweißstruktur von Transthyretin, das Transportprotein für Thyroxin, durch Mutationen strukturell so verändert, dass es sich ablagert (Amyloidbildung). Diese krankhaften Eiweißablagerungen können die Organe schädigen. Besonders betroffen sind das periphere Nervensystem und das Herz. Im Verlauf der Erkrankung kommt es zu Kardiomyopathien und Neuropathien, die mit starken Beeinträchtigungen im Alltag einhergehen. Die Lebenserwartung eines Patienten liegt im Schnitt vom Zeitpunkt der Diagnose an bei wenigen Jahren. Weltweit sind etwa 50.000 Patienten von der Erkrankung betroffen.
RNA-Interferenz: Wirkmechanismus von der Natur abgeschaut
Der
Onpattro®-Wirkstoff Patisiran ist ein sogenanntes RNA-Interferenz-Therapeutikum, das der überschießenden Transthyretin-Bildung entgegenwirkt. Patisiran besteht aus kleinen RNA-Stücken (small interfering RNA), die
sich gegen die Messenger-RNA für das Transthyretin-Protein richten und diese
stumm schalten. Dadurch reduziert sich die Transthyrethin-Anreicherung, was
sich durch signifikante klinische Verbesserungen der neurologischen Symptome in
der Zulassungsstudie APOLLO mit 225 Patienten widerspiegelte. Der
Wirkmechanismus ist von der Natur abgeschaut. So ist die RNA-Interferenz ein
natürlicher Prozess der Genabschaltung.
Heimbehandlung nach drei Klinikanwendungen möglich
Onpattro® ist als Konzentrat zur Herstellung einer Infusionslösung auf dem Markt. Der Wirkstoff liegt in Lipid-Nanopartikeln verkapselt vor. Die Infusion soll alle drei Wochen erfolgen. Nachdem die Therapie in der Klinik von einem mit dem Krankheitsbild vertrautem Arzt eingeleitet wurde und der Patient drei Anwendungen nacheinander gut vertragen hat, kann die Behandlung auch zu Hause von medizinischem Fachpersonal weitergeführt werden. Hersteller Alnylam hat für die Heimbehandlung einige Verhaltensregeln für Patienten zusammengefasst.
Prämedikation gegen Nebenwirkungen
In Studien war Onpattro® sehr häufig mit infusionsbedingten Reaktionen verbunden, die sich unter anderem durch Schmerzen am ganzen Körper, Übelkeit oder Schwindelgefühle äußern. Deshalb erhält der Patient vor jeder Infusion eine Prämedikation, die aus einem intravenösen Corticosteroid, einem intravenösen H1- und einem intravenösen H2-Blocker, sowie einer Paracetamoltablette besteht.
Für Mitbewerber „Tegsedi“ Zusatznutzen „nicht quantifizierbar"
Am vergangenen Freitag hat der G-BA auch den Beschluss für ein weiteres Orphan Drug bei hereditärer Transthyretin vermittelter Amyloidose veröffentlicht. Und zwar für das Antisense-Oligonukleotid Inotersen (Tegsedi®) von Akcea Therapeutics, das an die Messenger-RNA bindet und die Translation des Transthyretin-Proteins hemmt.
Der G-BA betrachtet den Zuatznutzen von Tegsedi® als „nicht quantifizierbar“. In der Zulassungsstudie Neuro TTR seien fünf Todesfälle unter Inotersen und keiner unter Placebo aufgetreten. Da nicht abschätzbar sei, ob die Todesfälle auf das Medikament zurückzuführen sind, sei keine abschließende Bewertung möglich, schreibt der G-BA in seiner Begründung. An dieser Stelle ist anzumerken, dass andere Parameter wie etwa die Lebensqualität sich in der Studie unter der Behandlung signifikant verbessert hatten.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.