
- DAZ.online
- News
- Apotheke
- Weitere Sartan-...
Olmesartan/HCT Heumann
Weitere Sartan-Zulassungen ruhen
Stuttgart - 07.05.2020, 16:30 Uhr
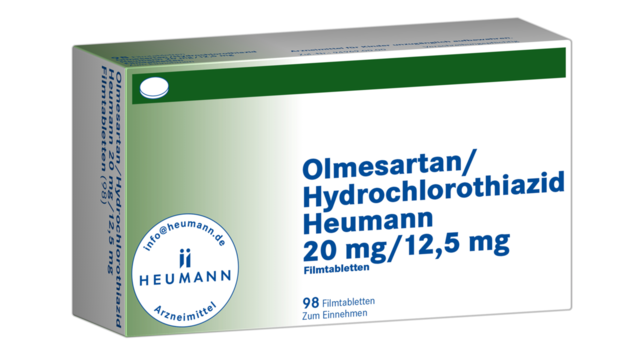
Das BfArM hatte für manche Sartane bereits im Februar das Ruhen der Zulassung angeordnet, nun kommen Olmesarten/HCT-Kombinationen von Heumann dazu. Die Hersteller sind den EU-Auflagen nicht nachgekommen, ihre Herstellungsverfahren zur Vermeidung nitrosaminhaltiger Verunreinigungen zu prüfen. (m / Foto: Heumann)
Das Bundesinstitut für Arzneimittel und Medizinprodukte hat für weitere sartanhaltige Arzneimittel das Ruhen der Zulassung angeordnet. Betroffen sind vier Olmesartan/Hydrochlorothiazid-Kombinationen von Heumann. Als Grund nennt das BfArM, dass der Hersteller die „vorgesehenen risikominimierenden Maßnahmen noch nicht oder nicht vollständig umgesetzt“ hat. Vorausgegangen war der Skandal um mit Nitrosaminen verunreinigte Sartane.
Mit Bescheid vom 4.Mai 2020 hat das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) das Ruhen der Zulassung von vier Sartan-Kombinationen angeordnet. Betroffen sind Olmesartan/Hydrochlorothiazid-Kombinationen von Heumann:
- Olmesartan/Hydrochlorothiazid Heumann 20 mg/12,5 mg Filmtabletten
- Olmesartan/Hydrochlorothiazid Heumann 20 mg/25 mg Filmtabletten
- Olmesartan/Hydrochlorothiazid Heumann 40 mg/12,5 mg Filmtabletten
- Olmesartan/Hydrochlorothiazid Heumann 40 mg/25 mg Filmtabletten
Mehr zum Thema

Candesartan, Irbesartan, Losartan, Olmesartan, Valsartan
Sartane – BfArM ordnet teils Ruhen der Zulassung an
Ruhen der Zulassung droht
BfArM macht bei Sartanen ernst

Auch in der EU
Wegen NDMA: Endgültiges Aus für Ranitidin?
Das Ruhen ist zunächst befristet bis zum 01.04.2022. Die Heumann-Präparate sind nicht die einzigen Sartane, für die aktuell die Zulassung ruht. Bereits mit einem Bescheid vom 26. Februar 2020 hatte das BfArM „mit sofortiger Wirkung das Ruhen der Zulassung“ für bestimmte irbesartan-, valsartan- und olmesartanhaltige Mono- und HCT-Kombipräparate der Hersteller Axcount Generika GmbH und HEC Pharm GmbH Arzneimittel angeordnet.
Warum müssen die Zulassungen ruhen?
Der Grund: Die Hersteller sartanhaltiger Arzneimittel waren auf EU-Ebene angehalten, ihre Herstellungsverfahren zur Vermeidung nitrosaminhaltiger Verunreinigungen in ihren Präparaten zu überprüfen. Offenbar sind manche pharmazeutischen Unternehmer diesen Verpflichtungen aus dem Umsetzungsbescheid vom 11.04.2019 bisher nicht oder nicht vollständig nachgekommen. Die Bundesoberbehörde ist in solchen Fällen befugt, das Ruhen der Zulassung befristet anzuordnen, und zwar „soweit dies erforderlich ist, um einem Beschluss der Europäischen Union nach Art. 34 der Richtlinie 2001/83/EG zu entsprechen“, begründet das BfArM sein Vorgehen.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.